2018-2019学年安徽省定远重点中学高二上学期第三次月考化学试题 解析版
安徽省定远重点中学2018-2019学年度上学期第三次月考
高二化学试题
本试卷满分100分,考试时间90分钟。请在答题卷上作答。
第I卷 选择题 (共48分)
一、选择题(本大题共24题,每题2分,满分48分,每小题只有一个正确答案)
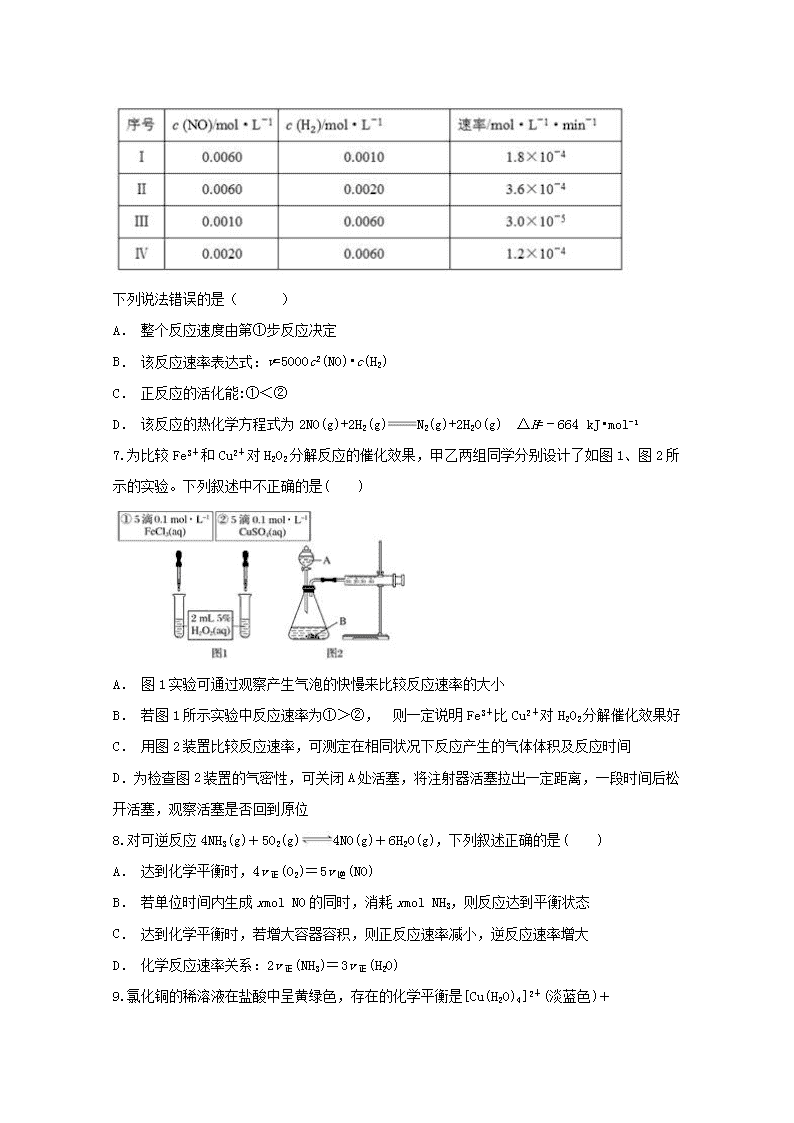
1.有关键能数据如下表所示:
则晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g) ===SiO2(s) ΔH=-989.2 kJ·mol-1,则x的值为( )
A. 460 B. 920 C. 1 165.2 D. 423.3
2.强酸和强碱在稀溶液中的中和热可表示为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-Q1kJ·mol-1
H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) ΔH=-Q2kJ·mol-1
HNO3(aq)+KOH(aq)===KNO3(aq)+H2O(l) ΔH=-Q3kJ·mol-1
则Q1、Q2、Q3的关系正确的是( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
3.氯原子对O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是③O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3 B. 反应O3+O===2O2的ΔH=E2-E3
C. O3+O===2O2是吸热反应 D. ΔH=ΔH1+ΔH2
4.已知热化学方程式:SO2(g)+O2(g)SO3(g) ΔH=-98.32 kJ·mol-1,在一定温度的密闭容器中充入2 mol SO2和1molO2充分反应,经过一段时间放出的热量为98.32 kJ,则容器中的压强与起始时压强的比值为( )
A. B. C. D.
5.用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
A. OE段表示的平均速率最快
B. EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D. G点表示收集的CO2的量最多
6.反应2NO(g)+2H2(g)N2(g)+2H2O(g)中,每生成7 g N2放出166 kJ的热量,该反应的速率表达式为v=k•cm(NO)•cn(H2)(k、m、n待测),其反应包含下列两步:①2NO+H2N2+H2O2(慢) ②H2O2+H22H2O(快)
T℃时测得有关实验数据如下:
下列说法错误的是( )
A. 整个反应速度由第①步反应决定
B. 该反应速率表达式:v=5000c2(NO)•c(H2)
C. 正反应的活化能:①<②
D. 该反应的热化学方程式为2NO(g)+2H2(g)N2(g)+2H2O(g) ΔH=﹣664 kJ•mol-1
7.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
A. 图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图1所示实验中反应速率为①>②, 则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
D. 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
8.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
9.氯化铜的稀溶液在盐酸中呈黄绿色,存在的化学平衡是[Cu(H2O)4]2+(淡蓝色)+
4Cl-[CuCl4]2-(黄绿色)+4H2O,下列可使溶液变成淡蓝色的方法是( )
A. 减少蒸馏水 B. 加硝酸银溶液
C. 加氯化钠固体 D. 加硫酸钠固体
10.两个体积相同带活塞的容器,分别盛装一定量的颜色相同的NO2(g)和Br2(g),迅速将两容器同时压缩到原来的一半(假设气体不液化),下列说法正确的是( )
A. a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅
B. a′,b′的颜色一样深
C. a′的压强比a的压强2倍要小,b′的压强为b的压强的2倍
D. a′中的c(NO2)一定比b′中的c(Br2)小
11.已知反应:A2(g)+2B2(g)2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度有利于该反应平衡正向移动
B. 达到化学平衡时,v正(A2)=2v逆(B2)
C. 升高温度,正向反应速率增加,逆向反应速率减小
D. 达到平衡后,降低温度A2气体的转化率增大
12.数据:7.2×10﹣4、4.6×10﹣4、4.9×10﹣10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2===HCN+NaNO2,②NaCN+HF====HCN+NaF,③NaNO2+HF===HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
A. HF的电离平衡常数为7.2×10﹣4
B. HNO2的电离平衡常数为4.9×10﹣10
C. 根据①③两个反应即可知三种酸的相对强弱
D. HNO2的电离平衡常数比HCN大,比HF小
13.醋酸溶液中存在电离平衡:CH3COOHH++CH3COO-,下列叙述不正确的是( )
A. 升高温度,平衡正向移动,醋酸的电离常数Ka增大
B. 0.10 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 25 ℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
14.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)
c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO+Cl2===2HCO+Cl-+ClO-
C. 向0.1 mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol· L-1的AgNO3溶液,CrO先形成沉淀
22.下列实验操作与预期实验目的或所得实验结论一致的是 ( )
23.已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
A. 向饱和AgCl水溶液中加入盐酸,Ksp值变大
B. AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C. 温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.Ksp(AgI)”或“=”,下同)7,乙方案中,说明醋酸是弱酸的理由是测得醋酸溶液的pH________2。
(3)请你评价乙方案的不妥之处:________________________________________________________________________
________________________________________________________________________。
26. (10分)化学学习小组进行如下实验。
[探究反应速率的影响因素]设计了如下的方案并记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol·L-1H2C2O4溶液、0.010 mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
(1)上述实验①、②是探究对化学反应速率的影响;若上述实验②、③是探究浓度对化学反应速率的影响,则a为;乙是实验需要测量的物理量,则表格中“乙”应填写。
[测定H2C2O4·xH2O 中x值] 已知:M(H2C2O4)=90 g·mol-1
①称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液;
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为 0.05 000 mol·L-1的 KMnO4标准溶液进行滴定。
(2)请写出与滴定有关反应的离子方程式_____________ 。
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是_____________
(选填 a、b)。
(4)由右图可知消耗KMnO4溶液体积为mL。
(5)滴定过程中眼睛应注视______________________。
(6)通过上述数据,求得x=_______。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果(偏大、偏小或没有影响) 。
27.(10分)50 mL 0.5 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)实验目的: ___________________________________________。
(2)实验用品:烧杯(500 mL和100 mL各1只)、温度计、塑料泡沫板(或硬纸板)、泡沫塑料或纸条、________(填写所缺的实验仪器);0.50 mol·L-1盐酸、0.55 mol·L-1NaOH溶液
(3)实验步骤:(略)
(4)问题与结论:
①完整地做一次这样的实验,需测定________次温度。
②大、小烧杯间填满碎纸条、大烧杯上加盖硬纸板的作用是________________。
③该实验中NaOH溶液的浓度大于盐酸浓度的作用是__________________。
④大烧杯上如不盖硬纸板,对求得中和热的数值有何影响:__________________________,理由: ____________________________________。
⑤改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1NaOH溶液进行反应,与上述实验相比,所放热量是否相等:____________;所求中和热数值是否相等: _________________。
28. (14分)为探究浓度对化学反应速率的影响,某学习兴趣小组中的甲、乙、丙三位同学均用如图所示实验装置进行相关实验(其中固体反应物来源相同),有关实验具体情况见下表。
回答下列问题:
(1)由甲同学的实验可以得出的结论是_____________________________________。
(2)由乙同学的实验能否得出“其他条件相同时,反应物浓度越大,化学反应速率越快”的结论? ________(填“能”或“不能”),原因是________________________。
(3)由丙同学的实验现象得出的结论明显与甲的不同,你认为造成这种不同的原因可能是________,请你设计出一种新的实验方案验证你的推测: _________。
(4)甲同学随后又通过实验探究了温度对化学反应速率的影响,试推测甲同学可能的实验方案为_____ ____。
29.(6分)已知在酸性溶液中,碘酸钾和亚硫酸钠会发生如下一些反应:
①++3H++ I-(慢)
②+5I-+6H+3I2+3H2O(慢)
③I2++ H2O2I-++3H+(快)
分别配制下面溶液:
溶液A:0.9 g碘酸钾溶于少量温水中,再稀释到500 mL。
溶液B:0.45 g亚硫酸钠配成溶液,稀释到500 mL。
溶液C:取5 g可溶性淀粉,放在小烧杯中,加入25 mL冷水,搅拌成悬浊液。另取200 mL水加热至沸腾,趁沸腾时倒入淀粉悬浊液并迅速搅拌,使淀粉糊化、溶解。到溶液冷却后边搅拌边慢慢加入12.5 mL浓硫酸,最后也稀释到500 mL。
溶液 D:200 mL水+50 mL A液+50 mL C液
溶液 E:225 mL水+25 mL A液+50 mL C液
试回答下列问题:
(1)根据实验原理,化学反应速率由哪步反应决定________。(填①、②、③)
(2)当哪种离子耗尽时才能见到溶液变蓝色________。(选填:I-、、H+、)
(3)在盛放D液和E液的两只烧杯里同时加入50 mL B液。D、E两烧杯哪个溶液先变蓝色________(填:D、E)
2018-2019学年度上学期第三次月考
高二化学试题答案解析
1.【答案】A
【解析】Si晶体与金刚石相似,一个硅原子与4个硅原子成键,每个化学键被两个硅原子共用,每消耗1 mol Si需要断裂2 mol的Si-Si;在二氧化硅晶体中,每个Si原子和4个O原子成键,生成1 mol SiO2形成4 mol Si-O键。化学反应的本质是化学键的先破后立,所以由键能可计算反应的焓变,即ΔH=反应物的总键能-生成物的总键能。ΔH=2×176 kJ·mol-1+498.8 kJ·mol-1-4xkJ·mol-1=-989.2 kJ·mol-1,x=460 kJ·mol-1。
2.【答案】C
【解析】57.3 kJ·mol-1是稀的强酸与强碱生成1 mol H2O(l)和可溶性盐时对应的中和热,当参加反应的酸或碱为弱电解质时,电离时需吸收热量,放出的热量小于57.3 kJ,Q1<57.3;浓硫酸溶于水放热,放出的热量大于57.3 kJ,Q2>57.3,综合可得放出的热量为Q2>Q3>Q1。
3.【答案】D
【解析】从能量关系图来看,ΔH=E3-E2,A、B错;从图中还可以看出反应物的总能量大于生成物的总能量,该反应放热,C错误;从物质角度看,反应③=①+②,根据盖斯定律,它们之间的函数关系同样适用于焓变,则ΔH=ΔH1+ΔH2,D正确。
4.【答案】D
【解析】物质在参加反应过程中放出或吸收的热量与此消耗的物质的量成正比,依据已知的热化学方程式计算出参加反应的SO2的物质的量进行解答。
最终放出热量98.3 2kJ,说明参加反应的SO2为1mol,则:
容器中的压强与起始时压强的比值为=。
5.【答案】D
【解析】斜率表示反应速率,斜率越大反应速率越大,EF段反应速率最大,A项错误;EF段生成的V(CO2)=672 mL-224 mL=448 mL,n(CO2)==0.02 mol,根据CaCO3+2HCl===CaCl2+CO2↑+H2O,可知参加反应的氯化氢为0.04 mol,盐酸的浓度变化量为=0.4 mol·L-1,v(HCl)=0.4 mol·L-1·min-1,B项错误;OE、EF、FG三段生成的二氧化碳体积分别为224 mL、448 mL、112 mL,用CO2表示的平均反应速率之比为224 mL∶448 mL∶112 mL=2∶4∶1,C项错误;G点表示收集的二氧化碳为从开始到G点生成的二氧化碳,共784 mL,D项正确。
6.【答案】C
【解析】本题考查了化学反应速率及化学反应与能量的变化。由信息可知,①反应速率慢,②反应速率快,所以整个反应速度由第①步反应决定,故A正确,不选。将Ⅰ和Ⅱ中的数据代入v=k•cm(NO)•cn(H2)可得:①1.8×10﹣4=k0.0060m×0.0010n,②3.6×10﹣4=k0.0060m×0.0020n,①除②可得:n=1,将Ⅲ和Ⅳ中的数据代入v=k•cm(NO)•cn(H2)可得:①3.0×10﹣5=k0.0010m×0.0060n,②1.2×10﹣4=k0.0020m×0.0060n,①除②可得:m=2,。将Ⅰ中的数据、m、n代入v=k•cm(NO)•cn(H2)可得:1.8×10﹣4=k0.00602×0.0010,解得k=5000,则该反应速率表达式:v=5000c2(NO)•c(H2
),故B正确,不选。化学反应速率与其活化能的大小密切相关,活化能越低,反应速率越快,因此降低活化能会有效地促进反应的进行,②反应的速率快,则活化能低,故C错,选C。7 g N2的物质的量为0.25 mol,则生成1 mol N2放出的热量为664 kJ,该反应的热化学方程式为2NO(g)+2H2(g)N2(g)+2H2O(g) ΔH=﹣664 kJ•mol-1,故D正确,不选。
7.【答案】B
【解析】若比较Fe3+和Cu2+对H2O2分解的催化作用,应选用Fe2(SO4)3(aq)和CuSO4(aq)。如果选用FeCl3(aq)和CuSO4(aq),虽然加入FeCl3(aq)的反应速率快,但可能是Cl-的催化作用。
8.【答案】A
【解析】A项,表明正、逆反应速率相等,反应达到平衡状态;B项,任何情况下消耗xmol NH3,必生成xmol NO;C项,减压时,正、逆反应速率均减小;D项,反应速率关系应为3v正(NH3)=2v正(H2O)。
9.【答案】B
【解析】减少蒸馏水相当于浓缩溶液,平衡向着减少微粒的方向移动(不含纯液体H2O),平衡正向移动,溶液变成黄绿色,A不符合题意。加硝酸银溶液,Ag++Cl-===AgCl↓,平衡逆移,B符合题意。加NaCl固体,增加Cl-浓度,平衡正向移动,C不符合题意;硫酸钠固体不影响平衡中各微粒浓度,平衡不移动, D不符合题意。
10.【答案】C
【解析】a→a′过程:2NO2(g)N2O4(g),容器体积缩小,颜色瞬间加深,压强增大,平衡正向移动,颜色略变浅,新平衡时各物质的浓度均比旧平衡大,最终颜色比原来深,A错误。 b→b′过程:体积减半,颜色加深,但其中不存在可逆反应,颜色不再改变,使b′中颜色应比a′的深,B错误。缩小体积时平衡移动,a′中物质的量比a中要少,a′的压强比a的压强2倍要小;b和b′中物质的量相等,b′的压强为b的压强的2倍,C正确。物质不同,即使两者颜色一样深,也不意味着c(NO2)和c(Br2)相等,所以a′中的c(NO2)与b′中的c(Br2)的浓度无法判断,D错误。
11.【答案】D
【解析】其他条件不变时,升高温度,正逆反应速率不同程度加快,平衡向吸热方向移动,尽可能削弱这种改变,反之亦然。该反应为放热反应,升温平衡逆向移动,A项错误;达到化学平衡时,不同物质表示的正逆速率之比与计量数比相同v正(A2)∶v逆(B2)=1∶2,B项错误;升温正、逆反应速率均增大,C项错误;降低温度平衡正向移动,反应物的转化率增大,D项正确。
12.【答案】B
【解析】强酸能和弱酸盐反应生成弱酸,根据反应可知,亚硝酸的酸性大于氢氰酸,氢氟酸的酸性大于亚硝酸,所以这三种酸的强弱顺序是:氢氟酸>亚硝酸>氢氰酸。所以氢氟酸的电离平衡常数最大,为7.2×10﹣4故A正确;亚硝酸的电离平衡常数为4.6×10﹣4,故B错误;根据强酸制取弱酸知,由①③两个反应即可知三种酸的相对强弱,故C正确;亚硝酸的酸性大于氢氰酸但小于氢氟酸,所以亚硝酸的电离平衡常数比HCN大,比HF小,故D正确;故选B。
13.【答案】D
【解析】弱电解质的电离平衡常数只受温度影响,升高温度电离平衡常数增大,A项正确;将溶液稀释,c(H+)减小,c(OH-)增大,B项正确;加入CH3COONa会抑制CH3COOH电离,C项正确;加入冰醋酸,溶液的pH、电离程度均减小,但电离常数不变,D项错误。
14.【答案】D
【解析】A项正确,c(H+)·c(OH-)=Kw为水的离子积表达式,它适用于水及稀溶液;B项正确,XZ线上任意点都有c(H+)=c(OH-),M区域位于直线XZ的左上侧,则M区域内任意点均有c(H+)0,升高温度,平衡正向移动,Kw增大,图中Z点Kw(Z)=(10-6.5)2=10-13,X点Kw(X)=(10-7)2=10-14,Kw(Z)>Kw(X),所以T19。因此,Ⅰ、Ⅱ曲线分别表示NaOH溶液和氨水稀释时溶液的pH变化曲线,a>9,A和B项都正确;稀释前pH=11的氨水和NaOH溶液比较,氨水的物质的量浓度大于NaOH溶液的物质的量浓度,完全中和稀释相同倍数后的两溶液,消耗相同浓度的稀H2SO4的体积V(NaOH) <
(3)难以配制pH=1的醋酸溶液,稀释之后用pH试纸测量不易读出准确数值
【解析】(1)准确配制溶液要用到容量瓶。
(2)CH3COONa溶液pH大于7说明CH3COO-水解,即证明CH3COOH是弱电解质。强酸每稀释10倍,pH应增大1个单位,若为强酸,稀释后pH应为2,如果小于2说明存在电离平衡,证明是弱酸。
26.【答案】(1)温度 1.0 溶液褪色时间/s
(2)5H2C2O4+2MnO+6H+===10CO2↑+2Mn2++8H2O
(3)b (4)20.00
(5)锥形瓶中颜色变化 (6)2 偏小
【解析】(1)探究影响化学反应速率因素,要求其他条件不变,即①、②探究温度对化学反应速率的影响,溶液体积都是6.0 mL,因此a=1.0,乙:溶液褪色时间/s。(2)草酸具有还原性,高锰酸钾具有强氧化性,把C转化成CO2,本身被还原成Mn2+,根据化合价升降法,进行配平,因此离子反应方程式为5H2C2O4+2MnO+6H+===10CO2↑+2Mn2++8H2O。(3)酸式滴定管盛放酸性溶液和氧化性物质,碱式滴定管只能盛放碱性溶液,即b正确;(4)滴定前刻度为0.90 mL,滴定后刻度是20.90 mL,消耗高锰酸钾的体积为(20.90-0.90) mL=20.00 mL;(5)滴定过程中,眼睛注视锥形瓶溶液颜色变化。(6)100 mL溶液中草酸物质的量为20×10-3×0.05×5×100/(2×25) mol=0.01mol,1.260/(90+18x)=0.01,解得x=2,未用待盛液润洗滴定管,稀释标准液,消耗高锰酸钾体积增大,草酸的质量增大,x偏小。
27.【答案】(1)测定中和热
(2)量筒、环形玻璃搅拌棒
(4)①3
②减少实验过程中的热量损失
③要保证盐酸反应完全
④偏小 热量散失
⑤不等 相等
【解析】 (1)实验目的是测定中和热。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、搅拌器以及量筒。
(4)①实验要测定酸、碱的初始温度以及反应后的最高温度,至少需要测量3次;②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;③用过量的NaOH保证盐酸反应完全,以盐酸的量为准计算生成的水量;④大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会偏小;⑤反应放出的热量与所用酸、碱的量有关,中和热是指酸、碱的稀溶液完全反应生成1mol水时的反应热。用60 mL 0.50
mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,生成水的物质的量增多,放出的热量增多,ΔH=-kJ·mol-1,中和热数值相等。
28.【答案】(1)在其他条件相同时,增大反应物的浓度,化学反应速率加快
(2)不能 HNO3与锌反应不产生H2,反应原理不同
(3)~(4)略(答案合理即可)
【解析】(1)甲同学所用的锌粉质量相同,反应的温度相同,外界压强相同,反应本质均是2H++Zn===Zn2++H2↑,溶液中其他成分也相同,不同的是B装置中酸的浓度比A中的大,因B中的化学反应速率大,故可以得出“在其他条件相同时,增大反应物的浓度,化学反应速率增大”这一结论。(2)由乙同学的实验不能得出上述结论,因为这两个反应不仅氢离子的浓度存在差别,溶液中还存在酸根离子的差别,更重要的是两个反应的原理不同,B中金属与硝酸间的反应不产生H2。(3)丙同学的实验反应本质与甲同学的相同,除酸根离子的种类不同外,其他条件完全相同,正常情况下产生气体的速率应相同,但实质上B中反应慢。这只能从酸根离子不同的角度进行思考:可能是SO对2H++Zn===Zn2++H2↑起抑制作用,也可能是Cl-对反应2H++Zn===Zn2++H2↑起催化作用。若要证明这种猜想是否正确,需要做进一步的实验:向A烧瓶中加入6.5 g锌粉,B烧瓶中加入6.5 g锌粉及适量的KCl固体,然后再通过分液漏斗分别向A、B两个烧瓶中加入100 mL,1 mol·L-1的硫酸,若B中反应速率比A中快,说明Cl-对此反应起催化作用;或者向A烧瓶中加入6.5 g锌粉,B烧瓶中加入6.5 g锌粉及适量的K2SO4固体,然后再通过分液漏斗分别向A、B两个烧瓶中加入100 mL 2 mol·L-1盐酸,若B中反应速率比A中慢,说明SO对此反应起抑制作用(相当于负催化剂)。(4)探讨温度对化学反应速率的影响时,只能使温度不同,其他各因素均应相同,故只要取相同体积、相同浓度的同一种酸,与相同质量的锌粉作用,并将其中的一个烧瓶放在热水中(也可以是加热)或放在冷水中,然后比较反应的快慢即可。
29.【答案】(1)①②
(2)
(3)D
【解析】(1)化学反应总速率总是由反应慢的一步决定,如木桶装水,水量多少总是由组装木桶的最短木板高度决定。
(2)溶液的蓝色,是因为存在I2,如果溶液中I2含量减少,蓝色变浅甚至消失;由反应知I2和强还原性的离子能反应,满足要求。
(3)溶液先变蓝色,说明反应速率快;对溶液来说,反应物浓度越高,反应速率越快,D中溶液先变蓝色。