- 2021-04-15 发布 |
- 37.5 KB |
- 49页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学实验题复习方略+复习模拟试题大全集
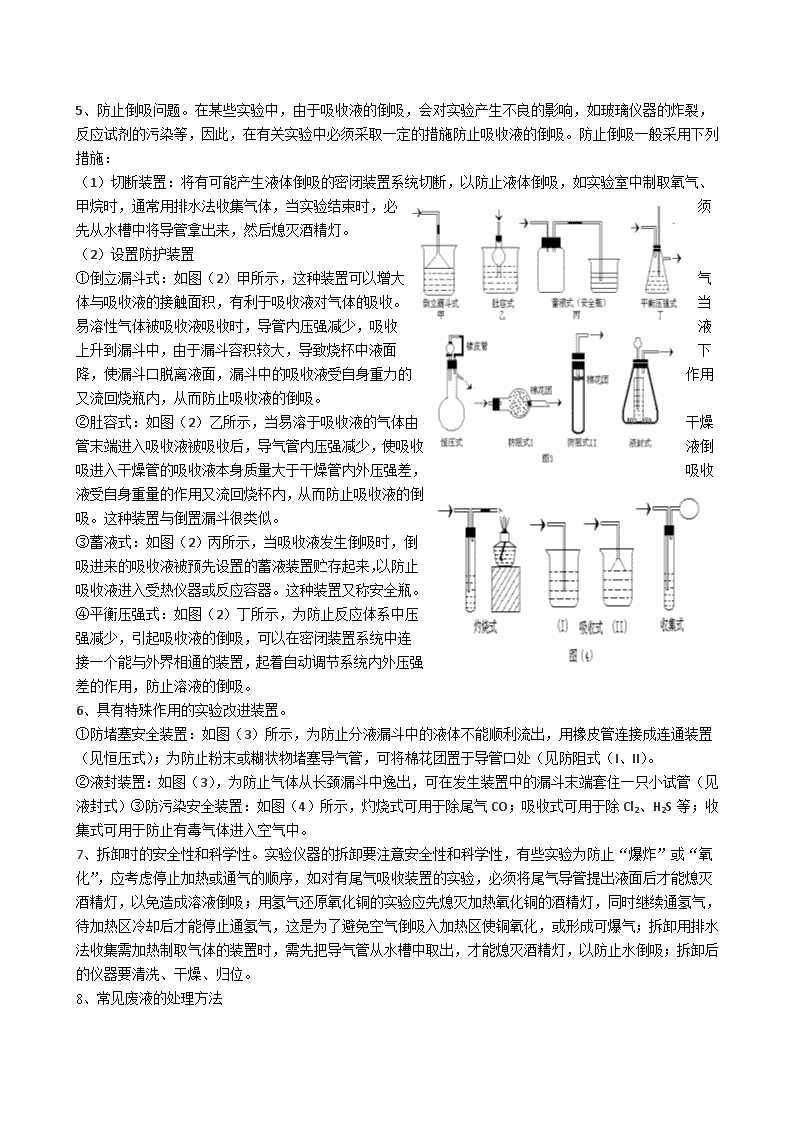
高考化学实验题复习方略+复习模拟试题大全集 高考化学实验题的答题策略(附参考答案) (一)解题思路及方法 1、思考问题的顺序 (1)围绕主要问题思考:如选择适当的实验路线、方法;所用药品、仪器简单易得;实验过程快速、安 全;实验现象明显。 (2)思考有关物质的制备、净化、吸收和存放等有关问题:如制取在空气中易水解的物质(如 Al2S3、AlCl3、 Mg3N2等)及易受潮的物质时,往往在装置末端再接一个干燥装置,以防止空气中水蒸气进入。 (3)思考实验的种类及如何合理地组装仪器,并将实验与课本实验比较、联靠。(如涉及到气体的制取和 处理,对这类实验的操作程序及装置的连接顺序大体可概括为: 发生 除杂质 干燥 主体实验 尾气处理。 2、仪器连接的顺序 (1)所用仪器是否恰当,所该仪器是全用还是选用; (2)仪器是否齐全,如制有毒气体及涉及有毒气体的实 验是否有尾气的吸收装置; (3)安装顺序是否合理,如是否遵循“自上而下,从左 到右”;气体净化装置中不应先经干燥,后又经过水溶液 洗气; (4)仪器间连接顺序是否正确。如洗气时“长进短出”,干燥管除杂质时“大进小出”,排水量气时“短 进气,长出水”等。 3、实验操作的顺序 (1)连接仪器,根据实验目的,注意事项,安全问题等,按气体流动顺序连接好实验仪器; (2)检查气密性,在整套仪器连接完毕后,应先检查装置的气密性,然后装入药品。检查装置气密性的 方法要依装置而定;如 1~6 的产气装置: (3)装药品进行实验操作。 二)解题时,应全方位思考的问题 1、检查气体的纯度。点燃或加热通有可燃性气体(H2、CO、CH4、C2H4、C2H2等)的装置前,必须检查气 体的纯度。例如用 H2、CO等气体还原金属氧化物时,需要加热金属氧化物,在操作中,不能先加热,后 通气,应当先通入气体,将装置内的空气排干净后,检查气体是否纯净(验纯),待气体纯净后,再点燃 酒精灯加热金属氧化物。 2、加热操作先后顺序选择。若气体产生需加热,应先用酒精灯加热产生气体的装置,等产生气体后,再 给实验需要加热的固体物质加热。例如用浓硫酸和甲酸共热产生 CO,再用 CO 还原 Fe2O3,实验时应首先 点燃 CO 发生装置的酒精灯,生成的 CO赶走空气后,再点燃 Fe2O3的酒精灯,而熄灭酒精灯的顺序则相反, 原因是:在还原性气体中冷却 Fe 可防止灼热的 Fe 再被空气中的 O2氧化并防石灰水倒吸。 3、冷凝回流的问题。有的易挥发的液体反应物,为了避免反应物损耗和充分利用原料,要在发生装置设 计冷凝回流装置。如在发生装置安装长玻璃管等。 4、冷却问题。有的实验为防止气体冷凝不充分而损失, 需用冷凝管或用冷水或冰水冷凝气体(物质蒸气),使 物质蒸气冷凝为液态便于收集。 5、防止倒吸问题。在某些实验中,由于吸收液的倒吸,会对实验产生不良的影响,如玻璃仪器的炸裂, 反应试剂的污染等,因此,在有关实验中必须采取一定的措施防止吸收液的倒吸。防止倒吸一般采用下列 措施: (1)切断装置:将有可能产生液体倒吸的密闭装置系统切断,以防止液体倒吸,如实验室中制取氧气、 甲烷时,通常用排水法收集气体,当实验结束时,必 须 先从水槽中将导管拿出来,然后熄灭酒精灯。 (2)设置防护装置 ①倒立漏斗式:如图(2)甲所示,这种装置可以增大 气 体与吸收液的接触面积,有利于吸收液对气体的吸收。 当 易溶性气体被吸收液吸收时,导管内压强减少,吸收 液 上升到漏斗中,由于漏斗容积较大,导致烧杯中液面下降, 使漏 斗口脱离液面,漏斗中的吸收液受自身重力的作用又流回 烧瓶 内,从而防止吸收液的倒吸。 ②肚容式:如图(2)乙所示,当易溶于吸收液的气体由 干燥 管末端进入吸收液被吸收后,导气管内压强减少,使吸收 液倒 吸进入干燥管的吸收液本身质量大于干燥管内外压强差, 吸收 液受自身重量的作用又流回烧杯内,从而防止吸收液的倒 吸。这种装置与倒置漏斗很类似。 ③蓄液式:如图(2)丙所示,当吸收液发生倒吸时,倒 吸进来的吸收液被预先设置的蓄液装置贮存起来,以防止 吸收液进入受热仪器或反应容器。这种装置又称安全瓶。 ④平衡压强式:如图(2)丁所示,为防止反应体系中压 强减少,引起吸收液的倒吸,可以在密闭装置系统中连接 一个能与外界相通的装置,起着自动调节系统内外压强差 的作用,防止溶液的倒吸。 6、具有特殊作用的实验改进装置。 ①防堵塞安全装置:如图(3)所示,为防止分液漏斗中的液体不能顺利流出,用橡皮管连接成连通装置 (见恒压式);为防止粉末或糊状物堵塞导气管,可将棉花团置于导管口处(见防阻式(I、II)。 ②液封装置:如图(3),为防止气体从长颈漏斗中逸出,可在发生装置中的漏斗末端套住一只小试管(见 液封式)③防污染安全装置:如图(4)所示,灼烧式可用于除尾气 CO;吸收式可用于除 Cl2、H2S 等;收 集式可用于防止有毒气体进入空气中。 7、拆卸时的安全性和科学性。实验仪器的拆卸要注意安全性和科学性,有些实验为防止“爆炸”或“氧 化”,应考虑停止加热或通气的顺序,如对有尾气吸收装置的实验,必须将尾气导管提出液面后才能熄灭 酒精灯,以免造成溶液倒吸;用氢气还原氧化铜的实验应先熄灭加热氧化铜的酒精灯,同时继续通氢气, 待加热区冷却后才能停止通氢气,这是为了避免空气倒吸入加热区使铜氧化,或形成可爆气;拆卸用排水 法收集需加热制取气体的装置时,需先把导气管从水槽中取出,才能熄灭酒精灯,以防止水倒吸;拆卸后 的仪器要清洗、干燥、归位。 8、常见废液的处理方法 废 液 处理方法 注意事项 酸或碱 中和法 分别收集,混合无危险时,将废酸、废 碱混合 氧化剂还原剂 氧化还原法 分别收集,查明废液性质,将其中一种 废液分次少量加入另一种废液中 含重金属离子废液 氢氧化物沉淀法硫化物共沉 淀法 用过滤或倾析法将沉淀分离,滤液不含 重金属离子再排放 含 Ba2+ 沉淀法 加入 Na2SO4溶液,过滤,除去沉淀,不 可排放 有机物 焚烧法有机溶剂萃取回收利 用 生成水、CO2等不污染环境;用溶剂萃 取分液,分馏后回收利用 9、常见意外事故的处理 意外事故 处理方法 洒在桌面的酒精燃烧 立即用湿抹布扑盖 酸洒在皮肤上 立即用较多的水冲洗(皮肤上不慎洒上浓 H2SO4,不得先用水 冲洗而要根据情况迅速用布擦去,再用水冲洗),再涂上 3%~5%的 NaHCO3溶液 碱洒在皮肤上 用较多的水冲洗,再涂上硼酸溶液 液溴、苯酚洒在皮肤上 用酒精擦洗 水银洒在桌面上 洒上硫粉进行回收 酸液溅到眼中 立即用水冲洗,边洗边眨眼睛 酒精等有机物在实验台上着火 用湿抹布、石棉或砂子盖灭,火势较大时,可用灭火剂扑救 四、例题分析 例 1、(06 年全国理综Ⅰ卷 28. 15 分) 在呼吸面具和潜水艇中可用过氧化纳作为供氧剂。请选 用 适当的化学试剂和实验用品、用上图中的实验装置进行 实 验,证明过氧化钠可作供氧剂。 (1)A 是制取 CO;的装置。写出 A 中发生反应的化学 方 程式: 。(2)填写表中空格: 仪器 加入试剂 加入该试剂的目的 B 饱和 NaHCO3溶液 C D (3)写出过氧化钠与二氧化碳反应的化学方程式: 。 (4)试管 F 中收集满气体后,下一步实验操作是: 。 【分析】 本题用给定的实验装置进行实验,证明过氧化钠可以用作供氧剂。题中包含对部分试剂的 选择、实验基本操作的考查,最后考生还应想到,需要证明实验中收集到的气体是氧气,该实验才能圆满 结束。由此进一步考查考生的实验基本功及对实验原理和实验目的的理解。题中明确指出实验装置中 A 是 制取 CO2的装置,考生熟悉的方法是,在锥形瓶中加入适量大理石(或石灰石),自分液漏斗中滴入稀盐酸 发生反应,其反应方程式为 CaCO3+2HCl═CaCl2+H2O+CO2↑。 反应产生的 CO2气体,连同水气、酸雾(HCl)一起进入洗气瓶 B 中,B 中加有饱和 NaHCO3溶液,其主要作 用是除去 CO2气体中的酸雾:NaHCO3+HCI═NaCl+H2O+ CO2 ↑ 同时 CO2在其中的溶解度比在水中小得多。c 中加有 Na2O2和石棉绒的混合物(加石棉绒的目的是防止气流 阻塞),CO2和水气在这里与 Na2O2,发生反应产生 O2。反应方程式为:2Na2O2+2 CO2═Na2CO3+ O2 2 Na2O2+2 H2O═4NaOH+ O2↑ 从 U 型管 c 出来的气体中,除 O2外,还有没反应的 CO2,如不除去这部分 CO2,它会与 O2一同收集在试 管 F 中,这将会对 O2的验证实验造成影响,因此在洗气瓶 D中应加入 NaOH 溶液,其目的是吸收未反应的 CO2。 在实验室制取气体时,除要选择适当的反应和合适的实验装置外,更重要的一点是,最后需要验证所 制得的气体,这一点考生应该是清楚的。本题虽然不是制备气体的实验,但它是要通过 Na2O2能与 CO2发 生反应产生 O2的实验来证明 Na2O2可以作为供氧剂。如果考生对本实验的目的比较明确,应该知道在试管 F 中集满气体后,还应证明试管 F 中收集的气体是 O2。正确的操作是:先把 E 中的导管移出水面,然后关 闭分液漏斗的活塞;用拇指堵住试管口,取出试管。立即把带火星的木条伸人试管口内,木条复燃则证明 试管中收集的气体是氧气。 参考答案:(1)CaCO3+2HCl=CaCl2+CO2+H2O (2)B:除去 CO2中混入的 HCl C:过氧化钠 与 CO2 和、H2O 反应产生 O2 D:NaOH 溶液吸收未反应的 CO2 (3)2Na2O2+2CO2=2Na2CO3+O2 (4)把 E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管 口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证 明 试管中收集的气体是氧气。 例 2、(05 年全国理综Ⅰ卷 28. 15 分)已知某纯碱试样中含有 NaCl 杂 质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。 主要实验步骤如下:① 按图组装仪器,并检查装置的气密性 ② 将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液 ③ 称量盛有碱石灰的 U 型管的质量,得到 b g ④ 从分液漏斗滴入 6 mol·L1的硫酸,直到不再产生气体时为止 ⑤ 从导管 A 处缓缓鼓入一定量的空气 ⑥ 再次称量盛有碱石灰的 U 型管的质量,得到 c g ⑦ 重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g 请填空和回答问题: (1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 (2)装置中干燥管 B 的作用是 (3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变) (4)步骤⑤的目的是 (5)步骤⑦的目的是 (6)该试样中纯碱的质量分数的计算式为 (7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。 【分析】 托盘天平是中学化学实验的基本仪器之一,按照规范操作,使用托盘天平时应当“左物,右码”, 如果所加砝码的质量与被称量物的质量相等,则天平两边达到平衡,其指针处于中央零点位置;如果天平 的指针向左偏转,则说明被称量物的质量大于所加砝码的质量,天平没有达到平衡。 本题的实验原理是:纯碱样品与足量稀 H2SO4反应释放出 CO2,U 型管中的碱石灰吸收 CO2后增重,测 量 U 型管增重,经换算可求得纯碱的质量分数。因此,在实验装置中,NaOH 溶液的作用是吸收自导管 A 处鼓入的空气中的 CO2;浓 H2SO4的作用是吸收反应产生的 CO2气体中的水蒸气;干燥管 B 的作用是防止 空气中的 CO2和水蒸气进入 U 型管中,这些措施都是为了保证测试的准确,使 U 型管的增重完全是由于吸 收纯碱试样与稀 H2SO4反应放出的 CO2而引起。若用相同浓度的盐酸替换分液漏斗中的稀 H2SO4,则在发生 的 CO2气体中必然会混有 HCl 气体,它不会被浓 H2SO4吸收,而是与 CO2一起被 U 型管中的碱石灰吸收, 这势必导致测试结果偏高。在实验中自导管 A 处缓缓鼓入空气,有助于使反应产生的 CO2全部逸出。在步 骤⑤中,第一次称重得到的质量 c g,并不能保证反应产生的 CO2已全部被 U 型管中的碱石灰吸收。在实 验中一般要多次重复步骤⑤和⑥的操作,直到恒重,即连续两次称量得到的 U 型管的质量基本不变,才能 说明 CO2已全部被吸收,实验可以结束。最终得到 U型管的质量为 d g。从 U 型管反应前后的增重(d-b)g, 可得到 n(CO2)= a bd 44 )( mol=n(Na2CO3),所以试样中纯碱的质量分数的计算式为 %100 44 )(106 a bd 本题还可以有其他实验方法,例如: 方法一:将 a g 试样溶于适量蒸馏水中配制成溶液,向其中加入过量 BaCl2溶液,得到 BaCO3沉淀,Ba2++ CO3 2- = BaCO3 ↓ 。 过 滤 , 洗 涤 沉 淀 , 干 燥 后 称 量 得 到 b g Ba CO3 , 则 样 品 中 n(BaCO3)= )BaCO( 3M b mol=n(Na2CO3),样品中纯碱的质量分数表达式为: aM b )BaCO( 106 3 ×100%。 方法二:将 a g 试样溶于适量蒸馏水中配制成溶液,向其中加入过量稀硝酸,充分搅拌至不再有气泡 产生,向溶液中加入 AgNO3 溶液至沉淀完全。过滤,洗涤沉淀,干燥后称量得到 c g AgCl,则 n(AgCl)= )AgCl(M c mol=n(NaCl),样品中 NaCl 杂质的质量分数表达式为: aM c )AgCl( M(NaCl) ×100%,所以纯碱的质量 分数表达式为:(1 一 aM c )AgCl( M(NaCl) )×100%。 参考答案:(1)样品重,砝码轻(2)防止空气中的 CO2和水气进入 U 型管中(3)偏高(4)把反应产 生的 CO2全部导入 U 型管中 (5)判断反应产生的 CO2是否全部排出,并被 U 型管中的碱石灰吸收 (6) %100 44 )(106 a bd (7)答案略。 例 3、下图中的实验装置可用于制取乙炔。请填空: (1)图中,A 管的作用是 。制取乙炔的化学方程式是 。 (2)乙炔通入 KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。 (3)乙炔通入溴的 CCl4溶液中观察到的现象是 ,乙炔发生了 反应。 05MCE228 (4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。 【分析】 本题的第(1)小题考查乙炔的制备。乙炔俗称电石气,因为在实验室里,乙炔是通过电石(碳化钙)和水 反应来制取的。反应方程式如下 CaC2十 2H2O = C2H2 + Ca(OH)2 可以采用不同的仪器来组装制备乙炔的实验装置,但每一种装置都必须保证能有效地控制水和电石的 反应。教科书绘制的装置将电石放在平底烧瓶内,水放在分液漏斗中,通过控制水的滴加来控制反应的发 生和停止。本试题绘制的装置将电石放置在玻管中的铁丝网上,将水放在玻管的下半部,并用橡胶管与另 一装水的玻管连接,组成一个能调节水面高度的连通器,以此来控制电石和水反应的发生和停止。从外形 看,这两种装置是不相同的,但从控制反应进程而言,这两种装置的作用是一样的。因此,本试题不仅考 查了制备乙炔的反应、制备乙炔的实验方法和相关知识,也考查了考生迁移知识的能力。 本题的第(2)小题考查乙炔的性质。乙炔在分子结构上类似于乙烯,分子中含有碳碳三键,碳碳三键中 有两个键较易断裂,因此乙炔在化学性质上也和乙烯类似,易被高锰酸钾氧化,从而使高锰酸钾的紫色褪 去;易发生加成反应,例如乙炔和溴加成能使溴的红色褪去。反应式如下. 上述两种反应都伴随有明显的现象变化,因 此常常用来鉴别碳碳不饱和键。(2)(3)小题的 考核内容和教科书中的基本内容相同,题目 并不难。但题目以乙炔为典型化合物,反映了炔类化合物的通性,题目以乙炔和高锰酸钾的反应和乙炔和 溴水的反应为例,突出了仔细观察实验现象的重要性。重视基础知识的教学、重视举一反三能力的培养和 重视认真观察事物变化的习惯的养成都是教学工作中的基本要素。 本题的第(4)小题强调了安全操作。乙炔和空气(或氧气)的混合物遇火时可能会发生爆炸,乙炔在空气 中的爆炸极限是含乙炔体积分数 2·5%~80%,因此在点燃乙炔前,必须先检查其纯度。实际上,安全操 作在化学工作中是相当重要的,在接触或使用一个化合物时,都应该先查阅相关书籍或手册,了解它的各 种性能如毒性、可燃性、可爆性等,以便采用规范的安全的操作方法来开展工作。有机化合物易燃,含碳 量高的有机物燃烧时因碳燃烧不完全常常会产生浓的黑烟,乙炔的成分里含碳量很大,所以燃烧时会发出 明亮而带浓烟的火焰。这也是乙炔的一个特性。 参考答案: 1 CaC2+2H2O Ca(OH)2+C2H2 2 KMnO4溶液褪色; 氧化 3 溴的四氯化碳溶液褪色; 加成 4 检查乙炔的纯度;火焰明亮并伴有浓烈的黑烟 例题 4.(2003年春北京,26)为了检验 Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁 架台、铁夹和加热设备均略去) 实验时在试管中放入研细的 Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有 少量液体 X,集气瓶中收集到无色气体 Y。(如图) 回答下面问题: (1)在装置中试管和 U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因 是 。(2)液体 X可能是 ;气体 Y可能是 。 (3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意 ,理由是 。 (4)用简单的实验证实(2)中的判断①对 X的判断 ②对 Y的判断 (要求:怎样从水槽中取出集气瓶、实验方法、现象、结论) 解析:解此题的两个关键知识点是:①2Pb(NO3)2 2PbO+4NO2+O2,②2NO2===N2O4。由此可知 X 为 N2O4,Y为 O2。 参考答案:(1)NO2气体会腐蚀橡胶 (2)N2O4(答液态的 NO2同样给分) O2 (3)先把导气管移出水面,然后熄灭火焰 防止水槽中的水反吸到 U型管中。 (4)①在通风橱中取下 U型管放置,观察到 U型管中液体迅速消失,管中充满红棕色气体,证明 X是 液态 N2O4。(其他合理答案同样给分) ②在水槽中,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星 的木条插入瓶口,木条迅速燃烧,证明 Y是 O2。 例题 5.(2002年上海,26) 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业 用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。 乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还有可能含有少 量还原性的杂质气体,由此他提出必须先除去 之,再与溴水反应。 请回答问题:(1)写出甲同学实验中两个主 要的化学方程式 。 (2)甲同学设计的实验 (填能或不 能 )验证乙炔与溴发生加成反应,其理由 是 。 (a)使溴水褪色的反应,未必是加成反应 (b) 使溴水褪色的反应,就是加成反应 (c)使溴水褪色的物质,未必是乙炔 (d)使溴水褪色的物质,就是乙炔 (3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式 是 。验证过程中必须全部除去。 (4)请你选用上列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装 置内所放的化学药品。 (5)为验证这一反应是加成而不是取代,丙同学提出可用 pH 试纸来测试反应后溶液的酸性,理由 是 。 解析:(1)本小题是按实验目的,写出实验原理的有关化学反应式,只要基础扎实,很容易写出化学方 程式,见答案。(2)根据“乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙 炔中还有可能含有少量还原性的杂质气体”,因此可得出“使溴水褪色的物质,未必是乙炔;使溴水褪色 的反应,未必是加成反应”的结论。故甲同学设计的实验不能证明乙炔与溴水发生了加成反应。(3)根据褪 色后的溶液里有少许淡黄色浑浊,可推知是硫,说明乙炔气体中含有硫化氢杂质,所发生的反应式是 Br2+H2S===S↓+2HBr。产生硫化氢的原因是电石中含有硫化钙杂质,发生的反应是 CaS+2H2O===H2S↑+Ca(OH)2。 (4)由于乙炔中含有硫化氢杂质,首先可利用 CuSO4溶液除去 H2S,然后再用 CuSO4溶液检验 H2S有无除 净,只有无 H2S存在方可根据溴水的褪色来验证乙炔与溴水是发生了加成反应。(5)用 pH试纸是验证溶液 的酸碱性的,实际上暗示“若发生取代反应,必定生成 HBr”的结论,因此可用 pH试纸检验溶液酸性有 无明显增强,即可得出结论。 参考答案:(1)CaC2+2H2O C2H2↑+Ca(OH)2 HC≡CH+Br2 CH(Br)== CH(Br)[或 HC≡CH+2Br2 CH(Br)2—CH(Br)2] (2)不能 (a)(c) (3)H2S Br2+H2S===S↓+2HBr (4)c b (CuSO4溶液) (CuSO4溶液) (5)如若发生取代反应,必定生成 HBr,溶液酸性将会明显增强,故可用 pH试纸来验证 一、导气管的连接 一般应遵循装置的排列顺序。对于吸收装置,若为洗气瓶则应“长”进(利于杂质的充分吸收)“短”出 (利于气体导出);若为盛有碱石灰的干燥管吸收水分和 ,则应“粗”进(同样利用 和水蒸气的充分 吸收)“细”出(利于余气的导出);若为了排水量气时,应“短”进“长”出,被排出水的体积即为生成 气体的体积。 二、仪器的连接 根据实验原理选择仪器和试剂,根据实验的目的决定仪器的排列组装顺序,一般遵循气体制取→除杂→干 燥→主体实验→实验产品的保护与尾气处理。其中除杂与干燥的顺序,若采用溶液除杂则应先净化后干燥。 尾气处理一般用溶液吸收或将气体点燃。 三、气密性的检查 制气装置一般都存在气密性检查问题。关键是何时进行气密性检查?如何进行气密性检查?显然应在仪器 连接完之后,添加药品之前进行气密性检查。气密性检查的方法虽多种多样,但总的原则是堵死一头,另 一头通过导管插入水中,再微热(用掌心或酒精灯)容积较大的玻璃容器,若水中有气泡逸出,停止加热 后导管中有一段水柱上升,则表示气密性良好,否则须重新组装与调试。 四、防倒吸 用溶液吸收气体或排水集气的实验中都要防倒吸。防倒吸一般可分为两种方法:一是在装置中防倒吸(如 在装置中加安全瓶或用倒扣的漏斗吸收气体等);二是在加热制气并用排水集气或用溶液洗气的实验中, 实验结束时,应先取出插在溶液中的导管,后熄灭酒精灯以防倒吸。 五、实验方案的评价 对实验方案的评价应遵循以下原则:①能否达到目的;②所用原料是否常见易得、廉价;③原料的利用率 高低;④过程是否简捷优化;⑤有无对环境污染;⑥ 实验的误差大小等等。能达到上述六点要求的实验 方案应该说不失为最优实验方案。最优方案的设计应遵循上述实验方案评价的六原则。方案确定后,为确 保实验目的实现,必须选择简捷而正确的操作程序。 六、实验结果的分析 实验是手段,要达到目的的还需对实验现象、实验数据进行科学的分析、处理,去伪存真,由表及里,剥 去假像方能识得庐山真面目。实验是培养学生科学品质与各种能力的有效手段和途径。一般从以下四方面 考虑:①方案是否合理,这是决定实验成败的关键;②操作不当引起的误差;③反应条件不足可导致反应 不能发生或反应速率过慢引起实验误差;④所用试剂不纯,杂质甚至参与反应均可导致实验误差等等。 高考化学实验题的答题策略(附参考答案) (一)解题思路及方法 1、思考问题的顺序 (1)围绕主要问题思考:如选择适当的实验路线、方法;所用药品、仪器简单易得;实验过程快速、安 全;实验现象明显。 (2)思考有关物质的制备、净化、吸收和存放等有关问题:如制取在空气中易水解的物质(如 Al2S3、AlCl3、 Mg3N2等)及易受潮的物质时,往往在装置末端再接一个干燥装置,以防止空气中水蒸气进入。 (3)思考实验的种类及如何合理地组装仪器,并将实验与课本实验比较、联靠。(如涉及到气体的制取和 处理,对这类实验的操作程序及装置的连接顺序大体可概括为: 发生 除杂质 干燥 主体实验 尾气处理。 2、仪器连接的顺序 (1)所用仪器是否恰当,所该仪器是全用还是选用; (2)仪器是否齐全,如制有毒气体及涉及有毒气体的实 验是否有尾气的吸收装置; (3)安装顺序是否合理,如是否遵循“自上而下,从左 到右”;气体净化装置中不应先经干燥,后又经过水溶液 洗气; (4)仪器间连接顺序是否正确。如洗气时“长进短出”,干燥管除杂质时“大进小出”,排水量气时“短 进气,长出水”等。 3、实验操作的顺序 (1)连接仪器,根据实验目的,注意事项,安全问题等,按气体流动顺序连接好实验仪器; (2)检查气密性,在整套仪器连接完毕后,应先检查装置的气密性,然后装入药品。检查装置气密性的 方法要依装置而定;如 1~6 的产气装置: (3)装药品进行实验操作。 二)解题时,应全方位思考的问题 1、检查气体的纯度。点燃或加热通有可燃性气体(H2、CO、CH4、C2H4、C2H2等)的装置前,必须检查气 体的纯度。例如用 H2、CO等气体还原金属氧化物时,需要加热金属氧化物,在操作中,不能先加热,后 通气,应当先通入气体,将装置内的空气排干净后,检查气体是否纯净(验纯),待气体纯净后,再点燃 酒精灯加热金属氧化物。 2、加热操作先后顺序选择。若气体产生需加热,应先用酒精灯加热产生气体的装置,等产生气体后,再 给实验需要加热的固体物质加热。例如用浓硫酸和甲酸共热产生 CO,再用 CO 还原 Fe2O3,实验时应首先 点燃 CO 发生装置的酒精灯,生成的 CO赶走空气后,再点燃 Fe2O3的酒精灯,而熄灭酒精灯的顺序则相反, 原因是:在还原性气体中冷却 Fe 可防止灼热的 Fe 再被空气中的 O2氧化并防石灰水倒吸。 3、冷凝回流的问题。有的易挥发的液体反应物,为了避免反应物损耗和充分利用原料,要在发生装置设 计冷凝回流装置。如在发生装置安装长玻璃管等。 4、冷却问题。有的实验为防止气体冷凝不充分而损失, 需用冷凝管或用冷水或冰水冷凝气体(物质蒸气),使 物质蒸气冷凝为液态便于收集。 5、防止倒吸问题。在某些实验中,由于吸收液的倒吸, 会对实验产生不良的影响,如玻璃仪器的炸裂,反应试剂的污染等,因此,在有关实验中必须采取一定的 措施防止吸收液的倒吸。防止倒吸一般采用下列措施: (1)切断装置:将有可能产生液体倒吸的密闭装置系统切断,以防止液体倒吸,如实验室中制取氧气、 甲烷时,通常用排水法收集气体,当实验结束时,必 须 先从水槽中将导管拿出来,然后熄灭酒精灯。 (2)设置防护装置 ①倒立漏斗式:如图(2)甲所示,这种装置可以增大 气 体与吸收液的接触面积,有利于吸收液对气体的吸收。 当 易溶性气体被吸收液吸收时,导管内压强减少,吸收 液 上升到漏斗中,由于漏斗容积较大,导致烧杯中液面下降, 使漏 斗口脱离液面,漏斗中的吸收液受自身重力的作用又流回 烧瓶 内,从而防止吸收液的倒吸。 ②肚容式:如图(2)乙所示,当易溶于吸收液的气体由 干燥 管末端进入吸收液被吸收后,导气管内压强减少,使吸收 液倒 吸进入干燥管的吸收液本身质量大于干燥管内外压强差, 吸收液受自身重量的作用又流回烧杯内,从而防止吸收液 的倒吸。这种装置与倒置漏斗很类似。 ③蓄液式:如图(2)丙所示,当吸收液发生倒吸时,倒 吸进来的吸收液被预先设置的蓄液装置贮存起来,以防止吸收液进入受热仪器或反应容器。这种装置又称 安全瓶。 ④平衡压强式:如图(2)丁所示,为防止反应体系中压强减少,引起吸收液的倒吸,可以在密闭装置系 统中连接一个能与外界相通的装置,起着自动调节系统内外压强差的作用,防止溶液的倒吸。 6、具有特殊作用的实验改进装置。 ①防堵塞安全装置:如图(3)所示,为防止分液漏斗中的液体不能顺利流出,用橡皮管连接成连通装置 (见恒压式);为防止粉末或糊状物堵塞导气管,可将棉花团置于导管口处(见防阻式(I、II)。 ②液封装置:如图(3),为防止气体从长颈漏斗中逸出,可在发生装置中的漏斗末端套住一只小试管(见 液封式)③防污染安全装置:如图(4)所示,灼烧式可用于除尾气 CO;吸收式可用于除 Cl2、H2S 等;收 集式可用于防止有毒气体进入空气中。 7、拆卸时的安全性和科学性。实验仪器的拆卸要注意安全性和科学性,有些实验为防止“爆炸”或“氧 化”,应考虑停止加热或通气的顺序,如对有尾气吸收装置的实验,必须将尾气导管提出液面后才能熄灭 酒精灯,以免造成溶液倒吸;用氢气还原氧化铜的实验应先熄灭加热氧化铜的酒精灯,同时继续通氢气, 待加热区冷却后才能停止通氢气,这是为了避免空气倒吸入加热区使铜氧化,或形成可爆气;拆卸用排水 法收集需加热制取气体的装置时,需先把导气管从水槽中取出,才能熄灭酒精灯,以防止水倒吸;拆卸后 的仪器要清洗、干燥、归位。 8、常见废液的处理方法 废 液 处理方法 注意事项 酸或碱 中和法 分别收集,混合无危险时,将废酸、废 碱混合 氧化剂还原剂 氧化还原法 分别收集,查明废液性质,将其中一种 废液分次少量加入另一种废液中 含重金属离子废液 氢氧化物沉淀法硫化物共沉 淀法 用过滤或倾析法将沉淀分离,滤液不含 重金属离子再排放 含 Ba2+ 沉淀法 加入 Na2SO4溶液,过滤,除去沉淀,不 可排放 有机物 焚烧法有机溶剂萃取回收利 用 生成水、CO2等不污染环境;用溶剂萃 取分液,分馏后回收利用 9、常见意外事故的处理 意外事故 处理方法 洒在桌面的酒精燃烧 立即用湿抹布扑盖 酸洒在皮肤上 立即用较多的水冲洗(皮肤上不慎洒上浓 H2SO4,不得先用水 冲洗而要根据情况迅速用布擦去,再用水冲洗),再涂上 3%~5%的 NaHCO3溶液 碱洒在皮肤上 用较多的水冲洗,再涂上硼酸溶液 液溴、苯酚洒在皮肤上 用酒精擦洗 水银洒在桌面上 洒上硫粉进行回收 酸液溅到眼中 立即用水冲洗,边洗边眨眼睛 酒精等有机物在实验台上着火 用湿抹布、石棉或砂子盖灭,火势较大时,可用灭火剂扑救 四、例题分析 例 1、(06 年全国理综Ⅰ卷 28. 15 分) 在呼吸面具和潜水艇中可用过氧化纳作为供氧剂。请选 用 适当的化学试剂和实验用品、用上图中的实验装置进行 实 验,证明过氧化钠可作供氧剂。 (1)A 是制取 CO;的装置。写出 A 中发生反应的化学 方 程式: 。(2)填写表中空格: 仪器 加入试剂 加入该试剂的目的 B 饱和 NaHCO3溶液 C D (3)写出过氧化钠与二氧化碳反应的化学方程式: 。 (4)试管 F 中收集满气体后,下一步实验操作是: 。 【分析】 本题用给定的实验装置进行实验,证明过氧化钠可以用作供氧剂。题中包含对部分试剂的 选择、实验基本操作的考查,最后考生还应想到,需要证明实验中收集到的气体是氧气,该实验才能圆满 结束。由此进一步考查考生的实验基本功及对实验原理和实验目的的理解。题中明确指出实验装置中 A 是 制取 CO2的装置,考生熟悉的方法是,在锥形瓶中加入适量大理石(或石灰石),自分液漏斗中滴入稀盐酸 发生反应,其反应方程式为 CaCO3+2HCl═CaCl2+H2O+CO2↑。 反应产生的 CO2气体,连同水气、酸雾(HCl)一起进入洗气瓶 B 中,B 中加有饱和 NaHCO3溶液,其主要作 用是除去 CO2气体中的酸雾:NaHCO3+HCI═NaCl+H2O+ CO2 ↑ 同时 CO2在其中的溶解度比在水中小得多。c 中加有 Na2O2和石棉绒的混合物(加石棉绒的目的是防止气流 阻塞),CO2和水气在这里与 Na2O2,发生反应产生 O2。反应方程式为:2Na2O2+2 CO2═Na2CO3+ O2 2 Na2O2+2 H2O═4NaOH+ O2↑ 从 U 型管 c 出来的气体中,除 O2外,还有没反应的 CO2,如不除去这部分 CO2,它会与 O2一同收集在试 管 F 中,这将会对 O2的验证实验造成影响,因此在洗气瓶 D中应加入 NaOH 溶液,其目的是吸收未反应的 CO2。 在实验室制取气体时,除要选择适当的反应和合适的实验装置外,更重要的一点是,最后需要验证所 制得的气体,这一点考生应该是清楚的。本题虽然不是制备气体的实验,但它是要通过 Na2O2能与 CO2发 生反应产生 O2的实验来证明 Na2O2可以作为供氧剂。如果考生对本实验的目的比较明确,应该知道在试管 F 中集满气体后,还应证明试管 F 中收集的气体是 O2。正确的操作是:先把 E 中的导管移出水面,然后关 闭分液漏斗的活塞;用拇指堵住试管口,取出试管。立即把带火星的木条伸人试管口内,木条复燃则证明 试管中收集的气体是氧气。 参考答案:(1)CaCO3+2HCl=CaCl2+CO2+H2O (2)B:除去 CO2中混入的 HCl C:过氧化钠 与 CO2 和、H2O 反应产生 O2 D:NaOH 溶液吸收未反应的 CO2 (3)2Na2O2+2CO2=2Na2CO3+O2 (4)把 E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管 口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证 明 试管中收集的气体是氧气。 例 2、(05 年全国理综Ⅰ卷 28. 15 分)已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数, 可用下图中的装置进行实验。 主要实验步骤如下:① 按图组装仪器,并检查装置的气密性 ② 将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液 ③ 称量盛有碱石灰的 U 型管的质量,得到 b g ④ 从分液漏斗滴入 6 mol·L1的硫酸,直到不再产生气体时为止 ⑤ 从导管 A 处缓缓鼓入一定量的空气 ⑥ 再次称量盛有碱石灰的 U 型管的质量,得到 c g ⑦ 重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g 请填空和回答问题: (1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 (2)装置中干燥管 B 的作用是 (3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填偏高、偏低或不变) (4)步骤⑤的目的是 (5)步骤⑦的目的是 (6)该试样中纯碱的质量分数的计算式为 (7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。 【分析】 托盘天平是中学化学实验的基本仪器之一,按照规范操作,使用托盘天平时应当“左物,右码”, 如果所加砝码的质量与被称量物的质量相等,则天平两边达到平衡,其指针处于中央零点位置;如果天平 的指针向左偏转,则说明被称量物的质量大于所加砝码的质量,天平没有达到平衡。 本题的实验原理是:纯碱样品与足量稀 H2SO4反应释放出 CO2,U 型管中的碱石灰吸收 CO2后增重,测 量 U 型管增重,经换算可求得纯碱的质量分数。因此,在实验装置中,NaOH 溶液的作用是吸收自导管 A 处鼓入的空气中的 CO2;浓 H2SO4的作用是吸收反应产生的 CO2气体中的水蒸气;干燥管 B 的作用是防止 空气中的 CO2和水蒸气进入 U 型管中,这些措施都是为了保证测试的准确,使 U 型管的增重完全是由于吸 收纯碱试样与稀 H2SO4反应放出的 CO2而引起。若用相同浓度的盐酸替换分液漏斗中的稀 H2SO4,则在发生 的 CO2气体中必然会混有 HCl 气体,它不会被浓 H2SO4吸收,而是与 CO2一起被 U 型管中的碱石灰吸收, 这势必导致测试结果偏高。在实验中自导管 A 处缓缓鼓入空气,有助于使反应产生的 CO2全部逸出。在步 骤⑤中,第一次称重得到的质量 c g,并不能保证反应产生的 CO2已全部被 U 型管中的碱石灰吸收。在实 验中一般要多次重复步骤⑤和⑥的操作,直到恒重,即连续两次称量得到的 U 型管的质量基本不变,才能 说明 CO2已全部被吸收,实验可以结束。最终得到 U型管的质量为 d g。从 U 型管反应前后的增重(d-b)g, 可得到 n(CO2)= a bd 44 )( mol=n(Na2CO3),所以试样中纯碱的质量分数的计算式为 %100 44 )(106 a bd 本题还可以有其他实验方法,例如: 方法一:将 a g 试样溶于适量蒸馏水中配制成溶液,向其中加入过量 BaCl2溶液,得到 BaCO3沉淀,Ba2++ CO3 2- = BaCO3 ↓ 。 过 滤 , 洗 涤 沉 淀 , 干 燥 后 称 量 得 到 b g Ba CO3 , 则 样 品 中 n(BaCO3)= )BaCO( 3M b mol=n(Na2CO3),样品中纯碱的质量分数表达式为: aM b )BaCO( 106 3 ×100%。 方法二:将 a g 试样溶于适量蒸馏水中配制成溶液,向其中加入过量稀硝酸,充分搅拌至不再有气泡 产生,向溶液中加入 AgNO3 溶液至沉淀完全。过滤,洗涤沉淀,干燥后称量得到 c g AgCl,则 n(AgCl)= )AgCl(M c mol=n(NaCl),样品中 NaCl 杂质的质量分数表达式为: aM c )AgCl( M(NaCl) ×100%,所以纯碱的质量 分数表达式为:(1 一 aM c )AgCl( M(NaCl) )×100%。 参考答案:(1)样品重,砝码轻(2)防止空气中的 CO2和水气进入 U 型管中(3)偏高(4)把反应产 生的 CO2全部导入 U 型管中 (5)判断反应产生的 CO2是否全部排出,并被 U 型管中的碱石灰吸收 (6) %100 44 )(106 a bd (7)答案略。 例 3、下图中的实验装置可用于制取乙炔。请填空: (1)图中,A 管的作用是 。制取乙炔的化学方程式是 。 (2)乙炔通入 KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。 (3)乙炔通入溴的 CCl4溶液中观察到的现象是 ,乙炔发生了 反应。 05MCE228 (4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。 【分析】 本题的第(1)小题考查乙炔的制备。乙炔俗称电石气,因为在实验室里,乙炔是通过电石(碳化钙)和水 反应来制取的。反应方程式如下 CaC2十 2H2O = C2H2 + Ca(OH)2 可以采用不同的仪器来组装制备乙炔的实验装置,但每一种装置都必须保证能有效地控制水和电石的 反应。教科书绘制的装置将电石放在平底烧瓶内,水放在分液漏斗中,通过控制水的滴加来控制反应的发 生和停止。本试题绘制的装置将电石放置在玻管中的铁丝网上,将水放在玻管的下半部,并用橡胶管与另 一装水的玻管连接,组成一个能调节水面高度的连通器,以此来控制电石和水反应的发生和停止。从外形 看,这两种装置是不相同的,但从控制反应进程而言,这两种装置的作用是一样的。因此,本试题不仅考 查了制备乙炔的反应、制备乙炔的实验方法和相关知识,也考查了考生迁移知识的能力。 本题的第(2)小题考查乙炔的性质。乙炔在分子结构上类似于乙烯,分子中含有碳碳三键,碳碳三键中 有两个键较易断裂,因此乙炔在化学性质上也和乙烯类似,易被高锰酸钾氧化,从而使高锰酸钾的紫色褪 去;易发生加成反应,例如乙炔和溴加成能使溴的红色褪去。反应式如下. 上述两种反应都伴随有明显的现象变化,因 此常常用来鉴别碳碳不饱和键。(2)(3)小题的 考核内容和教科书中的基本内容相同,题目 并不难。但题目以乙炔为典型化合物,反映了炔类化合物的通性,题目以乙炔和高锰酸钾的反应和乙炔和 溴水的反应为例,突出了仔细观察实验现象的重要性。重视基础知识的教学、重视举一反三能力的培养和 重视认真观察事物变化的习惯的养成都是教学工作中的基本要素。 本题的第(4)小题强调了安全操作。乙炔和空气(或氧气)的混合物遇火时可能会发生爆炸,乙炔在空气 中的爆炸极限是含乙炔体积分数 2·5%~80%,因此在点燃乙炔前,必须先检查其纯度。实际上,安全操 作在化学工作中是相当重要的,在接触或使用一个化合物时,都应该先查阅相关书籍或手册,了解它的各 种性能如毒性、可燃性、可爆性等,以便采用规范的安全的操作方法来开展工作。有机化合物易燃,含碳 量高的有机物燃烧时因碳燃烧不完全常常会产生浓的黑烟,乙炔的成分里含碳量很大,所以燃烧时会发出 明亮而带浓烟的火焰。这也是乙炔的一个特性。 参考答案: 1 CaC2+2H2O Ca(OH)2+C2H2 2 KMnO4溶液褪色; 氧化 3 溴的四氯化碳溶液褪色; 加成 4 检查乙炔的纯度;火焰明亮并伴有浓烈的黑烟 例题 4.(2003年春北京,26)为了检验 Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁 架台、铁夹和加热设备均略去) 实验时在试管中放入研细的 Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有 少量液体 X,集气瓶中收集到无色气体 Y。(如图) 回答下面问题: (1)在装置中试管和 U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因 是 。(2)液体 X可能是 ;气体 Y可能是 。 (3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意 ,理由是 。 (4)用简单的实验证实(2)中的判断①对 X的判断 ②对 Y的判断 (要求:怎样从水槽中取出集气瓶、实验方法、现象、结论) 解析:解此题的两个关键知识点是:①2Pb(NO3)2 2PbO+4NO2+O2,②2NO2===N2O4。由此可知 X 为 N2O4,Y为 O2。 参考答案:(1)NO2气体会腐蚀橡胶 (2)N2O4(答液态的 NO2同样给分) O2 (3)先把导气管移出水面,然后熄灭火焰 防止水槽中的水反吸到 U型管中。 (4)①在通风橱中取下 U型管放置,观察到 U型管中液体迅速消失,管中充满红棕色气体,证明 X是 液态 N2O4。(其他合理答案同样给分) ②在水槽中,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星 的木条插入瓶口,木条迅速燃烧,证明 Y是 O2。 例题 5.(2002年上海,26) 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业 用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。 乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还有可能含有少 量还原性的杂质气体,由此他提出必须先除去 之,再与溴水反应。 请回答问题:(1)写出甲同学实验中两个主 要的化学方程式 。 (2)甲同学设计的实验 (填能或不 能 )验证乙炔与溴发生加成反应,其理由 是 。 (a)使溴水褪色的反应,未必是加成反应 (b) 使溴水褪色的反应,就是加成反应 (c)使溴水褪色的物质,未必是乙炔 (d)使溴水褪色的物质,就是乙炔 (3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式 是 。验证过程中必须全部除去。 (4)请你选用上列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装 置内所放的化学药品。 (5)为验证这一反应是加成而不是取代,丙同学提出可用 pH 试纸来测试反应后溶液的酸性,理由 是 。 解析:(1)本小题是按实验目的,写出实验原理的有关化学反应式,只要基础扎实,很容易写出化学方 程式,见答案。(2)根据“乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙 炔中还有可能含有少量还原性的杂质气体”,因此可得出“使溴水褪色的物质,未必是乙炔;使溴水褪色 的反应,未必是加成反应”的结论。故甲同学设计的实验不能证明乙炔与溴水发生了加成反应。(3)根据褪 色后的溶液里有少许淡黄色浑浊,可推知是硫,说明乙炔气体中含有硫化氢杂质,所发生的反应式是 Br2+H2S===S↓+2HBr。产生硫化氢的原因是电石中含有硫化钙杂质,发生的反应是 CaS+2H2O===H2S↑+Ca(OH)2。 (4)由于乙炔中含有硫化氢杂质,首先可利用 CuSO4溶液除去 H2S,然后再用 CuSO4溶液检验 H2S有无除 净,只有无 H2S存在方可根据溴水的褪色来验证乙炔与溴水是发生了加成反应。(5)用 pH试纸是验证溶液 的酸碱性的,实际上暗示“若发生取代反应,必定生成 HBr”的结论,因此可用 pH试纸检验溶液酸性有 无明显增强,即可得出结论。 参考答案:(1)CaC2+2H2O C2H2↑+Ca(OH)2 HC≡CH+Br2 CH(Br)== CH(Br)[或 HC≡CH+2Br2 CH(Br)2—CH(Br)2] (2)不能 (a)(c) (3)H2S Br2+H2S===S↓+2HBr (4)c b (CuSO4溶液) (CuSO4溶液) (5)如若发生取代反应,必定生成 HBr,溶液酸性将会明显增强,故可用 pH试纸来验证 一、导气管的连接 一般应遵循装置的排列顺序。对于吸收装置,若为洗气瓶则应“长”进(利于杂质的充分吸收)“短”出 (利于气体导出);若为盛有碱石灰的干燥管吸收水分和 ,则应“粗”进(同样利用 和水蒸气的充分 吸收)“细”出(利于余气的导出);若为了排水量气时,应“短”进“长”出,被排出水的体积即为生成 气体的体积。 二、仪器的连接 根据实验原理选择仪器和试剂,根据实验的目的决定仪器的排列组装顺序,一般遵循气体制取→除杂→干 燥→主体实验→实验产品的保护与尾气处理。其中除杂与干燥的顺序,若采用溶液除杂则应先净化后干燥。 尾气处理一般用溶液吸收或将气体点燃。 三、气密性的检查 制气装置一般都存在气密性检查问题。关键是何时进行气密性检查?如何进行气密性检查?显然应在仪器 连接完之后,添加药品之前进行气密性检查。气密性检查的方法虽多种多样,但总的原则是堵死一头,另 一头通过导管插入水中,再微热(用掌心或酒精灯)容积较大的玻璃容器,若水中有气泡逸出,停止加热 后导管中有一段水柱上升,则表示气密性良好,否则须重新组装与调试。 四、防倒吸 用溶液吸收气体或排水集气的实验中都要防倒吸。防倒吸一般可分为两种方法:一是在装置中防倒吸(如 在装置中加安全瓶或用倒扣的漏斗吸收气体等);二是在加热制气并用排水集气或用溶液洗气的实验中, 实验结束时,应先取出插在溶液中的导管,后熄灭酒精灯以防倒吸。 五、实验方案的评价 对实验方案的评价应遵循以下原则:①能否达到目的;②所用原料是否常见易得、廉价;③原料的利用率 高低;④过程是否简捷优化;⑤有无对环境污染;⑥ 实验的误差大小等等。能达到上述六点要求的实验 方案应该说不失为最优实验方案。最优方案的设计应遵循上述实验方案评价的六原则。方案确定后,为确 保实验目的实现,必须选择简捷而正确的操作程序。 六、实验结果的分析 实验是手段,要达到目的的还需对实验现象、实验数据进行科学的分析、处理,去伪存真,由表及里,剥 去假像方能识得庐山真面目。实验是培养学生科学品质与各种能力的有效手段和途径。一般从以下四方面 考虑:①方案是否合理,这是决定实验成败的关键;②操作不当引起的误差;③反应条件不足可导致反应 不能发生或反应速率过慢引起实验误差;④所用试剂不纯,杂质甚至参与反应均可导致实验误差等等。 常见金属及其化合物(附参考答案) 一、选择题(每小题 5分,共 50分) 1.(2011·福建质检)合金是指两种或两种以上的金属(或金属与非金属)熔合 而成的具有金属特性的物质。分析下表中的数据,不能形成合金的是( ) Na[来源:Zxxk.Com] Cu Al Fe 熔点/℃ 97.8 1 083 660[来源:学科网] 1 535 沸点/℃ 883 2 567 2 467 2 750 A.Cu和 Al B.Fe和 Cu C.Fe和 Na D.Al和 Na 解析:要形成合金必须满足:形成合金的金属能同时处在液态。Cu 和 Al 在 1 083℃~2 467℃之间都是液态,Fe和 Cu在 1 535℃~2 567℃之间都是液态, Al 和 Na在 660℃~883℃之间都是液态,可以构成合金。而 Fe到达熔点时 Na 已经变为气态,不能形成合金,故选 C。[来源:学科网 ZXXK] 答案:C 2.(2011·郑州调研)在铁与铜的混合物中,加入一定量的稀硝酸,充分反应 后剩余金属 m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属 m2g, m1与 m2的关系是( ) A.m1一定大于 m2 B.m1可能等于 m2 C.m1一定等于 m2 D.m1可能大于 m2 解析:由题意知剩余金属可能为 Cu或 Cu与 Fe,但不论哪种情况,再加入 稀硫酸后,相当于加入稀硝酸(因溶液中含有 NO- 3,再加入硫酸引入 H+ 后,则 溶液中就相当于存在 HNO3),都可以使金属再溶解,所以 m1一定大于 m2。 答案:A 3.(2011·马鞍山二模)为测定某镁铝合金样品中铝的含量,进行了下列实验: 取一定量合金,加入 100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在 标准状况下体积为 560 mL;再加入 0.2 mol·L-1NaOH溶液至沉淀质量恰好不再 变化,用去 350 mL NaOH溶液。则所取样品中铝的物质的量为( ) A.0.005 mol B.0.01 mol C.0.025 mol D.0.03 mol 解析:镁铝合金溶于稀硫酸生成氢气 560 mL,即 0.025 mol H2,而硫酸为 0.03 mol,说明酸过量,余下 0.005 mol。合金反应后加入氢氧化钠溶液,沉淀不 再变化,铝变为 NaAlO2,镁变为Mg(OH)2。设 n(Al)=x mol,n(Mg)=y mol, 列式:1.5x+y=0.025,4x+2y=0.07-0.005×2,解得 x=0.01。 答案:B 4.(2011·惠州高三调研)Fe2O3、ZnO、CuO的固体混合粉末 a g,在加热条 件下用足量 CO还原,得到金属混合物 4.82 g,将生成的 CO2气体用足量的澄清 石灰水吸收后,产生 10.00 g白色沉淀,则 a的数值为( ) A.14.82 B.4.92 C.6.42 D.7.18 解析:金属氧化物与 CO反应生成金属单质和 CO2,根据反应前后氧原子变 化,CO2为 0.1 mol,则金属氧化物中氧原子为 0.1 mol,金属氧化物的质量等于 金属的质量加上氧原子的质量。 答案:C 5.某稀溶液中均含有 1 mol的 ZnSO4、Fe2(SO4)3、H2SO4、CuSO4,向其中 逐渐加入铁粉,溶液中 Fe2+的物质的量(纵坐标/mol)和加入铁粉的物质的量(横坐 标/mol)之间的关系为( ) 解析:与铁反应的离子有 2 mol Fe3+、2 mol H+ 、1 mol Cu2+,又因为氧化 性 Fe3+>Cu2+>H+ ,故加入铁粉时先后发生的反应为 2Fe3++Fe===3Fe2+; Cu2++Fe===Cu+Fe2+;2H+ 2 mol 1 mol 3 mol 1 mol 1 mol 1 mol 2 mol +Fe===Fe2++H2↑,A正确。 1 mol 1 mol 答案:A 6.铝、铍(Be)及其化合物具有相似的化学性质。已知反应:BeCl2+Na2BeO2 +2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是( ) A.Na2BeO2溶液的 pH>7,将其蒸干并灼烧后得到的残留物为 BeO B.BeCl2溶液的 pH>7,将其蒸干并灼烧后得到的残留物可能是 BeCl2 C.Be(OH)2既能溶于盐酸,又能溶于 NaOH溶液 D.BeCl2水溶液的导电性强,故 BeCl2是离子化合物 解析:蒸干并灼烧 Na2BeO2溶液后得到的残留物为 Na2BeO2;BeCl2是强酸 弱碱盐,其溶液 pH<7,蒸干并灼烧该溶液可得到 BeO;Be(OH)2和 Al(OH)3性 质相似,BeCl2和 AlCl3均是共价化合物。 答案:C 7.由 Na2O2、Na2CO3、NaHCO3、Na2O、NaCl中的某几种组成的混合物, 向其中加入足量的盐酸有气体放出。将气体通入足量的 NaOH溶液,气体体积 减小。将上述混合物在空气中加热,有气体放出且固体质量增加。下列判断正 确的是( ) A.混合物中一定不含 Na2CO3、NaCl B.混合物中一定有 Na2O2、NaHCO3、Na2O C.无法确定混合物中是否含有 NaHCO3 D.混合物中一定不含 Na2O2、NaCl 解析:混合物中加盐酸产生气体,气体通入 NaOH溶液后,体积减少,可 知气体成分为 CO2和 O2,则混合物中一定有 Na2O2,至少有 Na2CO3和 NaHCO3 中的一种;混合物在空气中加热,有气体放出且固体质量增加,则混合物中一 定有 NaHCO3。NaHCO3受热分解产物 CO2和 H2O,再与 Na2O2反应的质量变化 如下: 2 mol NaHCO3――→ △ 1 mol CO2 1 mol H2O ――→ Na2O21 mol O2 固体质量减小,而题给信息是固体质量增加,故一定还有 Na2O,而 Na2CO3 和 NaCl无法确定。 答案:B 8.在 pH为 4~5的环境中,Cu2+、Fe2+不生成沉淀,而 Fe3+几乎完全沉淀, 工业上制 CuCl2是将浓盐酸用蒸汽加热到 80℃左右,再慢慢加入粗氧化铜(含杂 质 FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是 ( ) A.加入纯 Cu将 Fe2+还原 B.向溶液中加入(NH4)2S使 Fe2+沉淀 C.直接加水加热使杂质离子水解除去 D.在溶液中通入 Cl2,再加入 CuO粉末调节 pH为 4~5 解析:有关反应为 CuO+2HCl=====80℃ CuCl2+H2O,FeO+2HCl=====80℃ FeCl2 +H2O,先通入氯气氧化 Fe2+:2FeCl2+Cl2===2FeCl3;再加入 CuO粉末,调节 pH为 4~5,使 Fe3+转化为 Fe(OH)3沉淀。 答案:D 9.(2009·上海化学)镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生 气体的体积(V)与时间(t)关系如下图。反应中镁和铝的( ) A.物质的量之比为 3:2 B.质量之比为 3:2 C.摩尔质量之比为 2:3 D.反应速率之比为 2:3 解析:由关系式:Mg~H2,2Al~3H2,可知产生等量 H2时,消耗 Mg、Al 的物质的量之比为 3:2,故 A项正确。二者质量之比为 4:3,摩尔质量之比为 24:27 =8:9,反应速率之比为 3:2。 答案:A 10.(2010·安徽理综)上图是三种稀酸对 Fe-Cr合金随 Cr含量变化的腐蚀 性实验结果,下列有关说法正确的是( ) A.稀硝酸对 Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 B.稀硝酸和铁反应的化学方程式是:Fe+6NHO3(稀)===Fe(NO3)3+3NO2↑ +3H2O C.Cr含量大于 13%时,因为三种酸中硫酸的氢离子浓度最大,所以对 Fe -Cr合金的腐蚀性最强 D.随着 Cr含量增加,稀硝酸对 Fe-Cr合金的腐蚀性减弱 解析:根据图可知,Cr的含量不同,三种酸对 Fe—Cr合金的腐蚀性不同, 当 w(Cr)较小时,稀硝酸对其腐蚀性最强,A不正确;铁与稀硝酸反应生成的是 NO而不是 NO2,B错;三种酸中由于溶液密度没有给出,硫酸中氢离子浓度不 一定最大,C错;根据图中稀 HNO3的曲线变化,可知 D正确。 答案:D 二、非选择题(共 50分) 11.(15分)下图中,A到 L为常见物质或该物质的水溶液,B在 A气体中 燃烧产生棕黄色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色, 组成 J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品 红溶液褪色。 回答下列问题: (1)K的电子式为________,所含的化学键有________。 (2)①若 D 的水溶液呈棕黄色,则 D的水溶液与 G反应的总离子方程式为 ________________________________________。 ②若D的水溶液呈蓝色,B与 C反应的化学方程式为___________ _________________________________。 (3)若将 F通入一定量 K的水溶液中,则所得溶液中各离子浓度一定满足的 关系式为____________________________________。 解析:(1)由 J的元素原子核内只有一个质子知 J为 H2;I的焰色反应为黄色, 所以 I含 Na元素;由金属 B在 A气体中燃烧产生棕黄色烟可知 A为 Cl2,B为 Fe或 Cu,则 D为 FeCl3或 CuCl2,且 D+G+H2O―→H+I+J,结合 I含 Na元 素知 G为金属钠,且 H2O+G―→K+J(H2),所以 K为 NaOH,其电子式为 Na +[··O ·· ·· ··H]-,含有离子键和极性共价键。 (2)①若 D的水溶液呈棕黄色,则 D为 FeCl3,其水溶液与 Na的反应为:6Na +2FeCl3+6H2O===2Fe(OH)3↓+6NaCl+3H2↑。 ②若 D的水溶液呈蓝色,则 D为 CuCl2,由 F为能使品红溶液褪色的无色 刺激性气体可知 F为 SO2,则 C为浓 H2SO4,B与 C的反应为: Cu+2H2SO4(浓)=====△ CuSO4+SO2↑+2H2O (3)无论什么电解质溶液一定满足电荷守恒关系: c(Na+)+c(H+)===c(OH-)+c(HCO- 3 )+2c(SO2-3 )。 答案:(1)Na+[··O ·· ·· ··H]- 离子键、共价键(或极性共价键) (2)①6Na+2Fe3++6H2O===2Fe(OH)3↓+6Na++3H2↑ ②Cu+2H2SO4(浓)=====△ CuSO4+SO2↑+2H2O (3)c(Na+)+c(H+)=c(OH-)+c(HCO- 3 )+2c(SO2-3 ) 12.(17分)(2011·重庆,26)用于金属焊接的某种焊条,其药皮由大理石、水 泥、硅铁等配制而成。 (1)Al的原子结构示意图为________;Al与 NaOH溶液反应的离子方程式为 ________。 (2)30Si原子的中子数为________;SiO2的晶体类型为________。 (3)Al3+与 Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性, 则该族元素的氢化物中沸点最低的是________。 (4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气 体是________。 (5)经处理后的熔渣 36.0g(仅含 Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分 离得到 11.0 g固体;滤液中加入过量 NaOH溶液,分离得到 21.4g固体;则此熔 渣中 Al2O3的质量分数为__________________________________。 解析:(1)Al的原子结构示意图为 ,Al与 NaOH溶液反应的离子 方程式为 2Al+2OH- +2H2O===2AlO- 2+3H2↑;(2)30Si原子的中子数为 30-14 =16,SiO2的晶体类型为原子晶体;(3)“Al3+与 Yn-的电子数相同,Y所在族的 各元素的氢化物的水溶液均显酸性”,则 Y是 F,第ⅦA族氢化物中沸点最低 的是 HCl,而不是 HF,因为 HF分子之间存在氢键。[来源:学+科+网] (4)“使金属不被氧化的气体”可由药皮的成分分析得出,大理石分解可生 成 CO2,CO2可以做保护气。 (5)“加入足量稀盐酸,分离得到 11.0 g固体”该固体为 SiO2;“滤液中加 入过量 NaOH溶液,分离得到 21.4g固体”,该固体为 Fe(OH)3,为 21.4g 107g/mol = 0.2 mol,故 Fe2O3为 0.1 mol,质量为 16 g,则 Al2O3的质量为(36.0 g-11.0 g- 16 g)=9 g,质量分数为 9g 36g ×100%=25%。 答案:(1) 2Al+2OH- +2H2O===2AlO- 2+3H2↑ (2)16 原子晶体 (3)HCl (4)CO2 (5)25% 13.(18分)(2011·福州模拟)Fe2O3和 Cu2O都是红色粉末,常用作颜料。某 校一化学实验小组通过实验来探究“红色”粉末是 Fe2O3还是Cu2O或二者混合 物。探究过程如下: [查阅资料]Cu2O是一种碱性氧化物,溶于稀硫酸生成 Cu和 CuSO4,在空气 中加热生成 CuO。 [提出假设] 假设 1:红色粉末是 Fe2O3 假设 2:红色粉末是 Cu2O 假设 3:红色粉末是 Fe2O3和 Cu2O的混合物 [设计实验]取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试 剂。 (1) 若 假 设 1 成 立 , 则 实 验 现 象 是 _______________________________________________________。 (2)若滴加 KSCN试剂后溶液不变血红色,则证明原固体粉末中一定不含三 氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应的 方 程 式 )__________ ______________________________________________________。 (3)若固体粉末完全溶解无固体存在,滴加 KSCN试剂时溶液不变血红色, 则 证 明 原 固 体 粉 末 是 _ _______ , 写 出 发 生 反 应 的 离 子 方 程 式 ________________________________________________。 [探究延伸]经实验分析,确定红色粉末为 Fe2O3和 Cu2O的混合物 。 (4)实验小组欲用加热法测定 Cu2O的质量分数。取 a g固体粉末在空气中充 分加热,待质量不再变化时,称其质量为 b g(b>a),则混合物中 Cu2O的质量分 数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资 料得知,在溶液中通过调节溶液的酸碱性而使 Cu2+、Fe2+、Fe 3+分别生成沉淀 的 pH如下: 物质 Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀 pH 6.0 7.5 1.4 沉淀完全 pH 13 14 3.7 实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3 实验小组设计如下实验方案: 试回答: ①试剂 1为________,试剂 2为________(填字母)。 ②固体 X的化学式为________。 ③操作Ⅰ为______________________________________。 答案:(1)固体完全溶解,溶液呈血红色[来源:学_科_网] (2)不合理 当原固体粉末为 Fe2O3和 Cu2O 的混合物时,加入稀 H2SO4后 Cu2O生成 Cu和 CuSO4,产生的 Fe3+与 Cu反应生成 Fe2+,滴加 KSCN溶液后 也可能不变红色 (3)Fe2O3和 Cu2O Fe2O3+6H+===2Fe3++3H2O, Cu2O+2H+===Cu+Cu2++H2O, 2Fe3++Cu===2Fe2++Cu2+ (4)9b-a a ×100% (5)①B D ②Fe(OH)3 ③加热浓缩,降温结晶 专题 8 电化学基础(附参考答案) 一、选择题(每小题 6分,共 60分) 1.(2010·天津理综)化学已渗透到人类生活的各个方面。下列说法不正确...的 是( ) A.阿司匹林具有解热镇痛作用 B.可以用 Si3N4、Al2O3制作高温结构陶瓷制品 C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 解析:阿司匹林是一种常见消炎药,A正确;Si3N4、Al2O3熔沸点高,可制 作高温结构陶瓷制品,B正确;在入海口,Fe、Cu、NaCl溶液构成原电池,Fe 作负极,加快了闸门的腐蚀,C错;四乙基铅易造成铅污染,D正确。 答案:C 2.(2011·安徽合肥高三调研)下列有关电池的说法中正确的是( )[来源:学科网] A.太阳能电池的主要材料是高纯度的二氧化硅 B.铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 C.氢氧燃料电池工作时,氢气在正极被氧化 D.锌锰干电池中,锌电极是负极 解析:太阳能电池的主要材料是硅而不是二氧化硅;在原电池中,电子从 负极沿外电路流向正极,氢氧燃料电池工作时,氢气在负极失电子被氧化。 答案:D 3.(2011·安庆二模)2010 年在上海举办的世博会主打环保牌,20辆氢燃料 电池公交车、300辆氢燃料电池出租车投入运行,它们以氢气为能源,实现了真 正的零污染。氢氧燃料电池的电解液为 KOH溶液,下列有关该电池的叙述不正 确的是( ) A.正极反应式为:O2+2H2O+4e-===4OH- B.工作一段时间后,电解液中 KOH的物质的量浓度不变 C.该燃料电池的总反应方程式为:2H2+O2===2H2O D.用该电池电解 CuCl2溶液,产生 2.24 L Cl2(标准状况)时,有 0.2 mol电 子转移 解析:该电池的总反应为:2H2+O2===2H2O,因此电解液中 n(KOH)不变, c(KOH)减小,B错。 答案:B 4.(2010·安徽理综)某固体酸燃料电池以 CsHSO4固体为电解质传递 H+ ,其 基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确 的是( ) A.电子通过外电路从 b极流向 a极 B.b极上的电极反应式为:O2+2H2O+4e-===4OH- C.每转移 0.1 mol电子,消耗 1.12L的 H2 D.H+ 由 a极通过固体酸电解质传递到 b极 解析:原电池反应中,正极上发生还原反应,负极上发生氧化反应,电子 从负极经外电路流向正极。H2发生氧化反应,a极为负极,b极为正极,负极反 应为:2H2-4e-===4H+ 或 2H2―→4H+ +4e- ,正极反应为:O2+4H+ +4e- ===2H2O或 O2+4H+ +4e-―→2H2O,故 A、B项错误;该反应中每转移 0.1 mol 电子,消耗标准状况下 1.12L H2,C项未指明标准状况,错误。 答案:D 5.(2011·浙江五校高三联考)CuI是一种不溶于水的白色固体,它可以由反 应:2Cu2++4I-===2CuI↓+I2而得到。如图所示装置中,a、b都是惰性电极, 通电一段时间后,在淀粉-KI 溶液中阳极周围变蓝色,则下列说法正确的是 ( ) A.若 a极变红,则在 Pt电极上:2I--2e-===I2 碘遇淀粉变蓝 B.若 b极变红,在 Pt电极上:4OH- -4e-===2H2O+O2↑O2将 I-氧化为 I2,碘遇淀粉变蓝 C.若 a极变红,在 Cu电极上:开始 Cu-2e-===Cu2+,一段时间后 2Cu 2+ +4I-===2CuI↓+I2 碘遇淀粉变蓝 D.若 b极变红,在 Cu极上:Cu-2e-===Cu2+ Cu2+显蓝色 解析:电解 NaCl溶液(滴入酚酞),阴极附近变红,若 a极变红,则 X为电 源的负极,Y为正极,故 Cu电极为阳极,则 Cu-2e-===Cu2+或 Cu―→Cu2++ 2e-,2Cu2++4I-===2CuI↓+I2,碘遇淀粉变蓝;若 b极变红,则 X为正极,Pt 电极为阳极,则 2I--2e-===I2或 2I-―→I2+2e-,碘遇淀粉变蓝,故 C正确。 答案:C 6.(2010·福建理综)铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=== 2PbSO4 +2H2O 研读下图,下列判断不正确...的是( ) A.K闭合时,d电极反应式: PbSO4+2H2O-2e-===PbO2+4H+ +SO2-4 B.当电路中转移 0.2 mol电子时, I中消耗的 H2SO4为 0.2 mol C.K闭合时,Ⅱ中 SO 2-4 向 c电极迁移 D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 解析:由图可知,Ⅰ为原电池,a为正极,b为负极,Ⅱ为电解池,c为阴 极,d为阳极。K闭合后,d电极上发生氧化反应,A对;当电路中通过 0.2 mol 电子时,有 0.1 mol的 Pb参加反应,由题中化学方程式可知消耗 H2SO4的量为 0.2 mol,B对;在电解池中,阴离子向阳极(d极)移动,C错;K闭合一段时间 后,阳极生成 PbO2,阴极上得到 Pb,所以Ⅱ可单独作为原电池,D对。 答案:C 7.(2011·江西重点中学联考)用下图装置(X、Y是直流电源的两极)分别进行 下列各组实验,则下表中所列各项对应关系均正确的一组是( ) 选项 电源 X极 实验前 U形管中 液体 通电后现象及结论 A 正极 Na2SO4溶液 U形管两端滴入酚酞试液后, a管中呈红色 B 正极 AgNO3溶液 b 管中电极反应式是:4OH- -4e-===2H2O+O2↑ C 负极 KCl 和 CuCl2 混 合溶液 相同条件下,a、b 两管中产 生的气体总体积可能相等 D 负极 [来源:学*科*网 Z*X*X*K] Fe(OH)3 胶体和 b管中液体颜色加深 导电液 解析:X为正极,电解 Na2SO4溶液时,实质是电解水,a管中电极为阴极, OH- 放电,a管中 c(H+)>c(OH-),滴加酚酞试液不变色,A错;X为正极,电解 AgNO3溶液时,b管中电极为阴极,电极反应式为 Ag+ +e-===Ag,B错;Fe(OH)3 胶体粒子带有正电荷,X为负极时,Fe(OH)3胶体粒子向 a管移动,a管中液体 颜色加深,D错。 答案:C 8.锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大 量推广,且对环境无污染。电池总反应式为 V2O5+xLi===LixV2O5。下列说法不 正确的是( ) A.正极材料为锂,负极材料为 V2O5 B.向外供电时,锂离子在凝胶中向正极移动 C.正极的电极反应式为:xLi++V2O5+xe-===LixV2O5 D.负极的电极反应式为:xLi-xe-===xLi+ 解析:利用化合价可知负极材料为锂,正极材料为 V2O5,A项错误;正极 的电极反应式为 xLi++V2O5+xe-===LixV2O5,负极的电极反应式为 xLi+-xe- ===xLi+,C、D两项正确;放电时为原电池,根据电荷相吸原理 Li+在凝胶中向 正极移动,B项正确。 答案:A 9.(2011·广东 A卷,12)某小组为研究电化学原理,设计如图装置。下列叙 述不正确的是( ) A.a和 b不连接时,铁片上会有金属铜析出 B.a和 b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu C.无论 a和 b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 D.a和 b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 解析:a和 b不连接时,发生置换反应,A项正确。a和 b用导线连接,形 成原电池,铜片作正极,溶液中 Cu2+得电子,析出铜单质,B项正确,铁片作 负极失去电子形成 Fe2+,溶液从蓝色逐渐变成浅绿色,所以 C 项正确。a 和 b 分别连接直流电源正、负极,a 作阳极,铜片失去电子形成 Cu2+,Cu2+向阴极 即铁电极移动,D项错误。 答案:D[来源:Zxxk.Com] 10.下列装置所示的实验不能达到实验目的的是( ) A.形成稳定电流的 装置 B.电解饱和食盐水 C.将用含有酚酞的 氯化钠溶液润湿的 滤纸铺在铂片上写 “祝你成功” D.电解精炼铝 解析:选项 A,能够形成原电池;选项 B,装置中的离子交换膜可以避免生 成的 Cl2与 NaOH溶液反应;选项 C,两电极都不参与电极反应,滤纸上的 NaCl 溶液被电解生成 NaOH、H2、Cl2,NaOH与酚酞作用出现“祝你成功”红色字 迹;选项 D,由于 AlCl3溶液中,H+ 得电子能力大于 Al3+,所以在纯铝电极上 得到的是 H2,而不是 Al。 答案:D 二、非选择题(共 40分) 11.(20分)(2011·北京,26)氯碱工业中电解饱和食盐水的原理示意图如上图 所示 (1)溶液 A的溶质是________; (2)电解饱和食盐水的离子方程式是____________________________ ___________________________________________________________。 (3)电解时用盐酸控制阳极区溶液的 pH在 2~3,用化学平衡移动原理解释 盐酸的作用:_______________________________________________。 (4)电解所用的盐水需精制,去除有影响的 Ca2 + 、Mg2 + ,NH + 4 , SO2-4 [c(SO2-4 )>c(Ca2+)]。精制流程如下(淡盐水和溶液 A来自电解池): ①盐泥 a除泥沙外,还含有的物质是________。 ②过程Ⅰ中将 NH + 4转化为 N2的离子方程式是___________________。 ③BaSO4的溶解度比 BaCO3的小。过程Ⅱ中除去的离子有________。 ④经过程Ⅲ处理,要求盐水 c中剩余 Na2SO3的含量小于 5mg /L,若盐水 b 中 NaClO的含量是 7.45 mg /L,则处理 10m3 盐水 b,至多添加 10% Na2SO3溶 液________kg(溶液体积变化忽略不计)。 解析:电解饱和食盐水时,阴极产物为 NaOH 和 H2,阳极产物是 Cl2,反 应的离子方程式是 2Cl-+2H2O=====电解 H2↑+Cl2↑+2OH- ,据此可以确定溶液 A 的溶质是 NaOH;电解时用盐酸控制阳极区溶液的 pH在 2~3的作用是促使化 学平衡 Cl2+H2O HCl+HClO向左移动,减少 Cl2在水中的溶解,有利于 Cl2 的逸出;根据粗盐水和淡盐水的化学成分,代入题给精制盐水的流程进行分析, 可知过程Ⅰ是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥 a除泥沙外,还含有的 物质是Mg(OH)2;将 NH + 4转化为 N2的氧化剂是 Cl2,对应的离子方程式是 2NH+ 4 +3Cl2+8OH-===N2↑+6Cl-+8H2O;过程Ⅱ是利用沉淀溶解平衡原理,将溶 液中的 Ca2+和 SO 2-4 分别转化为 CaCO3和 BaSO4沉淀除去;NaClO 与 Na2SO3 溶液反应的化学方程式为:NaClO+Na2SO3===NaCl+Na2SO4,若盐水b中NaClO 的含量是 7.45 mg/L,则处理 10 m3 盐水 b 时至少需要 10%Na2SO3 溶液 74.5 g 74.5 g·mol-1 ×126 g·mol-1× 100 10 =1.26 kg,若盐水 c 中剩余 Na2SO3的含量为 5 mg/L,则还需添加10% Na2SO3溶液50g÷10%=0.5 kg,因此至多添加10% Na2SO3 溶液的质量为 1.26 kg+0.5 kg=1.76 kg。[来源:学。科。网Z。X。X。K] 答案:(1)NaOH (2)2Cl-+2H2O=====电解 H2↑+Cl2↑+2OH- (3)Cl2与水反应:Cl2+H2O HCl+HClO,增大 HCl的浓度使平衡逆向移 动,减少 Cl2在水中的溶解,有利于 Cl2的逸出 (4)①Mg(OH)2 ②2NH+ 4 +3Cl2+8OH-===N2↑+6Cl-+8H2O ③SO2-4 、 Ca2+ ④1.76 12.(20分)某课外活动小组设计了如下图所示的装置,调节滑动变阻器,控 制电流强度适中的情况下用其进行缓慢电解 NaCl溶液及相关实验(此时,打开 止水夹 a,关闭止水夹 b)。由于粗心,实验并未达到预期目的,但也看到了令人 很高兴的现象(阳离子交换膜只允许阳离子和水通过)。 请帮助他们分析并回答下列问题: (1)写出 B装置中的电极反应: 阴极:_____________________________________________; 阳极:_____________________________________________。 (2)观察到 A装置中的现象是: ①__________________________________________________; ②______________________________________________ ____________________________________________________; ③_________________________________________________。 (3)当观察到 A 装置中的现象后,他们关闭止水夹 a,打开止水夹 b。再观 察 C装置,若无现象,请说明理由;若有现象,请写出有关反应的化学方程式(是 离 子 反 应 的 写 离 子 方 程 式 ) : ______________________________________________________。 (4)若想达到电解 NaCl 溶液的目的,应如何改进装置,请提出你的意见: ______________________________________________ __________________________________________________ ________________________________________________________。 解析:(1)阴极 H+ 放电,电极反应为:2H2O+2e-===H2↑+2OH-(2H+ +2e -===H2↑);阳极 Fe为活泼电极,故 Fe先失去电子,电极反应为:Fe-2e-===Fe2 + 。 (2)由于氢气通入烧瓶后,使氨气与水接触而引发喷泉,现象有:①A烧杯 中的水倒吸并产生红色喷泉;②烧瓶中液面上升到高于左侧导管一定程度后又 逐渐下落到与导管相平;③最后 A烧杯溶液呈红色,导管有气泡溢出。 (3)关闭止水夹 a,U型管左边气体不断生成,打开止水夹 b后,U型管右边 的 FeCl2溶液压入 NaOH溶液中,生成 Fe(OH)2沉淀:Fe2++2OH-===Fe(OH)2↓; Fe(OH)2不稳定,在空气中立即变成灰绿色,最后变成红褐色:4Fe(OH)2+2H2O +O2===4Fe(OH)3;或写成总反应式:4Fe2++8OH- +2H2O+O2===4Fe(OH)3↓。 (4)若想达到电解 NaCl溶液的目的,则阳极应为惰性电极,可把 Fe电极换成 C、 Pt等惰性电极或将装置中两电极换位置等。 答案:(1)2H2O+2e-===H2↑+2OH-(或 2H+ +2e-===H2↑) Fe-2e-===Fe2 + (2)①A烧杯中的水倒吸并产生红色喷泉 ②烧瓶中液面上升到高于左侧导 管一定程度后又逐渐下落至与导管相平 ③最后 A烧杯溶液呈红色,导管有气泡溢出 (3)Fe2++2OH-===Fe(OH)2↓,4Fe(OH)2+2H2O+O2===4Fe(OH)3或写成总 反应式:4Fe2++8OH- +2H2O+O2===4Fe(OH)3↓ (4)把 Fe电极换成 C、Pt等惰性电极或将装置中两电极换位置等 专题 6 化学反应速率和化学平衡(附参考答案) 一、选择题(每小题 6分,共 48分) 1.在一体积可变的密闭容器中,加入一定量的 X、Y,发生反应 mX(g) nY(g);ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、 气体体积的关系如下表所示: 下列说法正确的是( ) A.m>n B.Q<0 C.温度不变,压强增大,Y的质量分数减小 D.体积不变,温度升高,平衡向逆反应方向移动 解析:温度不变时(假设 100℃条件下),体积是 1L时 Y的物质的量为 1mol, 体积为 2L时,Y的物质的量为 0.75mol/L×2L=1.5mol,体积为 4L时,Y的物 质的量为 0.53mol/L×4L=2.12mol,说明体积越小,压强越大,Y的物质的量越 小,Y的质量分数越小,平衡向生成 X的方向进行,m查看更多