- 2021-04-15 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山西省大同市2021届高三化学上学期开学调研试题(Word版附答案)
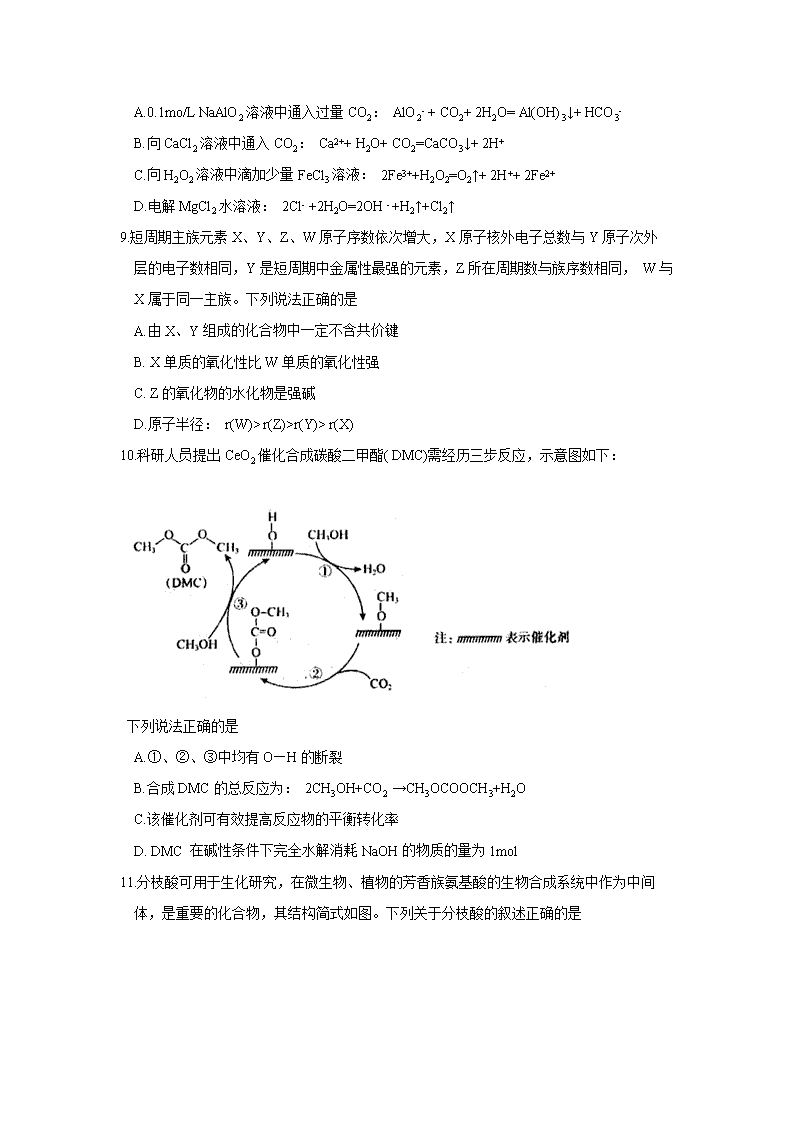
大同市2021届高三学情调研测试试题(卷) 化 学 注意事项: 1.答题前,考生务必将自己的姓名、准考证号填写在本试题相应的位置。 2.全部答案在答题卡上完成,答在本试题上无效。 3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。 如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案用0.5mm黑色笔迹签字笔写在答题卡上。. 4.考试结束后,将本试题和答题卡一并交回。 5.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分,考试时间90分钟。 可能用到的相对原子质量: H1 C12 O16 . N 14 P31 Cl35.5 Fe 56 Cu64 Zn 65 第I卷(选择题) 一、选择题:本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。 1.以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分 析不合理的是 A.宋代《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜,该颜料耐酸耐碱 B.《本草纲月》中有如下记载:“火药乃焰硝(KNO3)、硫黄、杉木炭所合,以为烽燧铳 机诸药者”,其中利用了KNO3的氧化性 C.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品 D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作 2.下列表示正确的是 A. N2分子的电子式: B.甲酸甲酯的结构简式: C2H4O2 C. CO2的比例模型: D.质子数为35、中子数为45的溴原子: Br 3.NA是阿伏加德罗常数的值。下列说法正确的是 A.22.4L (标准状况)氮气中含有7 NA个中子 B.1L 浓度为0.100mol/L.的Na2CO3溶液中,阴离子数为0.100NA C.12g 石墨烯和12 g金刚石均含有NA 个碳原子 D.0.1 mol Fe在足量氧气中燃烧,转移电子数为0.3NA 4.化学与生产、生活密切相关。下列有关物质的性质与用途具有对应关系的是 A. SO2具有氧化性,可用于漂白纸浆 B. BaCO3不溶于水,可用作医疗上检查肠胃的钡餐 C.石墨具有导电性,可用于制铅笔芯 D.明矾溶于水并水解形成胶体,可用于净水 5.下列说法不正确的是 A.根据纤维在火焰上.燃烧产生的气味,可以鉴别蚕丝与棉花 B.氨基酸是组成蛋白质的基本结构单元 C.涤纶、合成橡胶和有机玻璃均属于合成高分子化合物 D.煤的干馏和石油的分馏均属于化学变化 6.下列所示的物质间转化在给定条件下均能实现的是 A. NaBr (aq) Br2(aq) I2(aq) B. NaCl (aq) Cl2(g) 漂白粉(s) C. FeS2 SO2H2SO4 D. SiO2H2SiO3Na2SiO3 7.根据下列实验操作和现象所得到的结论正确的是 选项 实验操作和现象 结论 A 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 蛋白质发生了盐析 B 将数滴0.1mol·L-1MgSO4溶液滴入2mL 0.1mol·L -1NaOH溶液中充分反应,再滴加0.1 mol·L 1CuSO4溶液, 出现蓝色沉淀 Ksp[Cu(OH)2]查看更多