- 2021-04-15 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习素养提升专项练二含解析鲁科版
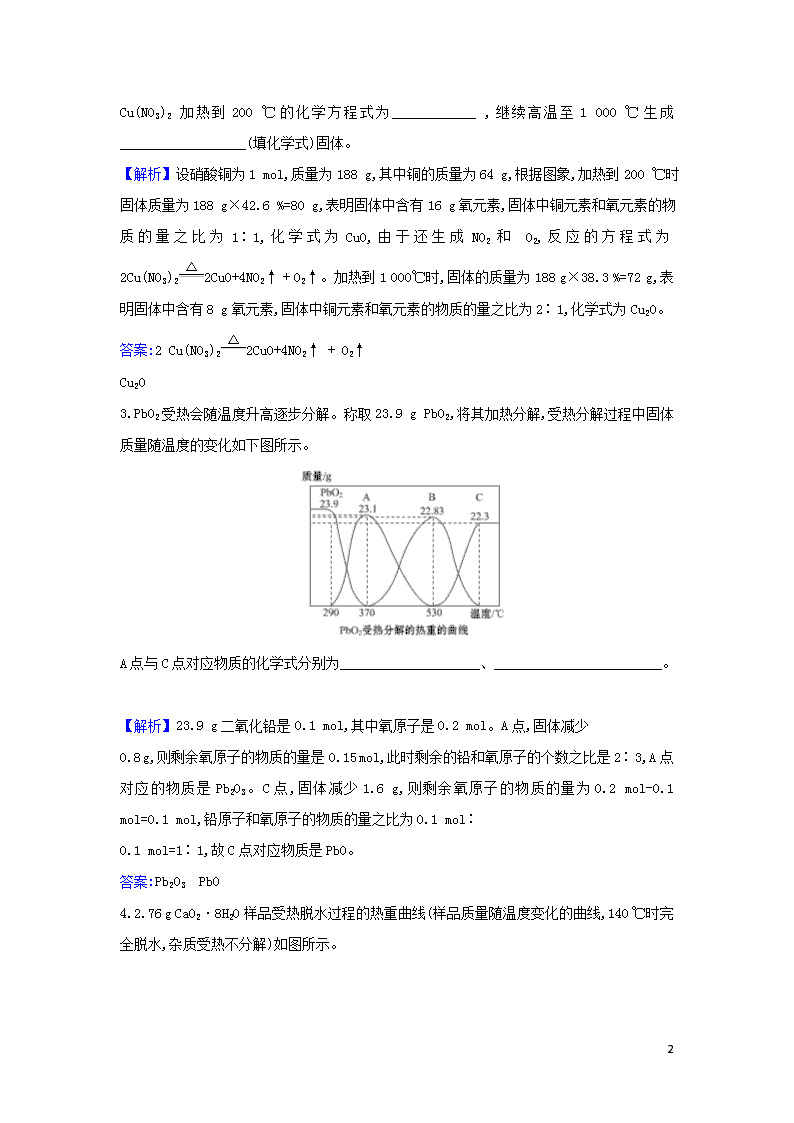
素养提升专项练 (二) (建议用时40分钟) 1.8.34 g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是 ( ) A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O B.温度为159 ℃时固体物质N的化学式为FeSO4·3H2O C.在隔绝空气条件下由N得到P的化学方程式为FeSO4FeO+SO3↑ D.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3 【解析】选D。A项,FeSO4·7H2O的物质的量为mol=0.03 mol,生成M时质量减小:8.34 g-6.72 g=1.62 g,故n(H2O)=0.09 mol,所以M的分子式为FeSO4·4H2O;B项,生成N时,n(H2O)=mol=0.18 mol,所以N的分子式为FeSO4·H2O;C项,生成P时,n(H2O)= mol=0.21 mol,所以P的分子式为FeSO4,化学方程式为FeSO4·H2OFeSO4+H2O;D项,生成P后继续加热为FeSO4的分解反应:2FeSO4Fe2O3+SO2↑+SO3↑。 2.下图为Cu(NO3)2样品高温过程的热重曲线(样品质量分数W%随温度变化的曲线),Cu(NO3)2受热分解有NO2与O2生成。 4 Cu(NO3)2 加热到200 ℃的化学方程式为____________ ,继续高温至1 000 ℃生成 __________________(填化学式)固体。 【解析】设硝酸铜为1 mol,质量为188 g,其中铜的质量为64 g,根据图象,加热到200 ℃时固体质量为188 g×42.6 %=80 g,表明固体中含有16 g氧元素,固体中铜元素和氧元素的物质的量之比为1∶1,化学式为CuO,由于还生成NO2和 O2,反应的方程式为2Cu(NO3)22CuO+4NO2↑ + O2↑。加热到1 000℃时,固体的质量为188 g×38.3 %=72 g,表明固体中含有8 g氧元素,固体中铜元素和氧元素的物质的量之比为2∶1,化学式为Cu2O。 答案:2 Cu(NO3)22CuO+4NO2↑ + O2↑ Cu2O 3.PbO2受热会随温度升高逐步分解。称取23.9 g PbO2,将其加热分解,受热分解过程中固体质量随温度的变化如下图所示。 A点与C点对应物质的化学式分别为____________________、________________________。 【解析】23.9 g二氧化铅是0.1 mol,其中氧原子是0.2 mol。A点,固体减少 0.8 g,则剩余氧原子的物质的量是0.15 mol,此时剩余的铅和氧原子的个数之比是2∶3,A点对应的物质是Pb2O3。C点,固体减少1.6 g,则剩余氧原子的物质的量为0.2 mol-0.1 mol=0.1 mol,铅原子和氧原子的物质的量之比为0.1 mol∶ 0.1 mol=1∶1,故C点对应物质是PbO。 答案:Pb2O3 PbO 4.2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线,140 ℃时完全脱水,杂质受热不分解)如图所示。 4 (1)试确定60 ℃时CaO2·xH2O中x=____________。 (2)该样品中CaO2的质量分数为__________________。 【解析】140 ℃后结晶水全部失去,其质量为2.76 g-1.32 g=1.44 g,物质的量为0.08 mol,则CaO2·8H2O的物质的量为0.01 mol,由CaO2·8H2O样品受热脱水过程的热重曲线可以看出60~140 ℃失去的结晶水的质量为1.68 g-1.32 g=0.36 g,物质的量为0.02 mol,则n(CaO2)∶n(H2O)=0.01∶0.02=1∶x,x=2。CaO2质量为72 g·mol-1×0.01 mol=0.72 g,则该样品中CaO2的质量分数为× 100 %=26.09 %。 答案:(1)2 (2)26.09% 5.碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。 (1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和________。 (2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为__________。 (3)为确定碱式碳酸铝镁的组成,进行如下实验: ①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。 ②另取一定量样品在空气中加热,样品的固体残留率(×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。 根据以上实验数据计算碱式碳酸铝镁样品中的n(OH- )∶n(C)(写出计算过程)。 【解析】(1)碱式碳酸铝镁之所以具有阻燃作用,除了受热分解需要吸收大量的热量外,还因为生成的高熔点的MgO、Al2O3和释放出的大量CO2也有阻燃作用。(2)根据电荷守恒有 4 n(Mg2+)×2+n(Al3+)×3=n(OH-)+n(C)×2,则2a+3b=c+2d。 答案:(1)生成的产物具有阻燃作用 (2)2a+3b=c+2d (3)n(CO2)==2.50×10-2 mol m(CO2)=2.50×10-2 mol×44 g·mol-1=1.10 g 在270~600 ℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O, m(CO2)+m(H2O)=3.390 g×(0.734 5-0.370 2)=1.235 g m(H2O)=1.235 g-1.10 g=0.135 g n(H2O)==7.50×10-3 mol n(OH-)=7.50×10-3 mol×2=1.50×10-2 mol n(OH-)∶n(C)=(1.50×10-2 mol)∶(2.50×10-2 mol)=3∶5。 4查看更多