- 2021-04-15 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届高考一轮复习人教版第四节金属的电腐蚀与防护学案
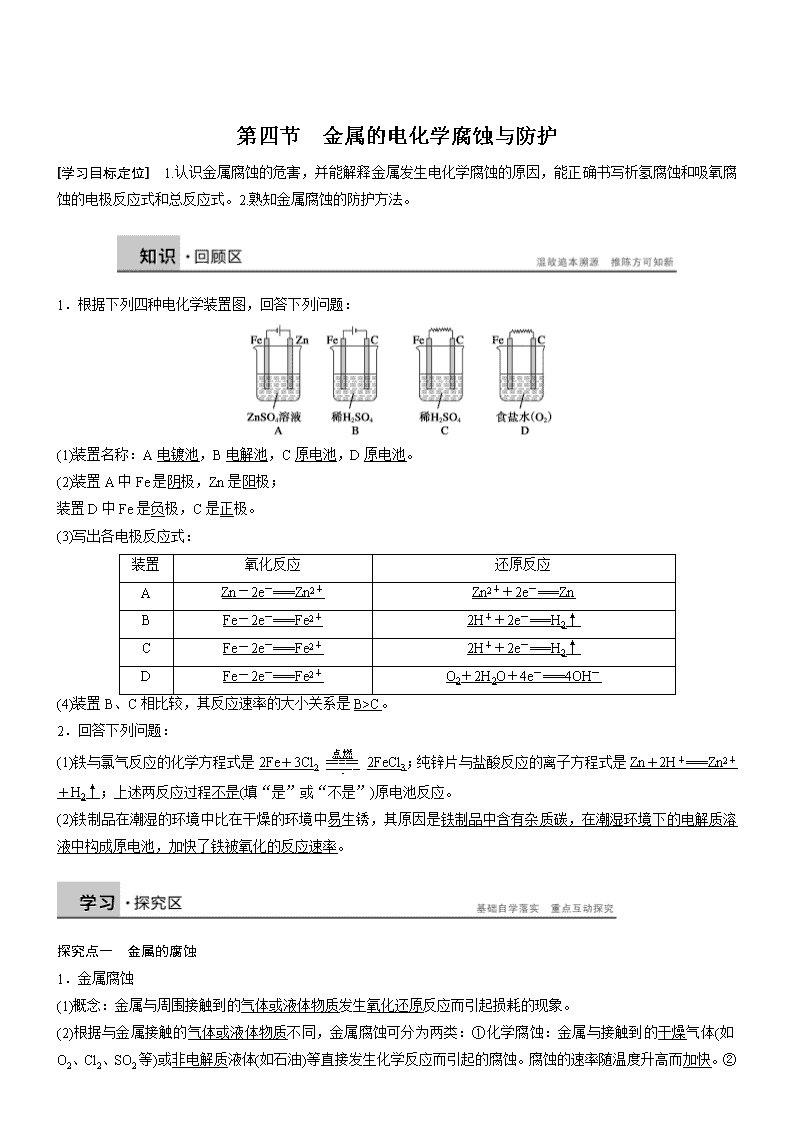
第四节 金属的电化学腐蚀与防护 [学习目标定位] 1.认识金属腐蚀的危害,并能解释金属发生电化学腐蚀的原因,能正确书写析氢腐蚀和吸氧腐蚀的电极反应式和总反应式。2.熟知金属腐蚀的防护方法。 1.根据下列四种电化学装置图,回答下列问题: (1)装置名称:A电镀池,B电解池,C原电池,D原电池。 (2)装置A中Fe是阴极,Zn是阳极; 装置D中Fe是负极,C是正极。 (3)写出各电极反应式: 装置 氧化反应 还原反应 A Zn-2e-===Zn2+ Zn2++2e-===Zn B Fe-2e-===Fe2+ 2H++2e-===H2↑ C Fe-2e-===Fe2+ 2H++2e-===H2↑ D Fe-2e-===Fe2+ O2+2H2O+4e-===4OH- (4)装置B、C相比较,其反应速率的大小关系是B>C。 2.回答下列问题: (1)铁与氯气反应的化学方程式是2Fe+3Cl22FeCl3;纯锌片与盐酸反应的离子方程式是Zn+2H+===Zn2++H2↑;上述两反应过程不是(填“是”或“不是”)原电池反应。 (2)铁制品在潮湿的环境中比在干燥的环境中易生锈,其原因是铁制品中含有杂质碳,在潮湿环境下的电解质溶液中构成原电池,加快了铁被氧化的反应速率。 探究点一 金属的腐蚀 1.金属腐蚀 (1)概念:金属与周围接触到的气体或液体物质发生氧化还原反应而引起损耗的现象。 (2)根据与金属接触的气体或液体物质不同,金属腐蚀可分为两类:①化学腐蚀:金属与接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀。腐蚀的速率随温度升高而加快。② 电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化。 (3)用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,这种腐蚀属于化学腐蚀,反应的化学方程式为2Al+6CH3COOH===2(CH3COO)3Al+3H2↑;若用铝饭盒盛放食盐(含水时),一段时间后,饭盒被腐蚀,这种腐蚀属于电化学腐蚀,反应原理是(写电极反应式和总反应式):负极:Al-3e-===Al3+,正极:O2+2H2O+4e-===4OH-,4Al+3O2+6H2O===4Al(OH)3。 2.钢铁的电化学腐蚀 根据钢铁表面水溶液薄膜的酸碱性不同,钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀,如下图所示: (1)钢铁的析氢腐蚀:当钢铁表面的电解质溶液酸性较强时,腐蚀过程中有H2放出。Fe是负极,C是正极。发生的电极反应式及总反应式为 负极:Fe-2e-===Fe2+; 正极:2H++2e-===H2↑; 总反应:Fe+2H+===Fe2++H2↑。 (2)钢铁的吸氧腐蚀:当钢铁表面的电解质溶液呈中性或呈弱酸性并溶有O2时,将会发生吸氧腐蚀。电极反应式及总反应式为 负极:2Fe-4e-===2Fe2+; 正极:2H2O+O2+4e-===4OH-; 总反应:2Fe+2H2O+O2===2Fe(OH)2。 最终生成Fe2O3·xH2O,是铁锈的主要成分。 [归纳总结] (1)影响金属腐蚀的因素 影响金属腐蚀的因素包括金属的本性和介质两个方面。就金属本性来说,金属越活泼,越容易失去电子而被腐蚀。介质对金属腐蚀的影响也很大,如果金属在潮湿的空气中,接触腐蚀性气体或电解质溶液,都容易被腐蚀。 (2)钢铁析氢腐蚀和吸氧腐蚀比较 因钢铁表面水膜酸碱性不同,钢铁发生析氢腐蚀和吸氧腐蚀,二者正极反应式不同,但负极反应式相同,都是铁失电子被氧化。 [活学活用] 1.下列有关金属腐蚀的说法中正确的是( ) A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程 B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程 C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈 D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生 答案 D 解析 金属腐蚀的本质,主要是金属原子失电子被氧化,腐蚀的内因是金属的化学性质比较活泼,外因是金属与空气、水和其他腐蚀性的物质接触,腐蚀主要包括化学腐蚀和电化学腐蚀,所以A错误;电化学腐蚀指不纯金属与电解质溶液接触时发生原电池反应而损耗的过程,不需要外加电流,所以B错误;钢铁腐蚀最普遍的是吸氧腐蚀,正极吸收氧气,而不是负极吸收氧气,所以C错误;只有选项D正确。 2.如图所示, 试管中放一铁钉,溶液为氯化钠溶液,数天后观察到的 现象有_______________________________________________________。 说明铁钉发生了____腐蚀,其中正极的电极反应式为__________________, 溶液中发生反应的化学方程式为__________________________。 答案 U形管的a端比b端液面高,试管内有红褐色物质生成 吸氧 2H2O+O2+4e-===4OH- 4Fe(OH)2+O2+2H2O===4Fe(OH)3 解析 此题考查了铁的吸氧腐蚀,铁钉腐蚀时吸收试管中的O2,使压强减小,左边液面上升,由极反应式负极:2Fe-4e-===2Fe2+,正极:O2+4e-+2H2O===4OH-。 探究点二 金属的防护方法 1.金属的防护就是防止金属的腐蚀,要解决的主要问题是使金属不被氧化。从金属腐蚀的反应实质、影响因素等方面分析,确定金属防护的方法: (1)改变金属的内部结构,使金属性质改变,增强其本身的抗腐蚀能力,成为耐腐蚀金属; (2)使金属与化学物质相互隔离,在金属表面覆盖油漆、镀层金属、氧化膜等保护层。 2.常见的金属防护方法 (1)物理保护法 ①在钢铁表面涂矿物性油脂、油漆或覆盖搪瓷、塑料等物质。 ②用电镀的方法,在钢铁制品表面镀上一层不易被腐蚀的金属,如锌、锡、铬、镍等。 ③工业上常利用一些溶液的氧化作用,在机器零件、精密仪器、枪炮等钢铁制件的表面上形成一层致密的黑色的四氧化三铁薄膜。 ④把铬、镍等加入普通钢里制成不锈钢,就大大地增加了钢铁对各种侵蚀的抵抗力。 (2)电化学保护法 ①为了减小某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用C(填写字母序号)。 A.铜 B.钠 C.锌 D.石墨 ②图乙所示的方案也可以减慢铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极。 [归纳总结] 金属的电化学防护方法 类型 方法 原理 实例 牺牲阳极的阴极保护法 在被保护的设备上装上比它更活泼的金属 被保护的金属作原电池的正极 船舶的外壳上装锌块 外加电流的阴极保护法 将被保护的设备与惰性电极置于电解质溶液里,接上外加直流电源 被保护的金属作电解池的阴极 保护海水中的钢闸门 [活学活用] 3.下列关于金属的防护方法的说法不正确的是( ) A.我们使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用 B.给铁件通入直流电,把铁件与电池负极相连接 C.轮船在船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法 D.钢铁制造的暖气管管道外常涂有一层较厚的沥青 答案 A 解析 A项中搪瓷层破损后金属铁直接暴露在空气中,搪瓷层已不能再对破损部位形成有效的保护;B项中利用的是外加电流的阴极保护法,从而保护铁不被腐蚀;C项是牺牲阳极的阴极保护法;D项是用沥青作涂层的涂层保护法。 4.美籍华裔化学家钱永健是诺贝尔化学奖获得者。少年时代,他就对化学产生了浓厚的兴趣。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是( ) A.金属腐蚀就是金属原子失去电子被还原的过程 B.合金都比纯金属易被腐蚀 C.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀 D.镀锌铁比镀锡铁更容易被腐蚀 答案 C 解析 金属腐蚀就是金属原子失去电子被氧化的过程,故A错;铁中加入镍比纯铁耐腐蚀,故B错;C项应用的是牺牲阳极的阴极保护法,故正确;镀锌铁破损后,Zn作负极,Fe仍受保护,而镀锡铁破损后,铁作负极,被腐蚀,所以D项错。 1.下列叙述中不正确的是( ) A.金属的电化学腐蚀比化学腐蚀更普遍 B.钢铁在干燥空气中不易被腐蚀 C.用铝质铆钉铆接铁板,铁板不易被腐蚀 D.原电池中电子由正极流入负极 答案 D 2.下列与金属腐蚀有关的说法正确的是( ) A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小 C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 答案 B 解析 A项,插入海水中的铁棒靠近液面的位置与氧气接触,易发生吸氧腐蚀;B项,开关由M改置于N时,Zn作负极,CuZn合金作正极,合金受到保护;C项,接通开关形成原电池,Zn作负极,Zn的腐蚀速率增大,但气体是在Pt电极上生成;D项,ZnMnO2中自放电腐蚀主要是Zn发生氧化反应而自放电。 3.下列叙述错误的是( ) A.生铁中含有碳,抗腐蚀能力比纯铁弱 B.用锡焊接的铁质器件,焊接处易生锈 C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 D.铁管上镶嵌锌块,铁管不易被腐蚀 答案 C 4.下列有关钢铁腐蚀与防护的说法正确的是( ) A.钢管与电源正极连接,钢管可被保护 B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀 D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+ 答案 B 解析 钢管连电源正极,则作阳极,易腐蚀;铜管与钢管堆放,钢管作负极,易腐蚀。 5.铜制品在经常下酸雨的地区电化学腐蚀严重。写出此电化学腐蚀的电极反应式: 正极:________________________________________________________________________, 负极:________________________________________________________________________。 答案 O2+2H2O+4e-===4OH- 2Cu-4e-===2Cu2+ 解析 要注意铜的电化学腐蚀与铁的区别,铜不能还原H+,故不可能发生析氢腐蚀,只能发生吸氧腐蚀;酸雨是一个干扰因素,只是使电解质溶液中的离子浓度增大,反应加快。 [基础过关] 一、金属的腐蚀 1.关于金属腐蚀的叙述中,正确的是( ) A.金属被腐蚀的本质是M+nH2O===M(OH)n+H2↑ B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化 C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀 D.常温下,置于空气中的金属主要发生化学腐蚀 答案 C 解析 A中金属腐蚀的本质应包括化学腐蚀和电化学腐蚀,为M-ne-===Mn+;B选项中Sn、Fe构成电化学腐蚀,主要是Fe-2e-===Fe2+,铁先被腐蚀;常温下,空气中的金属主要发生电化学腐蚀中的吸氧腐蚀,难以和非金属氧化剂(Cl2、S)等反应发生化学腐蚀。 2.下列事实与电化学腐蚀无关的是( ) A.光亮的自行车钢圈不易生锈 B.黄铜(Cu、Zn合金)制的铜锣不易生锈 C.铜、铝电线一般不连接起来作导线 D.生铁比熟铁(几乎是纯铁)容易生锈 答案 A 解析 B、C、D项均与原电池有关,能用电化学知识来解释,故选A。 3.出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法不正确的是( ) A.锡青铜的熔点比纯铜低 B.在自然环境中,锡青铜中的锡可对铜起保护作用 C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 答案 D 解析 锡青铜是合金,合金的熔点比任何一种纯金属的熔点低,一般合金的硬度比任何一种纯金属的硬度大,可判断A对;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀,C正确;电化学腐蚀过程实质是金属失去电子生成金属阳离子,有电子的转移,属于化学反应过程,D错。 二、铁的析氢腐蚀和吸氧腐蚀 4.下列关于钢铁的析氢腐蚀的说法中正确的是( ) A.铁为正极 B.碳为正极 C.溶液中氢离子浓度不变 D.析氢腐蚀在任何溶液中都会发生 答案 B 5.在铁的吸氧腐蚀过程中,下列5种变化可能发生的是( ) ①Fe由+2价转化成+3价 ②O2被还原 ③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O ⑤杂质C被氧化除去 A.①②④ B.③④ C.①②③④ D.①②③④⑤ 答案 A 6.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( ) A.负极发生的反应为Fe-2e-===Fe2+ B.正极发生的反应为2H2O+O2+2e-===4OH- C.原电池是将电能转变为化学能的装置 D.钢柱在水下部分比在空气与水交界处更容易腐蚀 答案 A 7.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( ) A.生铁块中的碳是原电池的正极 B.红墨水水柱两边的液面变为左低右高 C.两试管中相同的电极反应式是Fe-2e-===Fe2+ D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 答案 B 三、金属的防护方法 8.下列金属的防护方法不正确的是( ) A.对健身器材涂油漆以防止生锈 B.对某些工具的“机械转动部位”选用刷油漆的方法来防锈 C.用牺牲锌块的方法来保护船体 D.自行车的钢圈上镀上一层铬防锈 答案 B 9.下列举措不能防止或减缓钢铁腐蚀的是( ) A.在钢铁制品表面镀一层金属锌 B.将钢铁制品放置在潮湿处 C.在钢铁中加入锰、铬等金属,以改变钢铁结构 D.将钢铁制品与电源负极相连 答案 B 10.为了防止钢铁锈蚀,下列防护方法中正确的是( ) A.在精密机床的铁床上安装铜螺钉 B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 C.在海轮舷上用铁丝系住锌板浸在海水里 D.在地下输油的铸铁管上接直流电源的正极 答案 C 解析 A、B中形成的原电池都是铁作负极,加速钢铁腐蚀;D中铸铁管作阳极,加速腐蚀;C中锌比铁活泼,铁作正极。 [能力提升] 11.镁、铝、铁是重要的金属,在工业生产中用途广泛。 (1)镁与稀硫酸反应的离子方程式为_____________________________________________。 (2)铝与氧化铁发生铝热反应的化学方程式为_____________________________________。 (3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。 其中正极的电极反应式为________________________________________________________________________。 (4)在海洋工程上,通常用铝合金(AlZnCd)保护海底钢铁设施,其原理如图所示: 其中负极发生的电极反应为____________________________________________________; 在实际应用中,用铝合金而不选用纯铝,纯铝不能很好地起到保护作用,其原因是________________________________________________________________________。 答案 (1)Mg+2H+===Mg2++H2↑ (2)2Al+Fe2O3Al2O3+2Fe (3)2H2O+O2+4e-===4OH- (4)Al-3e-===Al3+ 铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,使金属铝呈现“惰性” 解析 (3)属于钢铁的吸氧腐蚀;(4)属于牺牲阳极的阴极保护法。 12.对金属制品进行抗腐蚀处理,可延长其使用寿命。 (1)以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是_______________________________________________________________________________ (用离子方程式表示)。为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________(填字母序号)。 a.NH3 b.CO2 c.NaOH d.HNO3 ②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________________。 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是________________________________________________________________________。 (3)利用右图装置,可以模拟铁的电化学防护。 若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。 若X为锌,开关K置于M处,该电化学防护法称为________________ ________________。 答案 (1)①2Al+2OH-+2H2O===2AlO+3H2↑ b ②2Al+3H2O-6e-===Al2O3+6H+ (2)补充溶液中的Cu2+,保持溶液中Cu2+的浓度恒定 (3)N 牺牲阳极的阴极保护法 13.钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。 (1)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是_________________________________________________。 (2)下列哪个装置可防止铁棒被腐蚀________。 (3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如右: ①A电极对应的金属是________(写元素名称),B电极的电极反应式是 ____________________________________________________________。 ②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干 、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。 ③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:______________________ ________________________________________________________________________。 答案 (1)2FeCl3+Fe===3FeCl2 (2)BD (3)①铜 Cu2++2e-===Cu ②0.08 ③铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀 14.如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验: 序号 内容 实验现象 1 常温下将铁丝放在干燥空气中一个月 干燥的铁丝表面依然光亮 2 常温下将铁丝放在潮湿空气中一小时 铁丝表面依然光亮 3 常温下将铁丝放在潮湿空气中一个月 铁丝表面已变得灰暗 4 将潮湿的铁丝放在常温的氧气流中一小时 铁丝表面略显灰暗 5 将潮湿的铁丝放在高于常温的氧气流中一小时 铁丝表面已变得灰暗 6 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 铁丝表面灰暗程度比实验5严重 回答以下问题: (1)上述实验中发生了电化学腐蚀的是(填实验序号)____________;在电化学腐蚀中,负极反应是________________________________________________________________________; 正极反应是_______________________________________________________________; (2)由该实验可知,可以影响铁锈蚀速率的因素是_________________________________; (3)为防止铁的锈蚀,工业上普遍采用的方法是_______________________________________ (答两种方法)。 答案 (1)3、4、5、6 2Fe-4e-===2Fe2+(或Fe-2e-===Fe2+) 2H2O+O2+4e-===4OH- (2)湿度、温度、O2的浓度、电解质的存在 (3)电镀、发蓝等表面覆盖保护层法;牺牲阳极的阴极保护法等 [拓展探究] 15.某研究小组对铁生锈进行研究。 (1)甲同学设计了A、B、C一组实验(如上图),探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈。 ①通过上述实验现象分析,可得出铁生锈的外部条件是_______________________________; ②铁钉发生电化学腐蚀的正极电极反应式为_________________________________________; ③实验B所用的水要经过__________处理;植物油的作用是____________________________; ④实验C中碱石灰的作用是______________________________。 (2)乙同学为了达到同样目的,设计了实验D(如图),发现一段时间后,试管中的液面升高,其原因是____________________________,该实验__________(填“能”或“不能”)说明水对铁钉生锈产生影响。 答案 (1)①有水(或电解质溶液)和氧气(或空气) ②O2+4e-+2H2O===4OH- ③煮沸(或“除去氧气”) 隔绝空气(或“防止氧气与铁接触”) ④吸收水蒸气(或“干燥”、“保持试管内干燥环境”) (2)铁的腐蚀要吸收氧气(或“氧气参与反应”、“消耗了氧气”)使气体体积减小 不能查看更多