2018届高考二轮复习鲁科版专题11电解质溶液与离子平衡教案29
专题十一 电解质溶液与离子平衡
教学目标
1、了解电解质、强电解质和弱电解质的概念。
2、了解弱电解质在水溶液中的电离平衡、水的电离及离子积常数、盐类水解的原理、影响因素及应用。
3、了解溶液 pH 的定义,能进行溶液 pH 的简单计算。
4、了解水的电离及离子积常数。
5、能正确分析电解质溶液中离子浓度比较。
6、酸碱中和滴定的原理及误差分析。
教学重点:
1、 电离平衡与水解平衡的原理、影响因素及应用。
2、 电解质溶液中离子浓度比较。
教学难点:
电解质溶液中离子浓度比较。
教学过程:
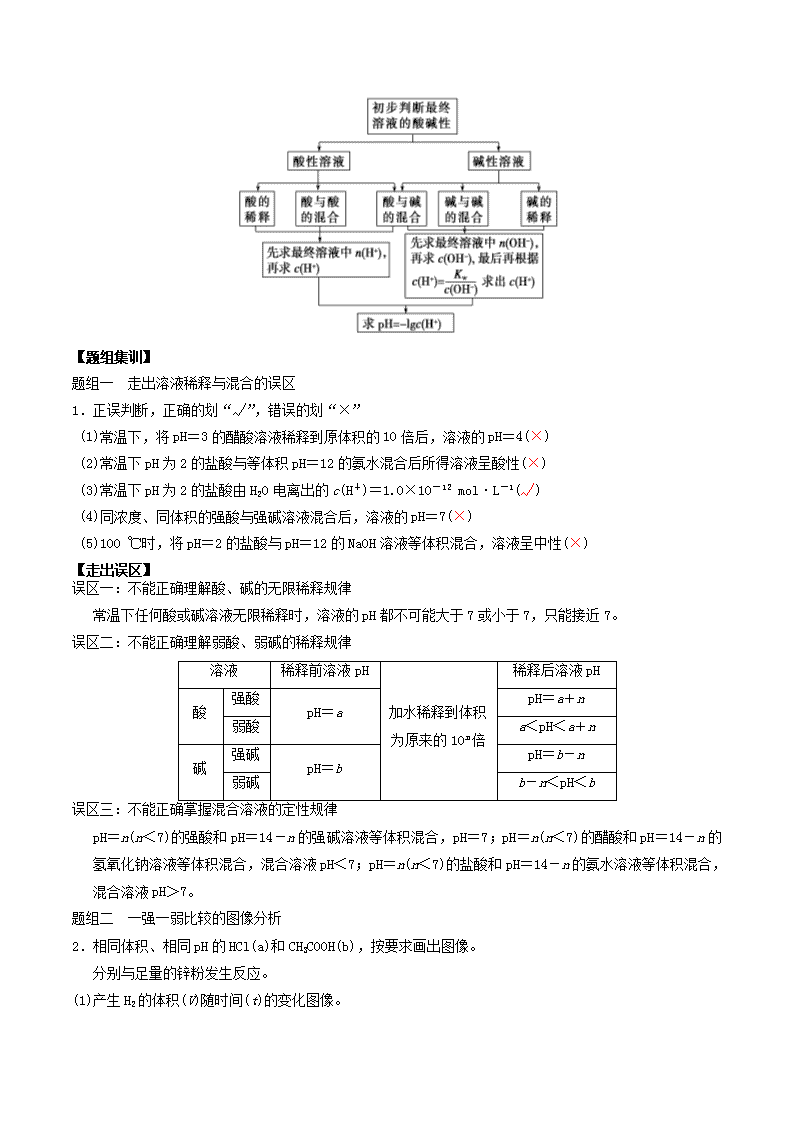
考点一:溶液的酸碱性及 pH
【知识精讲】
1.一个基本不变
相同温度下,不论是纯水还是稀溶液,水的离子积常数不变。应用这一原则时需要注意两个条件:水溶
液必须是稀溶液;温度必须相同。
2.两种测量方法
溶液的 pH 值可以用 pH 试纸测定(精确到整数,且只能在 1~14 的范围内),也可以用 pH 计(精确到 0.1)
测定。
3.三个重要比较
水溶液可分为酸性溶液、中性溶液和碱性溶液,下表是常温下这三种溶液的比较:
溶液的酸碱性 c(H+)与 c(OH-)比较 c(H+)大小 pH
酸性溶液 c(H+)>c(OH-) c(H+)>1×10-7 mol·L-1 <7
中性溶液 c(H+)=c(OH-) c(H+)=1×10-7 mol·L-1 =7
碱性溶液 c(H+)
7
4.pH 使用中的几个误区
(1)pH=7 的溶液不一定呈中性。只有在常温下 pH=7 的溶液才呈中性;当在 100 ℃时,水的离子积常数为
1×10-12,此时 pH=6 的溶液为中性溶液,pH>6 时为碱性溶液,pH<6 时为酸性溶液。
(2)使用 pH 试纸测溶液 pH 时,若先用蒸馏水润湿,测量结果不一定偏小。若先用蒸馏水润湿,相当于将待
测液稀释了,若待测液为碱性溶液,则所测结果偏小;若待测液为酸性溶液,则所测结果偏大;若待测
液为中性溶液,则所测结果没有误差。
5.溶液中的 c(H+)和水电离出来的 c(H+)的区别
(1)室温下水电离出的 c(H+)=1×10-7 mol·L-1,若某溶液中水电离出的 c(H+)<1×10-7 mol·L-1,则可判
断该溶液呈酸性或碱性;若某溶液中水电离出的 c(H+)>1×10-7 mol·L-1,则可判断出该溶液中存在能水
解的盐,从而促进了水的电离。
(2)室温下,溶液中的 c(H+)>1×10-7 mol·L-1,说明该溶液是酸性溶液或水解呈酸性的盐溶液;溶液中的
c(H+)<1×10-7 mol·L-1,说明该溶液是碱性溶液或水解呈碱性的盐溶液。
6.pH 和等于 14 的酸碱混合问题的判断
pH 和等于 14 的意义:酸溶液中的氢离子浓度等于碱溶液中的氢氧根离子的浓度。
(1)已知酸、碱溶液的 pH 之和为 14,则等体积混合时:
强酸、强碱 ――→恰好中和pH=7
强酸、弱碱 ――→碱过量pH>7
弱酸、强碱 ――→酸过量pH<7
(2)已知酸、碱溶液的 pH 之和为 14,若混合后溶液的 pH 为 7,溶液呈中性,则
强酸、强碱 ―→V 酸∶V 碱=1∶1
强酸、弱碱 ―→V 酸∶V 碱>1∶1
弱酸、强碱 ―→V 酸∶V 碱<1∶1
(3)强酸、强碱等体积混合后溶液酸、碱性的判断:
7.溶液 pH 计算的一般思维模型
【题组集训】
题组一 走出溶液稀释与混合的误区
1.正误判断,正确的划“√”,错误的划“×”
(1)常温下,将 pH=3 的醋酸溶液稀释到原体积的 10 倍后,溶液的 pH=4(×)
(2)常温下 pH 为 2 的盐酸与等体积 pH=12 的氨水混合后所得溶液呈酸性(×)
(3)常温下 pH 为 2 的盐酸由 H2O 电离出的 c(H+)=1.0×10-12 mol·L-1(√)
(4)同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH=7(×)
(5)100 ℃时,将 pH=2 的盐酸与 pH=12 的 NaOH 溶液等体积混合,溶液呈中性(×)
【走出误区】
误区一:不能正确理解酸、碱的无限稀释规律
常温下任何酸或碱溶液无限稀释时,溶液的 pH 都不可能大于 7 或小于 7,只能接近 7。
误区二:不能正确理解弱酸、弱碱的稀释规律
溶液 稀释前溶液 pH
加水稀释到体积
为原来的 10n 倍
稀释后溶液 pH
酸
强酸
pH=a
pH=a+n
弱酸 a<pH<a+n
碱
强碱
pH=b
pH=b-n
弱碱 b-n<pH<b
误区三:不能正确掌握混合溶液的定性规律
pH=n(n<7)的强酸和 pH=14-n 的强碱溶液等体积混合,pH=7;pH=n(n<7)的醋酸和 pH=14-n 的
氢氧化钠溶液等体积混合,混合溶液 pH<7;pH=n(n<7)的盐酸和 pH=14-n 的氨水溶液等体积混合,
混合溶液 pH>7。
题组二 一强一弱比较的图像分析
2.相同体积、相同 pH 的 HCl(a)和 CH3COOH(b),按要求画出图像。
分别与足量的锌粉发生反应。
(1)产生 H2 的体积(V)随时间(t)的变化图像。
(2)产生 H2 的速率 v(H2)随时间(t)的变化图像。
(3)溶液的 pH 随时间(t)的变化图像。
【答案】(1)
(2)
(3)
3.pH=2 的两种一元酸 x 和 y,体积均为 100 mL,稀释过程中 pH 与溶液体积的关系如下图所示。分别滴加
NaOH 溶液(c=0.1 mol·L-1)至 pH=7,消耗 NaOH 溶液的体积为 Vx、Vy,则( )
A.x 为弱酸,VxVy
C.y 为弱酸,VxVy
【答案】C
【解析】由图知:将一元酸 x 和 y 分别稀释 10 倍,pH 的变化量ΔpHx=1,ΔpHy<1,所以 x 为强酸,而 y 为
弱酸。pH=2 时弱酸 y 的浓度大,滴加 NaOH 至 pH=7 时需 NaOH 溶液的体积则 y 要比 x 大。
【方法技巧】图像法理解一强一弱的稀释规律
1.相同体积、相同浓度的盐酸、醋酸
(1)加水稀释相同的倍数,醋酸的 pH 大。
(2)加水稀释到相同的 pH,盐酸加入的水多。
2.相同体积、相同 pH 值的盐酸、醋酸
(1)加水稀释相同的倍数,盐酸的 pH 大。
(2)加水稀释到相同的 pH,醋酸加入的水多。
题组三 理解换算关系,突破 pH 的计算
4.在 T ℃时,Ba(OH)2 的稀溶液中 c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知 a+b=12。向该
溶液中逐滴加入 pH=4 的盐酸,测得混合溶液的部分 pH 如表所示:
序号
氢氧化钡溶
液的体积/mL
盐酸的体
积/mL
溶液的
pH
① 22.00 0.00 8
② 22.00 18.00 c
③ 22.00 22.00 d
假设溶液混合前后的体积变化可忽略不计,则下列说法不正确的是( )
A.a=8 B.b=4 C.c=9 D.d=6
【答案】C
【解析】本题考查了 pH 的综合计算和从表中获取关键信息的能力。Ba(OH)2 溶液的 pH=8,即 a=8,再根据
a+b=12,则 b=4,c(OH-)=10-4 mol·L-1。Ba(OH)2 溶液中氢氧根离子的浓度与盐酸的浓度相等,该
温度下 Kw=10-12,当加入 22.00 mL 盐酸时恰好中和,溶液的 pH=6,即 d=6;当加入 18.00 mL 盐酸
时,氢氧化钡过量,c(OH-)=(10-4×22.00-10-4×18.00)÷(22.00+18.00)=10-5 (mol·L-1),所以
此时 c(H+)=10-7 mol·L-1,pH=7,故 c=7。
【方法归纳】
室温下,Kw=c(H+)·c(OH-)=1×10-14,则 pKw=14。
考点二:溶液中的“两大平衡”
【知识精讲】
电离平衡、水解平衡是溶液中的两大平衡。这两种平衡都遵循勒夏特列原理——当只改变体系的一个条
件时,平衡向能够减弱这种改变的方向移动。
1.对比分析电离平衡和水解平衡
电离平衡及水解平衡均属于化学平衡,均遵循勒夏特列原理,外界条件对两平衡的影响如表所示:
电离平衡(如 CH3COOH 溶液) 水解平衡(如 CH3COONa 溶液)
升高温度 促进电离,离子浓度增大,Ka 增大 促进水解,Kh 增大
加水稀释
促进电离,离子浓度(除 OH-外)减小,
Ka 不变
促进水解,离子浓度(除 H+外)
减小,Kh 不变
加入相应
离子
加入 CH3COONa 固体,抑制电离,Ka
不变
加入 NaOH 固体,抑制水解,Kh
不变
加入反应
离子
加入 NaOH 固体,促进电离,Ka 不变 加入盐酸,促进水解,Kh 不变
Ka、Kh、Kw Kw=Ka·Kh
的关系
2.强化记忆弱酸弱碱盐、酸式盐溶液的酸碱性
(1)弱酸弱碱盐双水解,其溶液的酸碱性取决于弱酸和弱碱的相对强弱。当 Ka=Kb 时,溶液显中性,如
CH3COONH4;当 Ka>Kb 时,溶液显酸性,如 HCOONH4;当 Kac(HS-)>c(OH-)>c(H2S)
B.Na2C2O4 溶液:c(OH-)=c(H+)+c(HC2O-
4 )+2c(H2C2O4)
C.Na2CO3 溶液:c(Na+)+c(H+)=2c(CO2-
3 )+c(OH-)
D.CH3COONa 和 CaCl2 混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
【答案】B
【解析】A 项,Na2S 溶液中微粒关系为 c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H2S),错误;B 项,Na2C2O4 溶液中,
由电荷守恒得:
c(Na+)+c(H+)=2c(C2O2-
4 )+c(HC2O-
4 )+c(OH-)①
由物料守恒得:c(Na+)=2c(C2O2-
4 )+2c(HC2O-
4 )+2c(H2C2O4)②
由①-②得:c(OH-)=c(H+)+c(HC2O-
4 )+2c(H2C2O4),正确;
C 项,Na2CO3 溶液中,由电荷守恒得:c(Na+)+c(H+)=2c(CO2-
3 )+c(HCO-
3 )+c(OH-),错误;
D 项,CH3COONa 和 CaCl2 混合溶液中存在:c(Na+)=c(CH3COO-)+c(CH3COOH)①
2c(Ca2+)=c(Cl-)②
①+②得:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),错误。
2.25 ℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
A.0.1 mol·L-1 CH3COONa 溶液与 0.1 mol·L-1 HCl 溶液等体积混合:
c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1 NH4Cl 溶液与 0.1 mol·L-1 氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH+
4 )>c(Cl-)>c(OH-)
C.0.1 mol·L-1 Na2CO3 溶液与 0.1 mol·L-1 NaHCO3 溶液等体积混合:
2
3
c(Na+)=c(CO2-
3 )+c(HCO-
3 )+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4 溶液与 0.1 mol·L-1 HCl 溶液等体积混合(H2C2O4 为二元弱酸):
2c(C2O2-
4 )+c(HC2O-
4 )+c(OH-)=c(Na+)+c(H+)+c(Cl-)
【答案】B
【解析】A 项,二者恰好反应生成 CH3COOH 和 NaCl,CH3COOH 发生电离:CH3COOH CH3COO-+H+,溶液显
酸性,正确;B 项,NH4Cl 与 NH3·H2O 等浓度等体积混合显碱性,说明 NH3·H2O 的电离程度大于 NH +
4 的
水解程度,故 c(NH+
4 )>c(NH3·H2O),错误;C 项,等浓度的 Na2CO3 和 NaHCO3 溶液中,根据物料守恒,可
知 2c(Na+)=3c(CO2-
3 )+3c(HCO-
3 )+3c(H2CO3),正确;D 项,根据电荷守恒,正确。
题组二 化学反应过程中“粒子”浓度关系判断
3.20 ℃时向 20 mL 0.1 mol·L-1 醋酸溶液中不断滴入 0.1 mol·L-1 NaOH(aq),溶液 pH 变化如图所示。
此过程溶液中离子浓度的关系错误的是( )
A.a 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b 点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.c 点:c(H+)=c(CH3COOH)+c(OH-)
D.d 点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】C
【解析】a 点是 CH3COOH 和 CH3COO Na 的等量混合,离子浓度关系为 c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
b 点,溶液呈中性,溶质为 CH3COONa 和少量 CH3COOH,根据电荷守恒判断;c 点,正好生成 CH3COONa 溶
液,根据质子守恒得 c(OH-)=c(CH3COOH)+c(H+);d 点是 CH3COONa 和 NaOH 的混合,其中 CH3COONa 的
物质的量是 NaOH 的 2 倍,正确。
【方法技巧】巧抓“四点”,突破“粒子”浓度关系
1.抓反应“一半”点,判断是什么溶质的等量混合。
2.抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。
3.抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。
4.抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。
考点五:酸碱中和滴定及“迁移”应用
【知识精讲】
“中和滴定”考点归纳
(1)“考”实验仪器
酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶。其中常考的是滴定管,如正确选择滴定管(包
括量程),滴定管的检漏、洗涤和润洗,滴定管的正确读数方法等。
(2)“考”操作步骤
①滴定前的准备;查漏、洗涤、润洗、充液(赶气泡)、调液面、读数;②滴定:移液、滴加指示剂、滴定
至终点、读数;③计算。
(3)“考”指示剂的选择
①强酸强碱相互滴定,可选用甲基橙或酚酞;②若反应生成的强酸弱碱盐溶液呈酸性,则选用酸性变色范
围的指示剂(甲基橙),若反应生成强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞);③
石蕊试液因颜色变化不明显,且变色范围过宽,一般不作指示剂。
(4)“考”误差分析
写出计算式,分析操作对 V 标的影响,由计算式得出对最终测定结果的影响,切忌死记硬背结论。此外对
读数视线问题要学会画图分析。
(5)“考”数据处理
正确“取舍”数据,计算“平均”体积,根据反应式确定标准液与待测液浓度和体积的关系,从而列出
公式进行计算。
【题组集训】
题组一 中和滴定的基本操作
1.正误判断,正确的划“√”,错误的划“×”
(1)酸式滴定管装标准溶液前,必须先用该溶液润洗(√)
(2)酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差(×)
(3)欲测定 NaOH 溶液浓度,可选用滴定管、锥形瓶、烧杯、NaOH 溶液、0.100 0 mol·L-1 盐酸达到实验目
的(×)
(4)滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小(√)
(5)中和滴定实验时,用待测液润洗锥形瓶(×)
(6)“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,
须经干燥或润洗后方可使用(√)
(7) 读数为 22.30(×)
(8)酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高(√)
(9) (√)
(10) (×)
(11)可用 25 mL 碱式滴定管量取 20.00 mL KMnO4 溶液(×)
(12)读取滴定管内液体的体积,俯视读数导致读数偏小(√)
题组二 滴定终点的描述
2.用 a mol·L - 1 的 HCl 滴定未知浓度的 NaOH 溶液,用酚酞作指示剂,达到滴定终点的现象是
____________________;若用甲基橙作指示剂,滴定终点现象是____________________。
【答案】滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色 当滴入最后一滴标准液,
溶液由黄色变为橙色,且半分钟内不恢复黄色
3.用标准碘溶液滴定溶有 SO2 的水溶液,以测定水中 SO2 的含量,应选用____________作指示剂,达到滴定
终点的现象是________________________________。
【答案】淀粉溶液 当滴入最后一滴标准液,溶液由无色变为蓝色,且半分钟内不褪色
4.用标准酸性 KMnO4 溶液滴定溶有 SO2 的水溶液,以测定水中 SO2 的含量,是否需要选用指示剂________(填
“是”或“否”),达到滴定终点的现象是____ ____________。
【答案】否 当滴入最后一滴酸性 KMnO4 溶液,溶液由无色变为紫红色,且半分钟内不褪色
5.用氧化还原滴定法测定 TiO2 的质量分数:一定条件,将 TiO2 溶解并还原为 Ti3+,再用 KSCN 溶液作指示
剂,用 NH4Fe(SO4)2 标准溶液滴定 Ti3 + 至全部生成 Ti4 + ,滴定 Ti3 + 时发生反应的离子方程式为
__________________________,达到滴定终点时的现象是__________________________。
【答案】Ti3++Fe3+===Ti4++Fe2+ 当滴入最后一滴标准液,溶液变成血红色,且半分钟内不褪色
题组三 “滴定法”的迁移应用
6.中华人民共和国国家标准(GB27602011)规定葡萄酒中 SO2 最大使用量为 0.25 g·L-1。某兴趣小组用题
图 1 装置(夹持装置略)收集某葡萄酒中 SO2,并对其含量进行测定。
(1)仪器 A 的名称是____________,水通入 A 的进口为____________。
(2)B 中加入 300.00 mL 葡萄酒和适量盐酸,加热使 SO2 全部逸出并与 C 中 H2O2 完全反应,其化学方程式为
________________________________。
(3)除去 C 中过量的 H2O2,然后用 0.090 0 mol·L-1NaOH 标准溶液进行滴定,滴定前排气泡时,应选择题图
2 中的________;若滴定终点时溶液的 pH=8.8,则选择的指示剂为________;若用 50 mL 滴定管进行
实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,
③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗 NaOH 溶液 25.00 mL,该葡萄酒中 SO2 含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施___________________
__________________________________________________。
【答案】(1)冷凝管(或冷凝器) b
(2)SO2+H2O2===H2SO4
(3)③ 酚酞 ④ (4)0.24
(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比
实验,扣除盐酸挥发的影响
【解析】(1)A 仪器的名称为冷凝管或冷凝器;为使冷却效果好,应将冷却水从处于低处的 b 口通入。
(2)SO2 具有强还原性,H2O2 具有强氧化性,二者发生氧化还原反应:SO2+H2O2===H2SO4。
(3)NaOH 盛装在碱式滴定管中,应将橡皮管向上弯曲排出气泡,故选③;滴定至终点时溶液的 pH=8.8,
在酚酞的变色范围内,故可选用酚酞作指示剂;液面在 10 mL 时滴定管中有刻度的液体为 40 mL,因滴
定管的下端有一段无刻度,故滴定管内液体的体积大于 40 mL。
(4)SO2 与 NaOH 存在如下关系:
SO2 ~ H2SO4 ~ 2NaOH
64 g 2 mol
m(SO2) 0.090 0 mol·L-1×0.025 L
解得:m(SO2)=64 g×0.090 0 mol·L-1×0.025 L
2 mol
=0.072 g,故葡萄酒中 SO2 的含量为0.072 g
0.3 L
=0.24
g·L-1。
(5)盐酸为挥发性酸,挥发出的 HCl 消耗 NaOH,使测量值偏大。可以用难挥发的稀硫酸代替盐酸进行该
实验。