- 2021-04-15 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省宜宾市叙州区第二中学校2020届高三三诊模拟考试
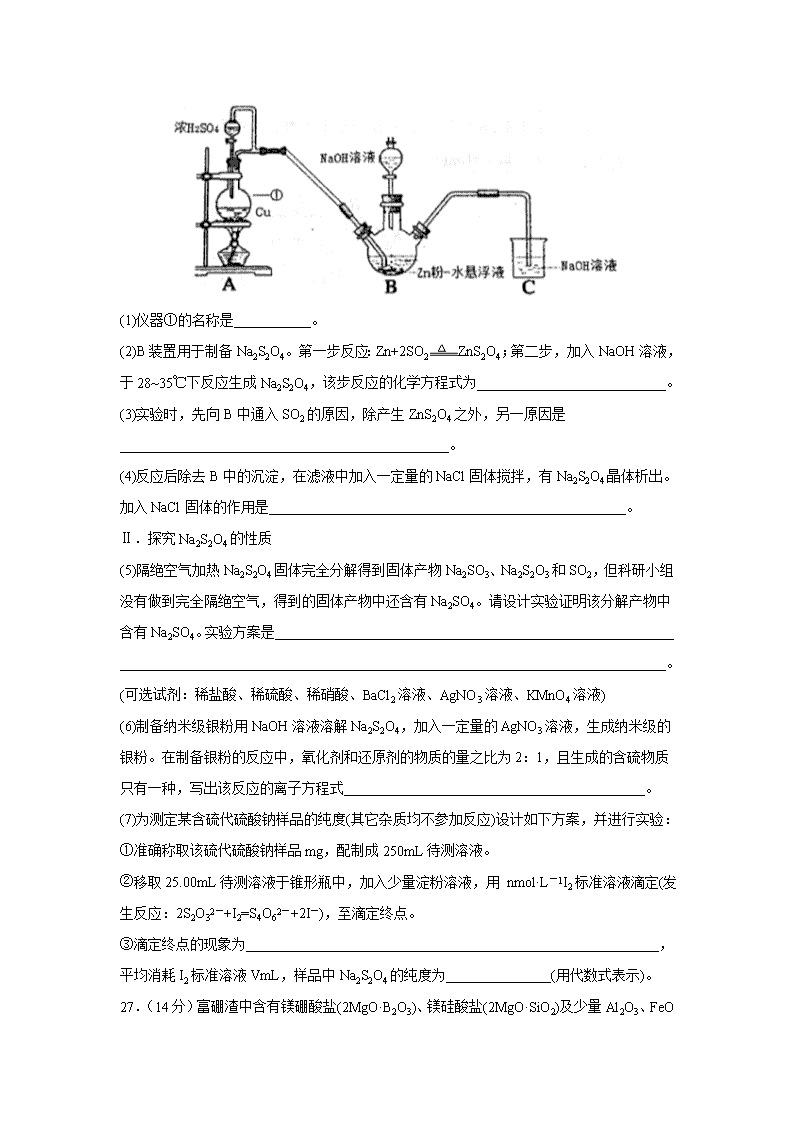
四川省宜宾市叙州区第二中学校2020届高三三诊模拟考试 可能用到的相对原子质量:C-12 N-14 O-16 S-32 C1-35.5 Ba-137 Cu-64 Na-23 第I卷 选择题 一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是( ) A.“薪柴之灰”可与铵态氮肥混合施用 B.“以灰淋汁”的操作是萃取 C.“取碱”得到的是一种碱溶液 D.“浣衣”过程有化学变化 8.NA为阿伏加德罗常数的值.下列说法正确的是( ) A.0.1 mol 的11B中,含有0.6NA个中子 B.pH=1的H3PO4溶液中,含有0.1NA个H+ C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 D.密闭容器中2 mol SO2与1 molO2反应制得2 molSO3 9.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。下列关于该化合物的说法不正确的是( ) A.5个碳原子均在同一平面上 B.该化合物的分子式为C5H8 C.其二氯代物超过两种 D.与环戊烯互为同分异构体 10.短周期元素W、X、Y、Z的原子序数依次增加,W的原子中只有1个电子,X2-和Y+ 离子的电子层结构相同,X与Z同族。下列叙述正确的是( ) A.原子半径:Z > Y > W B.X 的简单氢化物的稳定性比Z的弱 C.Y的氢化物为共价化合物 D.Z的最高价氧化物对应的水化物是一种强酸 11.海水化学资源开发利用的部分过程如图所示,下列说法正确的是( ) A.从海水中得到粗盐主要是通过蒸发操作实现的 B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 C.在步骤③中可通入Cl2使溴离子被还原为Br2 D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大 12.我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。下列说法不正确的是 ( ) A.该装置在太阳光下分解水,实现太阳能转化为化学能 B.催化剂b附近溶液的pH增大 C.催化剂a表面H2O发生还原反应,产生H2 D.吸收1molSO2,理论上能产生1molH2 13.水的电离平衡曲线如图所示,下列说法中,正确的是( ) A.图中A、B、D三点处Kw的大小关系:B>A>D B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小 C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点 D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42— 第II卷 非选择题 26.(14分)Na2S2O4俗称保险粉,常用做纺织工业的漂白剂、脱色剂等。某科研小组制备并探究其性质。 资料:Na2S2O4易溶于水,具有极强的还原性,易被空气氧化,在碱性介质中稳定。 Ⅰ.制备Na2S2O4 (部分加热等辅助仪器略去) (1)仪器①的名称是___________。 (2)B装置用于制备Na2S2O4。第一步反应:Zn+2SO2ZnS2O4;第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的化学方程式为___________________________。 (3)实验时,先向B中通入SO2的原因,除产生ZnS2O4之外,另一原因是_______________________________________________。 (4)反应后除去B中的沉淀,在滤液中加入一定量的NaCl固体搅拌,有Na2S2O4晶体析出。加入NaCl固体的作用是___________________________________________________。 Ⅱ.探究Na2S2O4的性质 (5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是_________________________________________________________ ______________________________________________________________________________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液) (6)制备纳米级银粉用NaOH溶液溶解Na2S2O4,加入一定量的AgNO3溶液,生成纳米级的银粉。在制备银粉的反应中,氧化剂和还原剂的物质的量之比为2:1,且生成的含硫物质只有一种,写出该反应的离子方程式___________________________________________。 (7)为测定某含硫代硫酸钠样品的纯度(其它杂质均不参加反应)设计如下方案,并进行实验: ①准确称取该硫代硫酸钠样品mg,配制成250mL待测溶液。 ②移取25.00mL待测溶液于锥形瓶中,加入少量淀粉溶液,用 nmol·L-1I2标准溶液滴定(发生反应:2S2O32-+I2=S4O62-+2I-),至滴定终点。 ③滴定终点的现象为___________________________________________________________,平均消耗I2标准溶液VmL,样品中Na2S2O4的纯度为_______________(用代数式表示)。 27.(14分)富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3 、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下: 已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L) Fe(OH)3 Al(OH)3 Fe(OH)2 Mg(OH)2 开始沉淀时 1.9 3.4 7.0 9.1 完全沉淀时 3.2 4.7 9.0 11.1 (1)上述流程中能加快反应速率的措施有_________、_________等。 (2)酸浸时发生反应 2MgO·SiO2 +2H2SO4=2MgSO4+SiO2+2H2O, 2MgO·B2O3+2H2SO4+H2O=2H3BO3+2MgSO4。 ①上述反应体现出酸性强弱:H2SO4______H3BO3(填“>”或“<”)。 ②酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:_______________________________、____________________________________。 ③已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3+OH- =B(OH)4-。下列关于硼酸的说法正确的是_____。 a.硼酸的电离方程式可表示为:H3BO3 + H2OB(OH)4-+H+ b.硼酸是一元弱酸 c.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生 (3)检验浸出液中的杂质离子 取少量浸出液,__________________________(填操作和现象),证明溶液中含有Fe2+。 (4)除去浸出液中的杂质离子 用MgO调节溶液的pH至____以上,使杂质离子转化为______(填化学式)沉淀,过滤。 (5)获取晶体 ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和; ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜(高压环境可保证在高温条件下水为液态)中,__________________________ (将方法补充完整)。 28.(15分)已知有关热化学方程式为: ① 4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-905kJ/mol; ② 3H2(g)+N2(g)2NH3(g) △H=-92.4kJ/mol; ③ 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol; ④ N2(g)+O2(g)=2NO(g) △H=QkJ/mol; (1)Q=___________。 (2)向某密闭容器中充入amolNH3、bmolO2后,测得反应体系中某种量值X与压强P、温度T之间的变化如图1所示,图2表示温度为T2时,当容器为1L恒容密闭容器时,容器中NH3的平衡转化率与反应开始时两种反应物的投料之比(用M表示)的关系。 ①若X表示NH3的百分含量,则T2_____T1(填>、<、无法确定);d、e两点的正反应的平衡常数K(d)_____K(e)。 ②X还可以表示_____________。 a.混合气体的平均摩尔质量 b.NO的产率 c.△H值 ③M=__________(用含a、b的式子表示,后同),若f点M=1.25,则此时O2的转化率为_________。 (3)有科学家电解原理获得高产率的合成氨,则阴极上的电极反应式为(已知电解质能传递H+)___________________________。 35.(15分)配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。 (1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。 (2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________ ,写出与 CO互为等电子体的分子的电子式:___________________。 (3)C、O、Fe的第一电离能由大到小的顺序为_______________________。 (4)关于Fe(CO)5,下列说法正确的是______。 A.Fe(CO)5是非极性分子,CO是极性分子 B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键 C.1 mol Fe(CO)5含有10 mol配位键 D. Fe(CO)5==Fe+5CO反应中没有新化学键生成 (5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。 ①上述三种晶体的晶胞中属于面心晶胞的是______ (填“a”“δ””或“γ”)- Fe。 ②a-Fe晶胞中铁原子的配位数为_______________。 ③γ-Fe晶胞的边长为a pm,则γ- Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。 36.(15分)某医药中间体F的制备流程如下(部分产物已略去)。 已知:(R、R1、R2、R3表示烃基) (1)F中含有官能团的名称是羰基和_____________。 (2)电石(CaC2)与水反应生成乙炔的化学方程式是_____________________________。 (3)A不能发生银镜反应,则A的结构简式是_____________。 (4)反应①~④中,属于加成反应的是_____________(填序号)。 (5)反应⑥的化学方程式是_____________________________________________。 (6)反应⑦的化学方程式是_________________________________________________。 (7)某聚合物H的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物H的结构简式是_____________。 (8) 以B和G为起始原料合成C,选用必要的无机试剂,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_____________________________。 【参考答案】 7.D 8.A 9.A 10.D 11.A 12.B 13.B 26.圆底烧瓶 ZnS2O4+2NaOHNa2S2O4 + Zn(OH)2¯ 排出装置中残留的O2或空气(或防止生成物Na2S2O4被氧化) 加入氯化钠,增大了Na+离子浓度,促进Na2S2O4结晶析出(用沉淀溶解平衡解释可以 取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 2Ag++S2O42—+4OH—=2Ag↓+2SO32—+2H2O 滴入最后一滴I2,溶液变为蓝色,且半分钟不褪色 3.16nv/m(或316nv/m%或3.16nv/m×100%) 27.研磨 加热 > Al2O3+6H+=2Al3++3H2O FeO+2H+=Fe2++H2O ab 滴加K3[Fe(CN)6]溶液,产生蓝色沉淀(合理答案给分) 4.7 Al(OH)3、Fe(OH)3 升温结晶,得到硫酸镁晶体,分离后,再将母液降温结晶,分离得到硼酸晶体 28. +180.5 > < a b/a 60% N2+6e-+6H+=2NH3 35.3d64s2 分子 C≡O O>C>Fe A、C γ 6 36. 羧基 CaC2+2H2O = Ca(OH)2+C2H2↑ HOCH2CCCH2OH ①和② 查看更多