- 2021-04-15 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年广西桂林十八中高一上学期段考化学试题
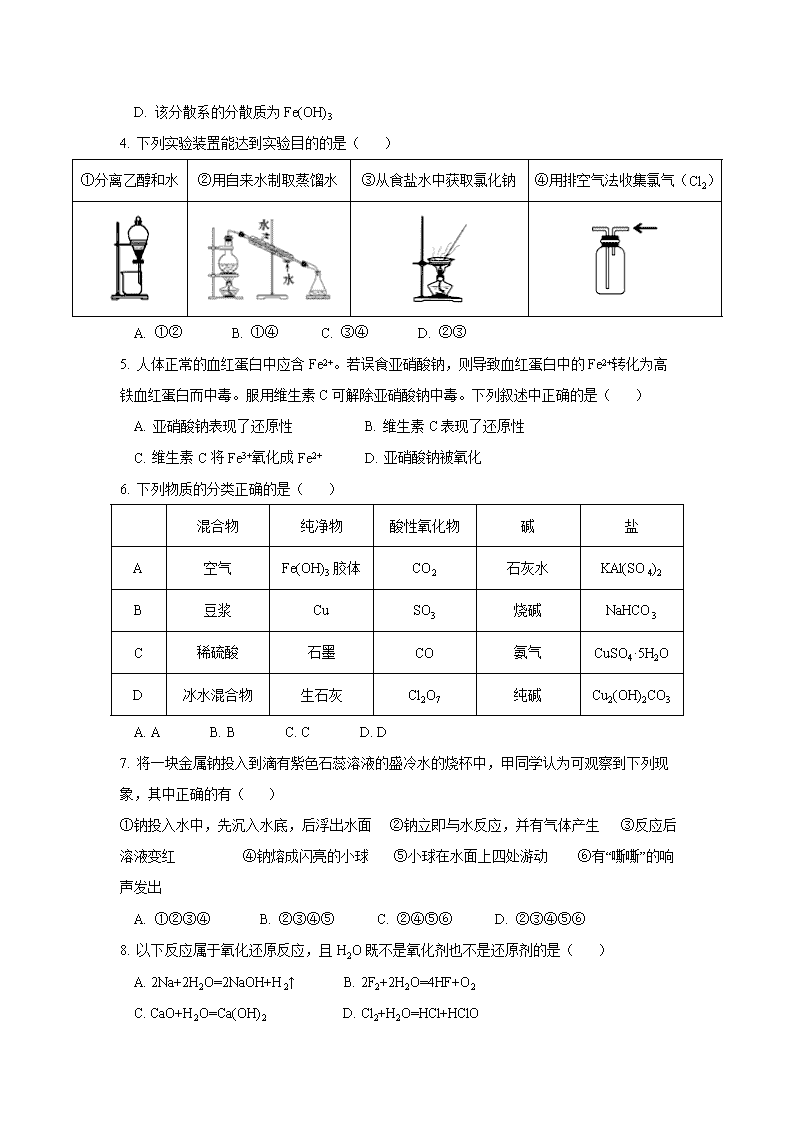
2018-2019学年广西桂林十八中高一上学期段考化学试题 注意:1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。考试时间: 90 分钟 。答卷前,考生务必将自己的姓名和考号填写或填涂在答题卷指定的位置,将条形码张贴在指定位置 2、选择题答案用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案;不能答在试题卷上。 3、主观题必须用黑色字迹的钢笔或签字笔在答题卷上作答,答案必须写在答题卷各题目指定区域内的相应位置上,超出指定区域的答案无效;如需改动,先划掉原来的答案,然后再写上新的答案。 可能用到的相对原子质量: H—1 C—12 N—14 O—16 S—32 Cl—35.5 Na—23 K—39 Mg—24 Al—27 Ca—40 第I卷(选择题,共 55 分) 一、选择题(本题共20小题,每小题只有一个选项符合题意。1-5题每小题2分,6-20题每小题3分,共55分) 1. 从20世纪90年代开始,叠氮化钠用作汽车司机安全防护袋的气源,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。装运叠氮化钠的包装箱所贴的危险化学品标志应该是( ) A B C D 剧毒品 爆炸品 易燃液体 易燃液体 2. 日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是( ) A. 钢铁生锈 B. 充有H2的“喜羊羊”娃娃遇明火发生爆炸 C. 食物腐败变质 D. 大理石雕像被酸雨腐蚀毁坏 3. 磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径为5.5~36nm的磁流体。下列说法中正确的是( ) A. 所得到的分散系属于胶体 B. 用一束光照射该分散系时,看不到一条光亮的“通路” C. 该分散系不能透过滤纸 D. 该分散系的分散质为Fe(OH)3 4. 下列实验装置能达到实验目的的是( ) ①分离乙醇和水 ②用自来水制取蒸馏水 ③从食盐水中获取氯化钠 ④用排空气法收集氯气(Cl2) A. ①② B. ①④ C. ③④ D. ②③ 5. 人体正常的血红蛋白中应含Fe2+。若误食亚硝酸钠,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸钠中毒。下列叙述中正确的是( ) A. 亚硝酸钠表现了还原性 B. 维生素C表现了还原性 C. 维生素C将Fe3+氧化成Fe2+ D. 亚硝酸钠被氧化 6. 下列物质的分类正确的是( ) 混合物 纯净物 酸性氧化物 碱 盐 A 空气 Fe(OH)3胶体 CO2 石灰水 KAl(SO4)2 B 豆浆 Cu SO3 烧碱 NaHCO3 C 稀硫酸 石墨 CO 氨气 CuSO4·5H2O D 冰水混合物 生石灰 Cl2O7 纯碱 Cu2(OH)2CO3 A. A B. B C. C D. D 7. 将一块金属钠投入到滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( ) ①钠投入水中,先沉入水底,后浮出水面 ②钠立即与水反应,并有气体产生 ③反应后溶液变红 ④钠熔成闪亮的小球 ⑤小球在水面上四处游动 ⑥有“嘶嘶”的响声发出 A. ①②③④ B. ②③④⑤ C. ②④⑤⑥ D. ②③④⑤⑥ 8. 以下反应属于氧化还原反应,且H2O既不是氧化剂也不是还原剂的是( ) A. 2Na+2H2O=2NaOH+H2↑ B. 2F2+2H2O=4HF+O2 C. CaO+H2O=Ca(OH)2 D. Cl2+H2O=HCl+HClO 9. 海盐经溶解、过滤后仍含有Ca2+、Mg2+、Fe3+、SO42-等可溶性杂质,提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;④加入适量盐酸; ⑤溶解; ⑥过滤; ⑦蒸发.其正确的操作顺序是( ) A. ⑤①③②⑥④⑦ B. ⑤①②③⑥④⑦ C. ⑤②①③④⑥⑦ D. ⑤③②①⑥④⑦ 10. 下列转化过程中必须加入还原剂的是( ) A. FeS→H2S B. SO32-→SO2 C. Fe3+→Fe2+ D. Cu→Cu2+ 11. 下列物质溶于水,其电离方程式正确的是( ) A. NaHCO3 = Na++H++CO32- B. (NH4)2SO4 = NH4++SO42- C. NH4Cl = NH4+ + Cl- D. Ba(OH)2 = Ba2+ + OH2- 12. 若NA表示阿伏加德罗常数的值,下列叙述正确的是( ) ①标准状况下,2.24L四氯化碳含碳原子数为0.1NA ②标准状况下,aL氧气和氮气的混合气含有的分子数约为aNA/22.4 ③1mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA ④同温同压下,体积相同的氢气和氩气所含的原子数相等 ⑤46gNO2和N2O4混合气体中含有原子数为3NA ⑥1 L 0.5 mol·L−1 Na2SO4溶液中,含有的氧原子总数为2NA A. ②⑥ B. ②⑤ C. ②③ D. ②③⑥ 13. 下列两种气体的分子数一定相等的是( ) A. 质量相等、密度不等的N2和C2H4 B. 等压等体积的N2和CO2 C. 等压等密度的CO和N2 D. 等温等体积的O2和N2 14. 在某无色酸性溶液中能大量共存的一组离子是( ) A. NH4+ 、SO42- 、Al3+ 、NO3- B. Na+ 、K+ 、HCO3- 、NO3- C. Na+ 、Ca2+ 、NO3- 、I- D. K+、Cu2+ 、NH4+ 、NO3- 15. 在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( ) A. 溶液中有晶体析出,Na+数目变小 B. 溶液中有气体逸出,Na+数目增加 C. 溶质的质量分数增大 D. 溶液中Na+数目减少,溶质质量分数变小 16. 下列离子方程式书写正确的是( ) A. 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ B. 氢氧化钡与硫酸铜溶液混合:2OH- + Cu2+ = Cu(OH)2↓ C. 过量NaHCO3溶液和少量Ba(OH)2反应:2HCO3-+Ba2++2OH- = BaCO3↓+CO32-+2H2O D. 石灰乳和盐酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O 17. 硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol•L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( ) A. S2- B. S C. SO32- D. SO42- 18. 用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( ) A. 3∶2∶2 B. 1∶2∶3 C. 1∶3∶3 D. 3∶1∶1 19. 已知K2Cr2O7在酸性溶液中易被还原成Cr3+ ,PbO2、K2Cr2O7、Cl2、FeCl3、Cu2+的氧化性依次减弱。下列反应在水溶液中不可能发生的是( ) A. Cu+2Fe3+ = Cu2++2Fe2+ B. 3Pb2++ Cr2O72−+2H+ = 3PbO2+2Cr3++ H2O C. 2Fe2++Cl2 = 2Fe3++2Cl− D. 6Cl−+ Cr2O72−+14H+ = 2Cr3++3Cl2↑+7H2O 20. 汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 = K2O+5Na2O+16N2↑下列说法正确的是( ) A. KNO3是还原剂,其中氮元素被氧化 B. 生成物中的N2是氧化产物,K2O是还原产物 C. 每转移1 mol电子,可生成N2的体积为35.84 L D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol 第II卷(非选择题,共 45 分) 二、填空题(本题共4小题,共55分) 21. (11分)下列物质: ①Na ②Br2 ③Na2O ④SO3 ⑤NH3 ⑥H2S ⑦10mL1mol·L-1盐酸 ⑧H2SO4 ⑨Ba(OH)2 ⑩蔗糖 ⑪NaCl溶液。 (1)属于电解质的是____________________(填序号,下同), 属于非电解质的是 ___________________, 能导电的是_________________________ 。 (2)写出⑧与⑨在水中反应的离子方程式______________________________________________________。 (3)若将0.2mol钠、镁、铝分别投入到⑦中,在标准状况下产生氢气的体积之比是__________________。 22.(10分)某固体物质可能由K2SO4、KI、NaCl、CuCl2、CaCl2、Na2CO3中的一种或几种组成。依次进行下列五步实验。观察到的现象如下: ①混合物加水得无色透明溶液; ②向上述溶液中滴加BaCl2溶液,有白色沉淀生成,将该沉淀滤出,并将滤液分成两份; ③上述白色沉淀可完全溶于稀盐酸; ④往一份滤液中滴加氯水并加入CCl4,振荡后静置CCl4层呈无色(氯水能将I-氧化为I2); ⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。 由此可推断出: (1)写出③中白色沉淀可完全溶于稀盐酸的离子方程式_______________________________________。 (2)写出⑤中生成白色沉淀的离子方程式___________________________________________________。 (3)该固体中一定含有______________________;无法确定是否含有的是_______________________。 (4)确定该物质是否存在的方法是 _________________________________________________________。 23.(10分)某校环保兴趣小组在处理污水样品时,需用220mL 0.1mol/L的稀盐酸溶液,现用质量分数为36.5%、密度为1.19g/cm3的浓盐酸来配制。 (1)配制上述溶液需要的玻璃仪器除烧杯和玻璃棒外有_______________________________________。 (2)根据计算,本实验需要用量筒量取浓盐酸的体积为____________mL。 (3)配制过程有下列几步操作: A. 将蒸馏水加入容量瓶至液面接近刻度线1~2cm处; B.量取所需体积的盐酸溶液,注入烧杯中,用玻璃棒搅拌,使其混合均匀; C.用胶头滴管加水至刻度线; D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也转移到容量瓶中; E.向烧杯中加入约20mL蒸馏水; F.待烧杯中溶液冷却后,沿玻璃棒转移到容量瓶中; G.盖好瓶塞,反复颠倒摇匀,静置,装瓶。 以上各步骤的先后顺序是_________________(填字母),使用容量瓶之前需要进行的一步操作是_________。 (4)假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值偏高的是________________ A. 容量瓶中有少量蒸馏水 B. 稀释浓HCl时,没有冷却就立即转移到容量瓶中 C. 配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中 D. 定容时俯视 24.(14分) Ⅰ.(1) ①H2 + CuO Cu + H2O ②CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O ③3S + 6NaOH 2Na2S + Na2SO3 + 3H2O ④NH4NO3 + Zn = ZnO + N2↑+ 2H2O ⑤Cu2O + 4HCl = 2HCuCl2 + H2O 上述反应中,属于氧化还原反应的是__________________________(填序号) (2)SeO2、KI和HNO3可发生反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O,配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目:__________________________________________________________。 (3)在反应 KIO3 + 6HI = 3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为_______________。 Ⅱ.已知: ① 2H2O + Cl2 + SO2 = H2SO4 + 2HCl ② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O (4)根据以上两个反应可以得出氧化剂和还原剂的强弱顺序,请写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:_______________________________________________________________________________________。 在反应②中,若有18.25g HCl被氧化,求: (5)转移的电子数为:_______________。 (6)标况下生成Cl2的体积(请列式计算)。 答案: 一、选择题(每题2分) 1 2 3 4 5 6 7 8 9 10 B D A D B B C D D C 11 12 13 14 15 16 17 18 19 20 C B A A A C D C B D 二、填空题(除特别注明外,每空2分,共45分) 21.(11分)(1)③⑥⑧⑨ ④⑤⑩ ①⑦⑪ (2)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O (3分) (3)20:1:1 22.(10分)(1)BaCO3+2H+=Ba2++H2O+CO2↑ (2)Ag++Cl-=AgCl↓ (3)Na2CO3 (4) NaCl (5)取①所得溶液,滴加硝酸酸化的硝酸银溶液,若出现白色沉淀,说明原固体 中有NaCl,反之则无 23.(10分)(1)250mL容量瓶,胶头滴管,量筒 (2)2.1 (3) EBFDACG 检漏 (4) BD 24.(14分)(1)①③④ 得4e- (2)SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O(4分) 失4e- (3)1:5 (4)2KMnO4+5SO2+ 2H2O = K2SO4+ 2MnSO4+2H2SO4 (5)0.5NA或3.01×1023 (6)5.6L(过程略) 答案: 一、选择题(每题2分) 1 2 3 4 5 6 7 8 9 10 B D A D B B C D D C 11 12 13 14 15 16 17 18 19 20 C B A A A C D C B D 二、填空题(除特别注明外,每空2分,共45分) 21.(11分)(1)③⑥⑧⑨ ④⑤⑩ ①⑦⑪ (2)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O (3分) (3)20:1:1 22.(10分)(1)BaCO3+2H+=Ba2++H2O+CO2↑ (2)Ag++Cl-=AgCl↓ (3)Na2CO3 (4) NaCl (5)取①所得溶液,滴加硝酸酸化的硝酸银溶液,若出现白色沉淀,说明原固体 中有NaCl,反之则无 23.(10分)(1)250mL容量瓶,胶头滴管,量筒 (2)2.1 (3) EBFDACG 检漏 (4) BD 24.(14分)(1)①③④ 得4e- (2)SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O(4分) 失4e- (3)1:5 (4)2KMnO4+5SO2+ 2H2O = K2SO4+ 2MnSO4+2H2SO4 (5)0.5NA或3.01×1023 (6)5.6L(过程略)查看更多