2019届一轮复习人教版专题七 元素周期律和元素周期表学案
专题七 元素周期律和元素周期表
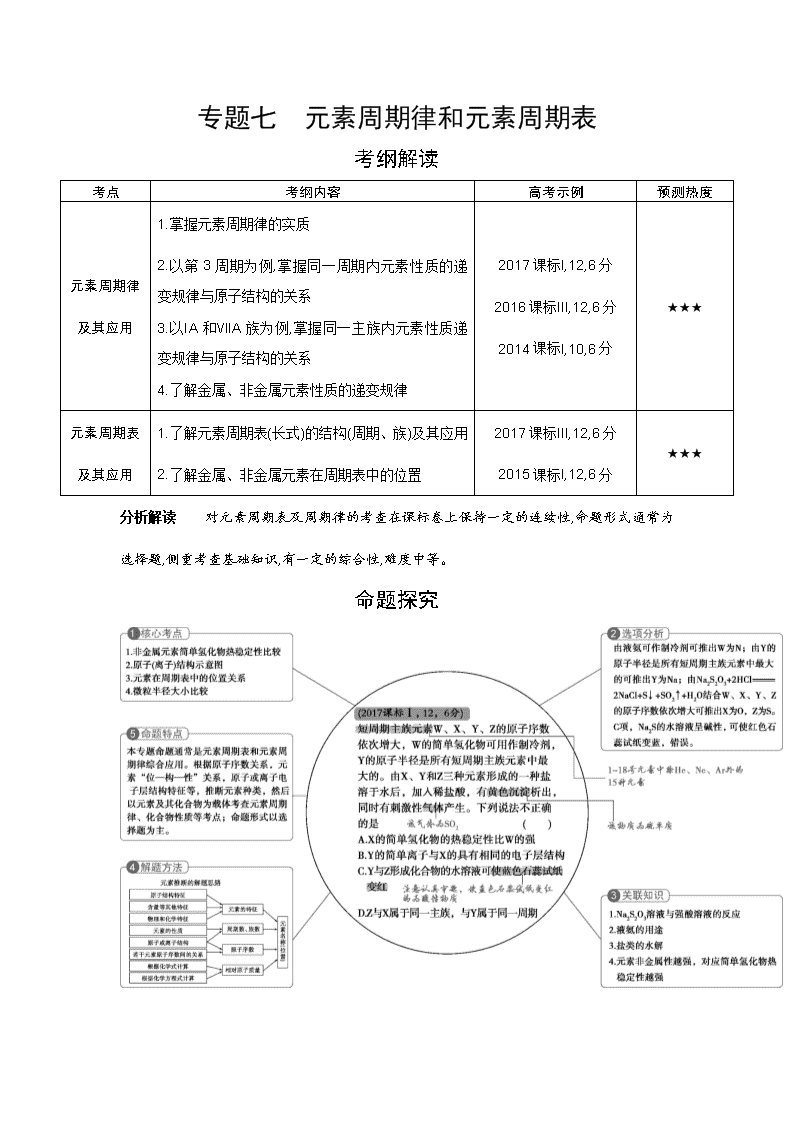
考纲解读
考点
考纲内容
高考示例
预测热度
元素周期律
及其应用
1.掌握元素周期律的实质
2.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系
3.以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系
4.了解金属、非金属元素性质的递变规律
2017课标Ⅰ,12,6分
2016课标Ⅲ,12,6分
2014课标Ⅰ,10,6分
★★★
元素周期表
及其应用
1.了解元素周期表(长式)的结构(周期、族)及其应用
2.了解金属、非金属元素在周期表中的位置
2017课标Ⅲ,12,6分
2015课标Ⅰ,12,6分
★★★
分析解读 对元素周期表及周期律的考查在课标卷上保持一定的连续性,命题形式通常为选择题,侧重考查基础知识,有一定的综合性,难度中等。
命题探究
五年高考
考点一 元素周期律及其应用
1.(2017课标Ⅱ,9,6分)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
答案 B
2.(2016课标Ⅲ,12,6分)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:W
Z
答案 B
3.(2016江苏单科,4,2分)短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是( )
A.元素X、W的简单阴离子具有相同的电子层结构
B.由Y、Z两种元素组成的化合物是离子化合物
C.W的简单气态氢化物的热稳定性比Y的强
D.原子半径:r(X)b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
答案 B
5.(2015福建理综,10,6分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。下列说法不正确的是( )
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
答案 A
6.(2015浙江理综,9,6分)下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是( )
X
Y
Z
W
T
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3汽化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
答案 D
7.(2014课标Ⅰ,10,6分)X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
答案 D
8.(2015天津理综,7,14分)随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在周期表中的位置是 。
(2)比较d、e常见离子的半径大小(用化学式表示,下同): > ;比较g、h的最高价氧化物对应水化物的酸性强弱: > 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式: 。
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式: 。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol ·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
①R溶液中,离子浓度由大到小的顺序是 。
②写出m点反应的离子方程式: 。
③若在R溶液中改加20 mL 1.2 mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
答案 (14分)(1)第三周期ⅢA族
(2)r(O2-) r(Na+) HClO4 H2SO4
(3) (或 等其他合理答案均可)
(4)2Na(s)+O2(g) Na2O2(s) ΔH=-511 kJ·mol-1
(5)①c(S)>c(N)>c(Al3+)>c(H+)>c(OH-)
②N+OH- NH3·H2O ③0.022
教师用书专用(9—12)
9.(2013江苏单科,10,2分)短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是( )
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)
B.元素Z、W的简单离子的电子层结构不同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物
答案 D
10.(2013天津理综,3,6分)下列有关元素的性质及其递变规律正确的是( )
A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
答案 A
11.(2013福建理综,9,6分)四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
A.原子半径ZQ
答案 BD
考点二 元素周期表及其应用
1.(2017课标Ⅲ,12,6分)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
A.氢化物沸点:WW
C.化合物熔点:Y2X3X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:YAl>C>O>H (2)C2H2
(3) Na+[······]2-Na+
①NaAlO2 Al+2H2O+CO2 Al(OH)3↓+HC[或2Al+3H2O+CO2 2Al(OH)3↓+C]
②C+H2O HC+OH-
c(Na+)>c(HC)>c(C)>c(OH-)>c(H+)
NaCl、NaHCO3、CO2(或H2CO3)
教师用书专用(9—10)
9.(2015山东理综,8,5分)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
A.原子半径:XZ
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
答案 C
10.(2013浙江理综,9,6分)短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
X
Y
Z
W
Q
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
答案 A
三年模拟
A组 2016—2018年模拟·基础题组
考点一 元素周期律及其应用
1.(人教必2,一-2-3,变式)根据元素周期表和元素周期律分析,下列选项不正确的是( )
A.稳定性:NH3H2SO4>H3PO4
C.碱性:KOH>NaOH>Mg(OH)2
D.还原性:F-C->B2+
B.C元素的最高正价为+7价
C.对应气态氢化物的稳定性:H2A>HC
D.还原性:C->A2-
答案 A
4.(2017山东省实验中学一诊,12)不能作为判断硫、氯两种元素非金属性强弱的依据的是( )
A.单质氧化性的强弱
B.单质沸点的高低
C.单质与氢气化合的难易
D.最高价氧化物对应水化物的酸性强弱
答案 B
5.(2017河南3月适应性测试,7)短周期元素X、Y、Z、W的原子序数依次增大。它们的原子最外层电子数之和为13,X的原子半径比Y小,其中X与W同主族。一种常见的无色无味液体分解可以得到X和Z元素的单质。下列说法中不正确的是( )
A.X、Y、Z三种元素可以形成离子化合物
B.元素X 和W之间不可能形成二元化合物
C.元素Y的简单气态氢化物的热稳定性比Z的弱
D.元素Y、Z、W中,元素W的简单离子的半径最小
答案 B
6.(2017广东广雅、江西南昌二中联考,9)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同的电子层结构,X的原子半径是短周期主族元素中最大的,W与Y同主族,Z与X形成二元化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:WZ
答案 B
7.(2016广东珠海摸底,12)已知短周期元素R、W、X、Y、Z的原子序数依次增大,其氢化物中上述元素的化合价如下表,下列说法正确的是( )
元素
R
W
X
Y
Z
化合价
-4
-1
-4
-2
-1
A.离子还原性:Y2-Z-
C.气态氢化物稳定性:RH4Z>Y
答案 C
考点二 元素周期表及其应用
9.(2018湖南益阳、湘潭调研,13)X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,其中只有Z是金属元素,W的单质是黄色晶体,X、Y、W在周期表中的相对位置关系如图所示。下列说法不正确的是( )
X
Y
W
A.5种元素中,原子半径最大的是Z
B.Y与Z形成的化合物都可以和盐酸反应
C.Z与Q形成的化合物水溶液一定显酸性
D.W的简单阴离子比Q的简单阴离子还原性强
答案 C
10.(2017吉林通化一检,10)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
X
Y
Z
W
Q
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
答案 A
11.(2017广东茂名二模,10)短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为15。X与Y、Z、W位于相邻周期,Z最外层电子数与周期数相等,W的一种氧化物是主要的大气污染物。下列叙述正确的是( )
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.最高价氧化物对应的水化物的碱性:Y>Z
C.X、W的简单气态氢化物都易溶于水
D.Z的最高价氧化物对应的水化物一定能溶于X的最高价氧化物对应的水化物
答案 B
12.(2016北京海淀期中,8)下图是元素周期表的一部分,下列关系判断正确的是( )
W
X
Z
Y
R
A.原子半径:Y>X>W
B.氢化物的沸点:W>X>Y
C.氢化物的稳定性:R>Y>X
D.简单阴离子的还原性:Y>R>Z
答案 D
13.(2016安徽合肥质检,15)X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如下表所示;X的单质在氧气中燃烧能生成两种无色气体,Y的最简单气态氢化物的水溶液显碱性。
X
Z
回答下列问题:
(1)元素X在周期表中位于 族;W和Z的气态氢化物稳定性比较,其较强的是 (填化学式)。
(2)W的单质与水反应生成的含氧酸的电子式为 。
(3)在BaCl2溶液中加入少量Y的最高价氧化物对应水化物的溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀 (填化学式)。
答案 (1)第ⅣA HCl (2) (3)BaSO4
B组 2016—2018年模拟·提升题组
(满分80分 时间:30分钟)
一、选择题(每小题6分,共48分)
1.(人教必2,一-2-8,变式)如图表示元素周期表前四周期的一部分,下列关于元素X、Y、Z、W的叙述正确的是( )
X
Y
Z
W
①Y、Z的最高价氧化物对应的水化物的酸性为YY>Z
C.Z的单质常温下是液体,可与铁粉反应
D.Z的原子序数比Y大9
答案 D
4.(2017江西六校联考,11)几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述不正确的是( )
A.一定条件下,Z单质与W的常见单质直接生成ZW
B.X最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物能反应
C.Y的最高价氧化物对应的水化物不能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
答案 B
5.(2017安徽宣城第二次调研,11)A、B、C、D为短周期主族元素,25 ℃时,其最高价氧化物对应水化物的溶液(浓度均为0.1 mol·L-1) 的pH和原子序数的关系如图所示。下列有关说法正确的是( )
A.简单离子半径:D>C>A>B
B.D元素氧化物对应水化物一定是强酸
C.B、C的简单离子都能破坏水的电离平衡
D.氢化物还原性:C>D
答案 D
6.(2017山东、湖北部分重点中学联考,13)已知A、B、C、D、E为短周期中原子序数依次增大的元素,A元素的原子可以形成简单阳离子和简单阴离子,B的原子最外层电子数是其周期序数的2倍,A、B、C形成的某些化合物可与C的单质连续反应生成不同类别的物质,D为短周期中原子半径最大的元素,E的单质可用于计算机芯片的制造。下列说法不正确的是( )
A.A、B可以形成直线形化合物
B.A、B、C三种元素形成的某些化合物可以再生
C.A、B、C、D四种元素形成的化合物水溶液可能显酸性
D.B的单质与C、E的化合物之间的反应一定是置换反应
答案 D
7.(2017湖北黄冈3月质检,11)下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是( )
M
N
X
Y
Z
A.氢化物的稳定性:N>Z,是因为N的氢化物分子间可形成氢键
B.元素的非金属性:M>Y,是因为单质M能与YN2反应生成单质Y
C.熔沸点:YN2>MN2,是因为YN2的分子间作用力强
D.简单离子的半径:N>X,是因为它们具有相同的电子层结构且X的核电荷数更大
答案 D
8.(2016江西九江七校一联,7)X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16。下列说法正确的是( )
A.Q与W能形成10 电子分子,不能形成14电子、18电子分子
B.Y的最高价氧化物对应水化物的化学式只能表示为H4YO4
C.Y、Z、Q分别与X化合,只能形成AB2型化合物
D.X、Z、W中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性
答案 D
二、非选择题(共32分)
9.(2017山东省实验中学一诊,20)(16分)X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质是黄绿色有毒气体。请回答下列问题:
(1)R在元素周期表中的位置为 。
(2)Z、Q、M简单离子半径由大到小的顺序为 (写元素离子符号)。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因: (用离子方程式表示)。溶液中所含离子浓度由大到小的顺序为 。
(4)YX4M的电子式为 ,Q3Y2可与水剧烈反应,产生沉淀与气体,反应的化学方程式为 。
(5)X、Z两元素形成的原子个数比为1∶1的化合物中含有的化学键类型为 。
(6)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为 。
答案 (1)第三周期ⅠA族
(2)Cl->O2->Mg2+
(3)N+H2O NH3·H2O+H+
c(N)>c(N)>c(H+)>c(OH-)
(4) Mg3N2+6H2O 3Mg(OH)2+2NH3↑
(5)共价键
(6)Cl2+2OH- ClO-+Cl-+H2O
10.(2016上海理工附中摸底,五)(16分)下表列出了五种短周期元素A、B、C、D、E的信息,请推断后作答:
元素
有关信息
A
元素主要化合价为-2,原子半径为0.074 nm
B
所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小
C
原子半径为0.102 nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰
D
最高价氧化物对应的水化物能按1∶1电离出电子数相等(10个电子)的阴、阳离子
E
原子半径为0.075 nm,最高价氧化物对应水化物与其氢化物可组成一种盐X
(1)写出A、E的元素符号: 、 。
(2)写出D元素最高价氧化物对应水化物的电子式: 。
(3)盐X的水溶液显 (选填“酸”“碱”或“中”)性,用离子方程式解释其原因: 。
(4)D2CA3的溶液与B的单质能发生氧化还原反应,其反应的离子方程式为 。
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y在常温下为液态,Y的化学式为 ,Y所含的化学键为 (填字母序号)。
a.极性键 b.非极性键 c.离子键
答案 (1)O N (2)
(3)酸 N+H2O NH3·H2O+H+
(4)Cl2+S+H2O 2Cl-+S+2H+
(5)N2H4 ab
C组 2016—2018年模拟·方法题组
方法1 微粒半径大小的比较方法
1.(2018山东省实验中学一诊,6)下图是部分短周期元素原子半径与原子序数的关系图,则下列说法正确的是( )
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
答案 D
2.(2018河北武邑中学三调,17)短周期主族元素A、B、C、D的原子序数依次增大。已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半。下列叙述正确的是( )
A.简单离子的半径:B>C>D>A
B.B与C形成的化合物在水溶液中能稳定存在
C.C与D不可能形成化合物C2D2
D.B与D形成的化合物溶于水所得溶液显酸性
答案 D
3.(2017浙江名校协作体联考,14)X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
W
X
Y
Z
A.Z、X、Y形成的简单气态氢化物稳定性依次增强
B.四种元素形成的单质最多有6种
C.四种元素的原子半径:rZ>rY>rX>rW
D.四种元素中,X的氧化物对应的水化物酸性最强
答案 A
4.(2017湖北荆门调研,13)X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同。25 ℃
时,0.1 mol/L X和W形成的化合物的水溶液pH=1。下列说法中正确的是( )
A.Z与Y、Z与W形成的化合物的化学键类型完全相同
B.Y、Z、W三种元素组成的化合物的水溶液可能显碱性
C.简单离子的半径:Z>R>W>Y
D.因非金属性Y>R,所以X与Y组成的化合物的沸点低于X与R组成的化合物
答案 B
5.(2016上海理工附中摸底,8)同周期的X、Y和Z三种元素,已知关系如下:HXO4、H2YO4和H3ZO4三种最高价含氧酸的酸性依次减弱。下列判断一定不正确的是( )
A.非金属性:X最强,Z最弱
B.原子半径:X最大,Z最小
C.气态氢化物稳定性:HX最强
D.气态氢化物水溶液酸性:ZH3r(T2-)
B.R的氧化物对应的水化物可能具有两性
C.X单质在氧气中燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
答案 B
7.(2017山西五校一联,4)X、Y、Z、W为四种短周期主族元素,且原子序数依次增大,其中X、Z同主族,Y是短周期主族元素中原子半径最大的,X是农作物生长的三种必需营养元素之一,W的单质以前常用于自来水消毒。下列说法正确的是( )
A.Z的最高价氧化物对应水化物能形成多种含Y元素的盐
B.W的氧化物对应水化物的酸性一定强于Z
C.Y的单质应该保存在水中
D.X的氢化物沸点比Z的氢化物沸点低
答案 A
8.(2016湖北黄冈质检,9)W、X、Y、Z均为前20号元素,原子序数依次增加,且分属不同的周期;W和Z、X和Y分别同主族;它们的最外层电子数之和为14。下列说法正确的是( )
A.氢化物的沸点:HmX>HmY
B.X、Y、Z形成的化合物的水溶液一定显中性
C.离子半径:YK+>Al3+