- 2021-04-15 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北省宣化一中2020届高三下学期高考押题卷(一)理科综合化学试题
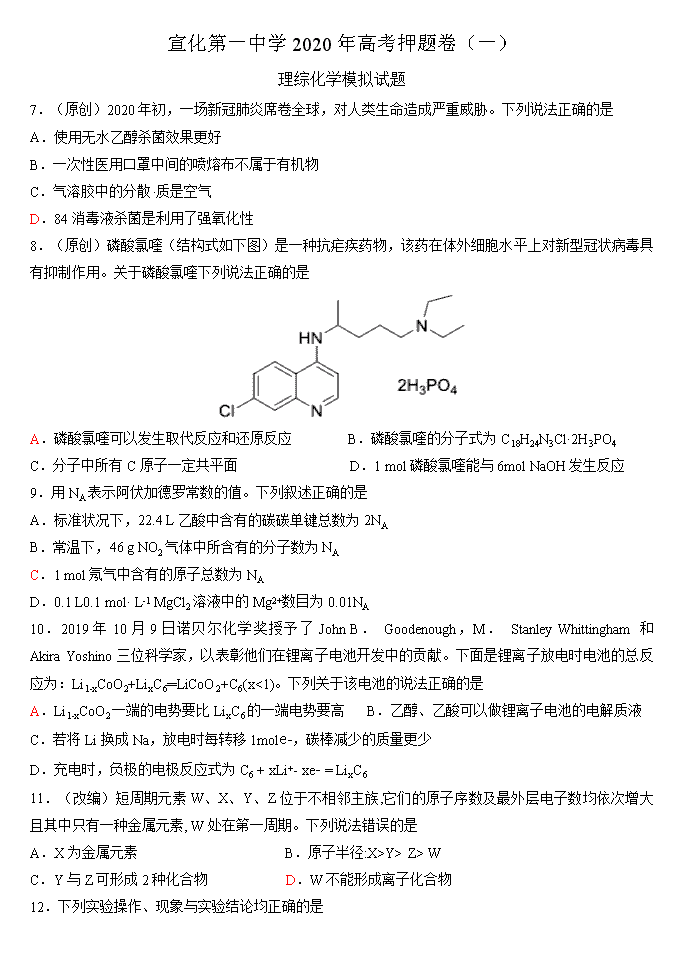
宣化第一中学2020年高考押题卷(一) 理综化学模拟试题 7.(原创)2020年初,一场新冠肺炎席卷全球,对人类生命造成严重威胁。下列说法正确的是 A.使用无水乙醇杀菌效果更好 B.一次性医用口罩中间的喷熔布不属于有机物 C.气溶胶中的分散·质是空气 D.84消毒液杀菌是利用了强氧化性 8.(原创)磷酸氯喹(结构式如下图)是一种抗疟疾药物,该药在体外细胞水平上对新型冠状病毒具有抑制作用。关于磷酸氯喹下列说法正确的是 A.磷酸氯喹可以发生取代反应和还原反应 B.磷酸氯喹的分子式为C18H24N3Cl·2H3PO4 C.分子中所有C原子一定共平面 D.1 mol磷酸氯喹能与6mol NaOH发生反应 9.用NA表示阿伏加德罗常数的值。下列叙述正确的是 A.标准状况下,22.4 L乙酸中含有的碳碳单键总数为2NA B.常温下,46 g NO2气体中所含有的分子数为NA C.1 mol氖气中含有的原子总数为NA D.0.1 L0.1 mol· L-1 MgCl2溶液中的Mg2+数目为0.01NA 10.2019年10月9日诺贝尔化学奖授予了John B. Goodenough,M. Stanley Whittingham 和 Akira Yoshino三位科学家,以表彰他们在锂离子电池开发中的贡献。下面是锂离子放电时电池的总反应为:Li1-xCoO2+LixC6═LiCoO2+C6(x<1)。下列关于该电池的说法正确的是 A.Li1-xCoO2一端的电势要比LixC6的一端电势要高 B.乙醇、乙酸可以做锂离子电池的电解质液 C.若将Li换成Na,放电时每转移1mole-,碳棒减少的质量更少 D.充电时,负极的电极反应式为C6 + xLi+- xe- = LixC6 11.(改编)短周期元素W、X、Y、Z位于不相邻主族,它们的原子序数及最外层电子数均依次增大且其中只有一种金属元素, W处在第一周期。下列说法错误的是 A.X为金属元素 B.原子半径:X>Y> Z> W C.Y与Z可形成2种化合物 D.W不能形成离子化合物 12.下列实验操作、现象与实验结论均正确的是 选项 实验操作、现象 实验结论 A 用酸化的NaCl溶液、Zn电极、Fe电极组成原电池,向铁电极区滴入2滴铁氰化钾溶液,产生蓝色沉淀 Zn、Fe构成原电池,Fe做负极 B 向酸性KMnO4溶液中加入H2C2O4溶液,紫色溶液褪为无色 发生反应:2MnO4−+5C2O42−+16H+═2Mn2++10CO2↑+8H2O C 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后,观察到其一分层,另一不分层 分层的是矿物油,不分层的是植物油 D 一小粒金属钠投入装有无水乙醇的试管中,一段时间后,钠慢慢浮至乙醇表面 密度:乙醇大于钠 13.(改编)草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为c(HC2O4-)/c(H2C2O4)或c(C2O42-)/c(HC2O4-)]与pH的变化关系如图所示。下列说法一定正确的是( ) A.Ⅱ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系 B.pH=1.22的溶液中:2c(C2O42﹣)+c(HC2O4﹣)>c(Na+) C.1.22<pH<4.19的溶液中:c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4) D.pH=4.19的溶液中:c(Na+)=3c(HC2O4﹣) 26.(改编)能消灭新冠病毒的二氧化氯(ClO2)一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。 (1)工业上制备ClO2的反应原理常采用: 2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。 ①浓盐酸在反应中显示出来的性质是___________(填序号)。 A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性 ②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为_________mol。 (2)目前已开发出用电解法制取ClO2的新工艺。 ①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:______________________________。 ②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 _______________________________________________________________________________________。 (3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。现用ClO 2将某工厂污水中CN- 氧化,只生成两种气体,其离子反应方程式为_________________________________________________; Cl2也能将污水中的CN-氧化为无毒的物质,自身被还原,原理同ClO2。处理含CN-相同量的污水,所需Cl2的物质的量是ClO2的_______倍(保留小数点后一位有效数字) (4)利用ClO2进行消毒。除了利用第(1)问中氯酸钠(NaClO3)与浓盐酸反应来制取ClO2以外,还可以用NaClO3和Na2C2O4在溶液中混合可以制取ClO2,反应的化学方程式为(已知Na2C2O4被氧化为Na2CO3):________________________________________ __。 比较这两种制取ClO2的方法,你认为工业生产ClO2较好的方法是________________(填前者或后者),理由是: _______________________________________________________________________。 27.常用调味剂花椒油是一种从花椒籽中提取的水蒸气挥发性香精油,溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。 实验步骤: (一)在A装置中的圆底烧瓶中装入容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20 g花椒籽粉和50 mL水。 (二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。 (三)向馏出液中加入食盐至饱和,再用15 mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体倾倒入蒸馏烧瓶中,蒸馏得花椒油。 (1)装置A中玻璃管的作用是______________________________________。 装置B中圆底烧瓶倾斜的目的是_____________________________________。 (2)步骤(二)中,当观察到________________现象时,可停止蒸馏。蒸馏结束时,下列操作的顺序为____________(填标号)。 ①停止加热 ②打开弹簧夹 ③关闭冷凝水 (3)在馏出液中加入食盐的作用是___________________________________; 加入无水Na2SO4的作用是________________________________________。 (4)实验结束后,用稀NaOH溶液清洗冷凝管,反应的化学方程式为 ____________________________________________________________。(残留物以表示) (5)为测定花椒油中油脂的含量,取20.00 mL花椒油溶于乙醇中,加80.00 mL 0.5 mol/L NaOH的乙醇溶液,搅拌,充分反应,加水配成200 mL溶液。取25.00 mL加入酚酞,用0.1 moI/L盐酸进行滴定,滴定终点消耗盐酸20.00 mL。则该花椒油中含有油脂____________g/L。 (以计,式量:884)。 35.铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题: (1)Fe原子的核外电子排布式为___________________________________。 (2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提 高耐冲击性能和耐磨性能。第三电离能I3(Fe)________I3(Mn)(填“大于”或“小于”),原因 _____________________________________________________________________________________。 (3)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,________________熔点高,其主要原因是__________________________________________________________________________________。 (4)FeCl3可与KSCN溶液发生显色反应。SCN-的三种元素中电负性最大的是________________。 (5)液态环戊二烯中存在的微粒间相互作用有__________________________。 A.范德华力 B.氢键 C.σ键 D.π键 环戊二烯分子中碳原子的杂化轨道类型是__________________________。 配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是______________________________________。 (6)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____________(列出计算式)g·cm-3。 36. 7.解析:A选项中使用75%的乙醇溶液比无水乙醇杀菌效果好;B选项中喷熔布主要以聚丙烯为主要原料,属于有机高分子材料;C选项中气溶胶的分散剂是空气;D.选项84消毒液杀菌消毒利用次氯酸钠的强氧化性。 8.解析:A选项中磷酸氯喹含有氯原子可以发生水解这个取代反应,同时其结构内含有苯环可以发生和氢气的加成反应也是还原反应;B选项中分子式为C18H26N3Cl·2H3PO4 ;C选项存在烷烃基团所以所有C原子不能同处于一个平面;磷酸氯喹含有两个磷酸分子可以1︰6和氢氧化钠反应,同时分子中的氯原子可以1︰1和氢氧化钠反应。 9.C 10. 解析:在原电池中Li1-xCoO2一端,发生还原反应,得到电子。而LixC6的一端发生氧化反应,失去电子。电流与电子的导线的流动方向相反,电流是从电势高的一端流动到电势低的一端。所以Li1-xCoO2一端的电势要比LixC6的一端电势要高。故A选项正确。有乙醇、乙酸可以做锂离子电池的电解质液。乙醇、乙酸中有活泼氢,因而乙醇、乙酸不可以做锂离子电池的电解质液。故B选项不正确。锂离子电池,放电时每转移1mol e-,碳棒减少7g;若将Li换成Na,放电时每转移1mol e-,碳棒减少23g。因而,若将Li换成Na,放电时每转移1mol e-,碳棒减少的质量更多。故C选项不正确。充电时,电源负极与阴极相连,发生还原反应C6 +xLi++xe- = LixC6。故D选项不正确。 11.D 12.C 13.解析:二元弱酸草酸的K1=c(HC2O4-)×c(H+)/c(H2C2O4)>K2=c(C2O42-) ×c(H+)/c(HC2O4-),当溶液的pH相同时,c(H+)相同,lgX:Ⅰ>Ⅱ,则Ⅰ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系,Ⅱ表示lg c(C2O42-)/c(HC2O4-)与pH的变化关系。故A错误; B.pH=1.22时,溶液呈酸性,则c(H+)>c(OH﹣),根据电荷守恒: c(Na+)+c(H+)=c(HC2O4﹣)+2c(C2O42-)+c(OH-)可知,2c(C2O42﹣)+c(HC2O4-)>c(Na+),故B正确; C.lgX为增函数,pH=1.22时,曲线Ⅰ中,lgX=lgc(HC2O4-)/c(H2C2O4)=0时,c(HC2O4-)=c(H2C2O4) ,曲线Ⅱ中lgX=lg c(C2O42-)/c(HC2O4-)=﹣3,103c(C2O42-)=c(HC2O4-)=c(H2C2O4);pH=4.19时,曲线Ⅰ中,lgX=lgc(HC2O4-)/c(H2C2O4)=3,c(HC2O4-)=103c(H2C2O4),曲线曲线Ⅱ中,lgX=lg c(C2O42-)/c(HC2O4-)=0,c(C2O42﹣)=c(HC2O4-)=103c(H2C2O4),所以1.22<pH<4.19的过程中,c(HC2O4-)实质逐渐增大,c(H2C2O4)逐渐减小,c(C2O42﹣)逐渐增大,则不一定满足c(C2O42﹣)>c(H2C2O4),故C错误; D.pH=4.19时,曲线Ⅱ中c(C2O42﹣)=c(HC2O4﹣),根据电荷守恒: c(Na+)+c(H+)=c(HC2O4﹣)+2c(C2O42-)+c(OH-)可得,c(Na+)+c(H+)=3c(HC2O4﹣) +c(OH-);且c(H+)>c(OH-),所以c(Na+)≠3c(HC2O4﹣) 故D错误。 解析A. Zn、Fe构成原电池,金属性:Zn>Fe,活泼的做负极,故Zn做负极,A项错误;B.H2C2O4为弱酸,离子反应中不拆,B项错误;C.植物油在NaOH溶液中发生水解反应,矿物油与NaOH溶液分层,现象不同可鉴别,C项正确;D.钠与无水乙醇反应,会产生氢气,由于钠密度大于乙醇密度,所以会沉底,但产生的氢气会使钠的浮力增大,慢慢的就会浮于水面,D项错误。 26.(1)①B ②0.1 (各1分)(2)①Cl--5e-+ 2H2O=ClO2↑+ 4H+ ②0.01 在阴极发生2H+ + 2e-=H2↑,H+浓度减小,使得H2O OH-+H+的平衡向右移动,OH-浓度增大,pH增大; (3)2ClO2+2CN-=N2↑+ 2CO2↑+2Cl- ,2.5; (4)2NaClO3+Na2C2O4===2ClO2↑+2Na2CO3 后者;后者原料易运输;副产物少;对环境污染小。 27.解析 (1)加热时烧瓶内气体压强增大,导气管可缓冲气体压强,平衡气压,以免关闭弹簧夹后圆底烧瓶内气压过大;装置B中圆底烧瓶倾斜可以防止飞溅起的液体进入冷凝管中(缓冲气流)。 (2)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏,装置B中的花椒油会随着热的水蒸气不断变为气体蒸出,当仪器甲处馏出液无油状液体,说明花椒油完全分离出来,此时停止蒸馏。蒸馏结束时,首先是打开弹簧夹,然后停止加热,最后关闭冷凝水,故操作的顺序为②①③。 (3)在馏出液中加入食盐的作用是增大水层的密度,降低花椒油在水中的溶解度,有利于分层;加入无水Na2SO4的作用是无水Na2SO4与水结合形成Na2SO4·10H2O,以便于除去花椒油中的水或对花椒油进行干燥。 (4)实验结束后,用稀NaOH溶液清洗冷凝管内壁上沾有的油脂,二者发生反应产生可溶性的高级脂肪酸钠和甘油,该反应的化学方程式为 。 (5)根据HCl+NaOH===NaCl+H2O,所以n(NaOH)(过量)=n(HCl)=0.1 mol/L×0.020 L×=0.016 mol,则与油脂反应的物质的量为0.5 mol/L×0.08 L-0.016 mol=0.024 mol,根据花椒油与NaOH反应的物质的量关系可知n(油脂)=n(NaOH)=×0.024 mol=0.008 mol,其质量为m(油脂)=0.008 mol ×884 g/mol=7.072 g,则该花椒油中含有油脂7.072 g÷0.02 L=353.6 g/L。 答案 (1)平衡气压,以免关闭弹簧夹后圆底烧瓶内气压过大 防止飞溅起的液体进入冷凝管中(缓冲气流) (2)仪器甲处馏出液无油状液体 ②①③ (3)降低花椒油在水中的溶解度,有利于分层 除去花椒油中的水或干燥 (4) (5)353.6 35.解析 (2)Fe2+的电子排布为[Ar]3d6,Mn2+的电子排布为[Ar]3d5,Mn2+的3d能级为半充满的相对稳定结构,较难失电子,故第三电离能I3(Fe)<I3(Mn)。 (3)离子晶体晶格能越大,其熔沸点越高,晶格能与离子半径成反比、与电荷成正比,二者都是离子化合物,Fe3+的半径小且电荷多,Fe2O3的晶格能更大,故其熔点高。 (5)配合物中配体提供电子对的方式包括孤对电子、π电子等,根据二茂铁的分子结构,铁与4个π电子形成4个配位键,与2个孤对电子形成2个配位键,铁的配位数为6。 (6)Fe原子位于结构单元的内部、顶点、面心,该晶胞中Fe原子个数=12×+3+2×=6,N原子个数为2,化学式为Fe3N,六棱柱底面积=a×a×sin60°×3 cm2=a2×3 cm2,晶胞体积=a2×3×c cm3,氮化铁密度===g/cm3。 答案 (1)[Ar]3d64s2(或1s22s22p63s23p63d64s2) (2)小于 Mn2+的3d能级为半充满的相对稳定结构,较难失电子 (3)Fe2O3 FeO与Fe2O3都是离子晶体,Fe3+的半径小且电荷大,Fe2O3晶格能大 (4)N (5)ACD sp2、sp3 6 (6) 36. +NaOH 羟基 OH查看更多