- 2021-04-15 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习全国非新高考地区版第六章微考点50电解原理在金属腐蚀及防护中的应用作业
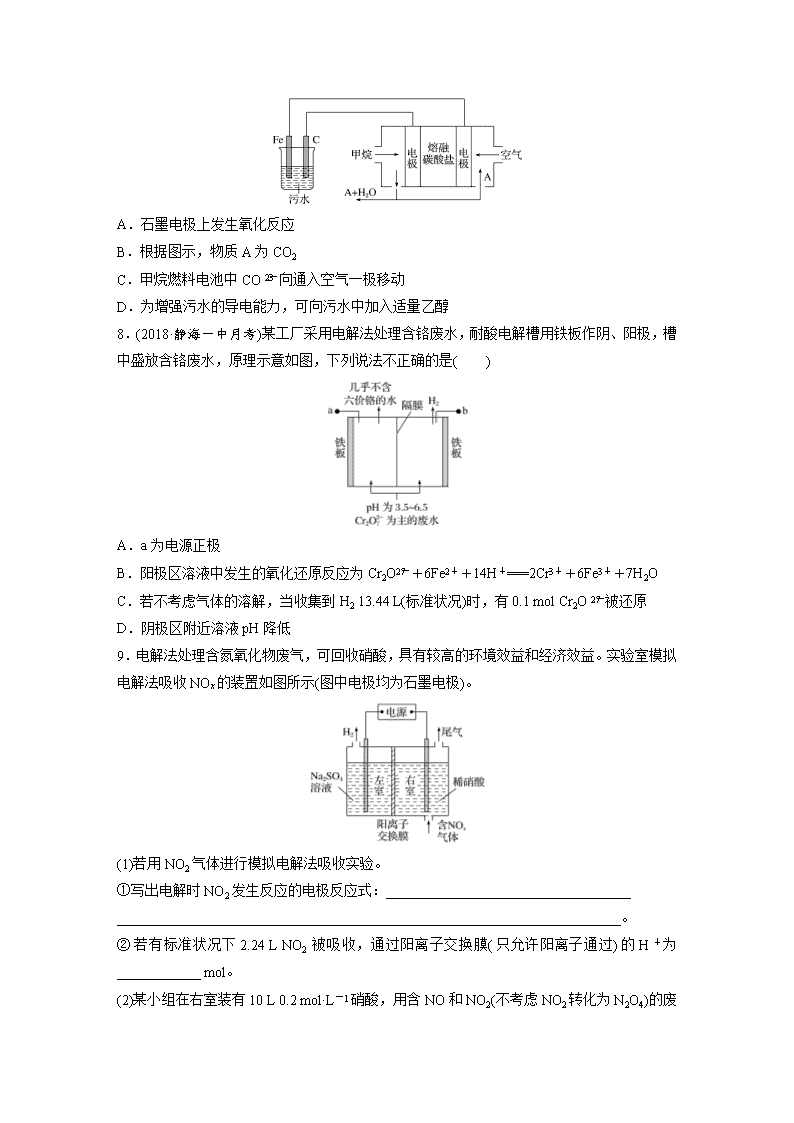
题型一 电解原理在金属腐蚀及防护中的应用 1.(2018·厦门双十中学月考)关于钢铁腐蚀与防护的说法不正确的是( ) A.钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+ B.钢铁发生吸氧腐蚀时,正极反应式为O2+2H2O+4e-===4OH- C.地下钢管连接镁块是采用牺牲阳极的阴极保护法 D.用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极 2.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是( ) A.图Ⅰ中a为纯铜 B.图Ⅰ中SO向b极移动 C.图Ⅱ中如果a、b间连接电源,则a连接负极 D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 3.(2018·邯郸一中模拟)全世界每年钢铁因锈蚀造成大量的损失。某城拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( ) A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池 B.金属棒X的材料应该是比镁活泼的金属 C.金属棒X上发生反应:M-ne-===Mn+ D.这种方法称为牺牲阳极的阴极保护法 4.(2019·河北质检)一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表所示。 pH 2 4 6 6.5 8 13.5 14 腐蚀快慢 较快 慢 较快 主要产物 Fe2+ Fe3O4 Fe2O3 FeO 下列说法正确的是( ) A.随pH的升高,含碳钢腐蚀速率逐渐加快 B.pH<4,发生析氢腐蚀 C.pH为14,其负极反应为2H2O+Fe-3e-===FeO+4H+ D.pH为7时,负极反应为Fe-3e-===Fe3+,生成的Fe3+被空气中的氧气氧化为Fe2O3 5.(2018·内蒙古部分学校月考)城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法不正确的是( ) A.该装置能够将电能转化为化学能 B.管道右端腐蚀比左端快,右端电极反应式为Fe-2e-===Fe2+ C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀 D.钢铁“阳极保护”的实质是阳极金属表面形成一层耐腐蚀的钝化膜 题型二 电解原理在废水处理中的应用 6.(2018·河南八市重点高中质检)工业上可采用惰性电极处理含Na2SO4的废水,得到其他工业产品。其原理如图所示,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中的离子被阻挡不能进入中间隔室。下列叙述不正确的是( ) A.通电后中间隔室的SO向正极区迁移,电解后正极区pH减小 B.ab为阳离子交换膜,负极区得到NaOH溶液 C.负极区反应为2H2O-4e-===O2↑+4H+,负极区溶液pH降低 D.每有1 mol O2生成,会有4 mol Na+进入负极区 7.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3胶体有吸附性,可吸附污染物而沉积下来,具有净化水的作用,其原理如图所示。下列说法正确的是( ) A.石墨电极上发生氧化反应 B.根据图示,物质A为CO2 C.甲烷燃料电池中CO向通入空气一极移动 D.为增强污水的导电能力,可向污水中加入适量乙醇 8.(2018·静海一中月考)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意如图,下列说法不正确的是( ) A.a为电源正极 B.阳极区溶液中发生的氧化还原反应为Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O C.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O被还原 D.阴极区附近溶液pH降低 9.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。 (1)若用NO2气体进行模拟电解法吸收实验。 ①写出电解时NO2发生反应的电极反应式:___________________________________ ________________________________________________________________________。 ②若有标准状况下2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为____________ mol。 (2)某小组在右室装有10 L 0.2 mol·L-1硝酸,用含NO和NO2(不考虑NO2转化为N2O4) 的废气进行模拟电解法吸收实验。 ①实验前,配制10 L 0.2 mol·L-1硝酸溶液需量取________________ mL密度为1.4 g·mL-1、质量分数为63%的浓硝酸。 ②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比(假设尾气不含氮氧化物,写出计算过程)。 10.(2018·山东省实验中学月考)氨对人类的生产生活具有重要影响。 (1)氨的制备与利用。 ①工业合成氨的化学方程式是_______________________________________________ ________________________________________________________________________。 ②氨催化氧化生成一氧化氮反应的化学方程式是________________________________ ________________________________________________________________________。 (2)氨的定量检测。 水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。 利用氨气传感器检测水体中氨氮含量的示意图如图1: ①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________________________ ②若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则水样中氨氮(以氨气计)含量为________ mg·L-1。 (3)氨的转化与去除。 微生物燃料电池(MFC)是一种现代化氨氮去除技术,图2为MFC碳氮联合同时去除的氮转化系统原理示意图。 ①A极的电极反应式为_______________________________________________________, A、B两极生成CO2和N2的物质的量之比为________。 ②用化学用语简述NH去除的原理:__________________________________________ ________________________________________________________________________。 答案精析 1.D [在电解池中,阴极本身不参与电极反应,故用外加电流的阴极保护法防止钢铁腐蚀时,钢铁应作电解池的阴极,接电源的负极,D项错误。] 2.D [由图Ⅰ可知,a为阴极,b为阳极,为粗铜的精炼,其中粗铜作阳极,纯铜作阴极,所以阴极a为纯铜,A项正确;电解时,电解质溶液中阴离子向阳极移动,所以图Ⅰ中SO向阳极(b电极)移动,B项正确;外加电流的阴极保护法中,被保护的金属连接原电池负极,所以图Ⅱ中如果a、b间连接电源,则a连接负极,C项正确;牺牲阳极的阴极保护法中,被保护的金属作原电池正极,图Ⅱ中如果a、b间用导线连接,则X应作负极,其活泼性应大于铁,D项错误。] 3.B 4.B 5.B [该装置相当于电解池,能将电能转化为化学能,A正确;左端是阳极,腐蚀得更快,B错误;如果没有外加电源,潮湿的土壤(接近中性)中的钢铁管道发生原电池反应,所以发生的是吸氧腐蚀,C正确;根据题意,此种腐蚀较慢,所以“阳极保护”实际上是在金属表面形成了一层致密的保护膜,D正确。] 6.C [电解时阴离子向阳极移动,故SO向正极区迁移,电解时阳极上OH-发生氧化反应:4OH--4e-===2H2O+O2↑,c(OH-)减小,故电解后正极区pH减小,A项正确;负极区H+放电,c(H+)减小,Na+向负极区移动,故ab为阳离子交换膜,负极区得到NaOH溶液,B项正确;负极区H+放电,发生反应:2H++2e-===H2↑,c(H+)减小,pH增大,C项错误;每有1 mol O2生成,转移4 mol电子,根据各电极上转移电子数相同,故有4 mol Na+进入负极区,D项正确。] 7.B [甲烷发生氧化反应,所在电极为电源的负极,故石墨为阴极,发生还原反应,A项错误;甲烷在负极的反应为CH4-8e-+4CO===5CO2+2H2O,A为CO2,B项正确;CO在工作过程中向负极移动,通入空气的一极为电源的正极,C项错误;乙醇为非电解质,不能增强水溶液的导电能力,D项错误。] 8.D [根据图示,a作阳极,b作阴极,电极反应式为阳极:Fe-2e-===Fe2+,阴极:2H++2e-===H2↑,然后Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,由于在阴极区c(H+)减小,pH增大。根据6H2~6Fe2+~Cr2O得,当有13.44 L(标准状况)H2放出时,应有0.1 mol Cr2O被还原。] 9.(1)①NO2+H2O-e-===NO+2H+ ②0.1 (2)①142.9 ②根据原子守恒:n(NO)+n(NO2)=3 mol-0.2 mol·L-1×10 L+0.1 mol=1.1 mol 根据得失电子守恒:0.1 mol×1+[n(NO)-0.1 mol]×3+n(NO2)×1=×2 解得,n(NO)=0.8 mol n(NO2)=0.3 mol V(NO)∶V(NO2)=n(NO)∶n(NO2)=0.8 mol∶0.3 mol=8∶3 10.(1)①N2+3H22NH3 ②4NH3+5O24NO+6H2O (2)①c(OH-)增大,使NH+OH-NH3·H2ONH3+H2O平衡正向移动,利于生成氨气,被空气吹出 ②3.4 (3)①CH3COO--8e-+2H2O===2CO2↑+7H+ 5∶2 ②NH在好氧微生物反应器中转化为NO:NH+2O2===NO+2H++H2O,NO在MFC电池正极转化为N2:2NO+12H++10e-===N2↑+6H2O 解析 (2)①在氨氮水样中存在平衡:NH+OH-NH3·H2ONH3+H2O,加入NaOH溶液,OH-浓度增大,平衡正向移动,有利于生成NH3而被空气吹出。②水样中N元素的化合价为-3价,则1 L水样中1 mol氮原子被氧化为N2转移3 mol电子,转移电子的物质的量为6×10-4 mol,被氧化的NH3的物质的量为2×10-4 mol,被氧化的NH3的质量为2×10-4 mol×17 g·mol-1=3.4 mg,水样中氨氮(以NH3计)含量为3.4 mg·L-1。(3)B极电极反应式为2NO+12H++10e-===N2↑+6H2O,A极电极反应式为CH3COO--8e-+2H2O===2CO2↑+7H+,A、B两极生成CO2和N2的物质的量之比为5∶2。查看更多