- 2021-04-15 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省沙市中学2020届高三上学期第四次双周练物理试题
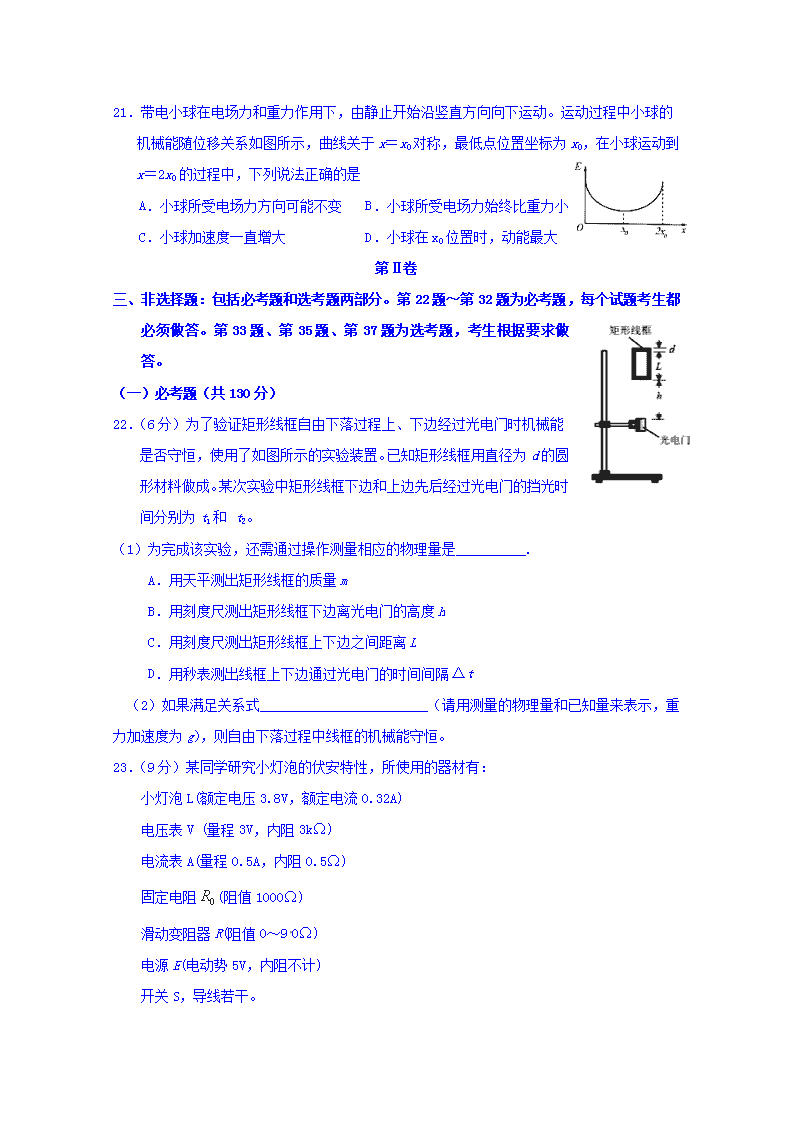
2019—2020学年上学期2017级 第四次双周练理综试卷 考试时间:2019年11月28日 本试卷分Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。 可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Fe 56 Cu 64 Sc 45 Pb 207 一、选择题(本题共13小题。在每小题给出的四个选项中,只有一项是符合题目要求的) 二、选择题:本题共8小题,每小题6分,在每小题给出的四个选项中,第14-18题只有一项符合题目要求,第19-21题有多项符合题目要求。全部选对的得6分,选对但不全的得3分,有选错的得0分。 14.下列关于物理学史和物理研究方法的叙述中正确的是 A.根据速度的定义式,当Δt取不同的值时,v都可以表示物体的瞬时速度 B.牛顿在前人的基础上总结得出并通过实验验证了牛顿运动定律 C.伽利略借助实验研究和逻辑推理得出了自由落体运动规律 D.用比值定义的物理概念在物理学中占有相当大的比例,例如加速度就是采用比值定义的 15.如图所示,长木板A与物体B叠放在水平地面上,物体与木板左端立柱间放置轻质弹簧,在水平外力F作用下,木板和物体都静止不动,弹簧处于压缩状态。将外力F缓慢减小到零,物体始终不动,在此过程中 A.弹簧弹力逐渐减小 B.物体B所受摩擦力逐渐减小 C.物体B所受摩擦力始终向左 D.木板A受到地面的摩擦力逐渐减小 16.如图所示,光滑水平面上停着一辆小车,小车的固定支架左端用不计质量的细线系一个小铁球。开始将小铁球提起到图示位置,然后无初速释放,之后不会与车上的支架碰撞。在小铁球来回摆动的过程中,下列说法中正确的是 A.小球摆到最低点时,小车的速度最大 B.小车和小球系统动量守恒 C.小球摆到右方最高点时刻,小车有向右的速度 D.小球向右摆动过程小车一直向左加速运动 17.如图所示,有一内壁光滑的高为H=5m、宽为L=1m的直立长方形容器,可视为质点的小球在上端口边缘O以水平初速度v0向左抛出正好打在E点,若球与筒壁碰撞时无能量损失,不计空气阻力,重力加速度的大小为g=10m/s2。则小球的初速度v0的大小可能是 A.2m/s B.4m/s C.6 m/s D.9 m/s 18.如图所示,A为地球赤道表面的物体,B为环绕地球运行的卫星,此卫星在距离地球表面R/2的高度处做匀速圆周运动,且向心加速度的大小为a.已知地球同步卫星的轨道半径为6.6R,R为地球的半径,引力常量为G .则下列说法正确的是 A.地球两极的重力加速度大小3a/2 B.物体A的线速度比卫星B的线速度大 C.地球的质量为 D.地球的第一宇宙速度大小为 19.如图所示,A、B、C、D为匀强电场中相邻的四个等势面,一电子经过等势面D时,动能为16 eV,速度方向垂直于等势面D飞经等势面C时,电势能为-8eV,飞至等势面B时速度恰好为零,已知相邻等势面间的距离均为4 cm,电子重力不计.则下列说法正确的是 A.电子做匀变速直线运动 B.匀强电场的电场强度大小为100 V/m C.等势面A的电势为-8 V D.电子再次飞经D等势面时的动能为16 eV 20.为了安全,在公路上行驶的汽车必须保持距离。假设高速公路上甲、乙两车在同一车道上行驶,甲车在前,乙车在后。t=0时刻,发现前方有事故,两车同时开始刹车,行进中两车恰好没有发生碰撞。两车刹车过程的v–t图象如图所示,以下判断正确的是 A.两车都停止运动时相距25 m B.t=0时刻两车间距等于50 m C.t=5 s时两车间距小于t=15 s时两车间距 D.乙车刹车的加速度大小是甲车的1.5倍 21.带电小球在电场力和重力作用下,由静止开始沿竖直方向向下运动。运动过程中小球的机械能随位移关系如图所示,曲线关于x=x0对称,最低点位置坐标为x0,在小球运动到x=2x0的过程中,下列说法正确的是 A.小球所受电场力方向可能不变 B.小球所受电场力始终比重力小 C.小球加速度一直增大 D.小球在x0位置时,动能最大 第Ⅱ卷 三、非选择题:包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须做答。第33题、第35题、第37题为选考题,考生根据要求做答。 (一)必考题(共130分) 22.(6分)为了验证矩形线框自由下落过程上、下边经过光电门时机械能是否守恒,使用了如图所示的实验装置。已知矩形线框用直径为d的圆形材料做成。某次实验中矩形线框下边和上边先后经过光电门的挡光时间分别为t1和 t2。 (1)为完成该实验,还需通过操作测量相应的物理量是__________. A.用天平测出矩形线框的质量m B.用刻度尺测出矩形线框下边离光电门的高度h C.用刻度尺测出矩形线框上下边之间距离L D.用秒表测出线框上下边通过光电门的时间间隔Δt (2)如果满足关系式________________________(请用测量的物理量和已知量来表示,重力加速度为g),则自由下落过程中线框的机械能守恒。 23.(9分)某同学研究小灯泡的伏安特性,所使用的器材有: 小灯泡L(额定电压3.8V,额定电流0.32A) 电压表V (量程3V,内阻3kΩ) 电流表A(量程0.5A,内阻0.5Ω) 固定电阻(阻值1000Ω) 滑动变阻器R(阻值0~90Ω) 电源E(电动势5V,内阻不计) 开关S,导线若干。 (1)实验要求能够实现在0~3.8V的范围内对小灯泡的电压进行测量,画出实验电路原理图。 (2)实验测得该小灯泡伏安特性曲线如图(a)所示。 由实验曲线可知,随着电流的增加小灯泡的灯丝的电阻率____(填“增大”“不变”或“减小”)。 (3)用另一电源(电动势4V,内阻1.00Ω)和题给器材连接成图(b)所示的电路,调节滑动变阻器R的阻值,可以改变小灯泡的实际功率,闭合开关S,在R的变化范围内,小灯泡的最小功率为 W。(结果均保留2位有效数字) 24.(13分)如图甲,在水平地面上固定一倾角为θ的光滑绝缘斜面,斜面处于电场强度大小为E、方向沿斜面向下的匀强电场中。一劲度系数为k的绝缘轻质弹簧的一端固定在斜面底端,整根弹簧处于自然状态。一质量为m、带电量为q(q>0)的滑块从距离弹簧上端为s0处静止释放,滑块在运动过程中电量保持不变,设滑块与弹簧接触过程没有机械能损失,弹簧始终处在弹性限度内,重力加速度大小为g。 (1)求滑块从静止释放到与弹簧上端接触瞬间所经历的时间t。 (2)求滑块在沿斜面向下运动到速度最大的整个过程中,物快和 弹簧组成的系统机械能变化量。 25.(19分)如图,质量为m=1kg的小滑块(视为质点)在半径为R=0.4m的1/4圆弧A端由静止开始释放,它运动到B点时速度为v=2m/s.当滑块经过B后立即将圆弧轨道撤去.滑块在光滑水平面上运动一段距离后,通过换向轨道由C点过渡到倾角为θ=37°、长s= 1m的斜面CD上,CD之间铺了一层匀质特殊材料,其与滑块间的动摩擦系数可在0≤μ≤1.5之间调节.斜面底部D点与光滑地面平滑相连,地面上一根轻弹簧一端固定在O点,自然状态下另一端恰好在D点.认为滑块通过C和D前后速度大小不变,最大静摩擦力等于滑动摩擦力.取g=10m/s2,sin37°=0.6,cos37°=0.8,不计空气阻力. (1)求滑块对B点的压力大小以及在AB上克服阻力所做的功; (2)若设置μ=0,求质点从C运动到D的时间; (3)若最终滑块停在D点,求μ的取值范围. 26.(14分)MnSO4晶体是一种易溶于水微红色晶体,某校同学设计实验制备并检验MnSO4的性质。回答下列问题: (1)甲组同学设计用SO2和适量纯净的MnO2制备MnSO4,其装置如下: ①A装置中固体药品X通常是______填化学式)。 ②B装置中通SO2的导管末端接多孔球泡的目的是 ;C装置用于吸收少量的SO2,发生反应的离子方程式为 。 (2)乙组同学定性检验甲组同学的产品中Mn2+的存在,取少量晶体溶于水,加入(NH4)2S2O8溶液,滴入硝酸银(作催化剂),微热振荡,溶液显紫色,发生反应的离子方程式为______ ____________________________________。 (3)丙组同学为检验无水MnSO4(接近白色)的热分解产物,将MnSO4晶体脱水后放入下图所示的装置中,打开K1和K2,缓慢通入N2,加热,硬质玻璃管中最后得到黑色固体。 ①检验分解的气态产物中是否有SO2及SO3,装置E、F中的溶液依次是____、___(填字母)。 a.Ba(NO3)2溶液 b.BaCl2溶液 c.品红溶液 d.浓硫酸 ②若D中得到的黑色粉末为Mn3O4,E、F中均有明显现象,则D中发生反应的化学方程式为_______________________________________。 (4)丁组同学设计实验以丙组同学得到的黑色粉末为原料,利用铝热反应原理将其还原为金属锰,所需的药品除氯酸钾外,还需要________________。 27.(14分)钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下: 回答下列问题: (1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是________,冷却后再慢慢注入 H2O2中,并不断搅拌。 (2)先加入氨水调节pH=3,过滤,滤渣主要成分是__________;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为_____________。(已知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31) (3)用草酸“沉钪”。25 ℃时pH=2的草酸溶液中=__________(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式_______________________________。 [已知Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5] (4)草酸钪“灼烧”氧化的化学方程式为____________________________________________。 (5)废酸中含钪量为15 mg·L-1,V L废酸最多可提取Sc2O3的质量为____________。 28.(14分)CO2是一种廉价的碳资源,综合利用CO2对构建低碳社会有重要意义。 (1)已知: H2(g)+ O2(g) === H2O(g) ΔH=-241.8kJ·mol-1 CO2(g) === CO(g)+ O2(g) ΔH=+283.0kJ·mol-1 则反应:CO2(g)+H2O(g) === CO(g)+H2(g)+O2(g) ΔH= 。 (2)工业生产中可利用H2还原CO2制备清洁能源甲醇: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0 ①保持温度、体积一定,能说明上述反应达到平衡状态的是 。 A.容器内压强不变 B.3v正 (CH3OH)= v正 (H2) C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变 ②将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率随温度的变化如题28图-1所示,催化效果最好的是催化剂 (填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是 。 题28图-1 题28图-2 (3)固体氧化物电解池(SOEC)可用于高温电解CO2/H2O,既可高效制备合成气(CO和H2),又可实现CO2的减排,其工作原理如题28图-2。 ①电源正极为 (填“a”或“b”),电极c上发生的电极反应式为 、 。 ②阴阳两极生成的气体的物质的量之比为 。 29.(10分)无土栽培是近几十年来发展起来的一种作物栽培的新技术, 作物不是栽培在土壤中,而是种植在培养液里,或在某种栽培基质中用营养液进行作物栽培。只要有一定的栽培设备和管理措施,作物就能正常生长,并获得高产。请用所学生物知识回答下列问题: (1)无土栽培的核心是用营养液代替土壤提供植物生长所需的 。 (2)实验室中研究某种元素是否为某植物生长发育所必需时,一般不使用士壤栽培植物而选样用营养液来培养植物,原因是 。 (3)某兴趣小组想改进一个培养某植物幼苗的营养液配方,找出其他成分不变时硝酸铵的最适浓度。请以该种植物幼苗为材料,设计实验探究,要求简要写出实验思路及预期实结果。 30.(10分)回答下列有关绿色植物代谢的问题: (1)绿色植物的叶片呈现绿色的原因是 。 (2)在远红光条件下补充红光照射某植物,单位时间的氧气释放量大于单独用红光或远红光照射时的氧气释放量。推测该植物体中可能存在两种色素系统,各有不同的 。 (3)在充足光照和一定温度条件下,正常生长的甲、 乙两株植物光合速率随CO2浓度变化情况如右图所示。A点限制植物乙光合速率增大的主要环境因素可能是 ;B点时,甲植物固定CO2的速率 (填“=”“>”或“<”)乙植物。现将甲、乙两植物放置在同一密闭小室中,适宜条件下光照培养,先死亡的将是 植物,原因是 。 31.(9分)某研究小组对不同温度下、密闭容器中水稻种子储存过程中每隔12 h的CO2生成速率相对值进行了相关研究,结果如下表所示。请根据所学知识回答下列问题: CO2生成速率(mL·Kg-1·h-1) 储存时间 12 h 24 h 36 h 48 h 60 h 72 h 84 h 96 h 温度 0.5 ℃ 4.8 3.6 2.7 2.5 2.3 2.1 2.0 1.9 25 ℃ 47.2 45.1 37.8 35.5 34.6 — — — (注:“—”表示未测定) (1)由上表可知,0.5 ℃条件下水稻种子的CO2生成速率较25 ℃ 条件下要低,主要原因是 ;随着储存时间的延长,CO2生成速率逐渐降低的原因是 。该实验还可通过检测 浓度变化来计算呼吸速率。 (2)某同学拟验证上述实验结果,设计如下方案:取两粒水稻种子,分别装入甲、乙两个容积相同的瓶内,然后密封;将甲、乙瓶分别置于25 ℃和0.5 ℃的条件下储存,每隔一段时间测定瓶内的CO2浓度,记录实验数据并计算CO2的生成速率。为使实验结果更可靠,请你提出两条建议,以完善上述实验方案(不考虑温度因素)。 32.(12 分)下图是果蝇的四对相对性状及其基因位置和显隐性关系,请回答下列问题: (1)果蝇正常/钝圆平衡棒的遗传符合 ,等位基因是通过 (变异)形成的。 (2)用基因型为BbDd的雄性果蝇与黑体色残翅雌性果蝇交配(正交),后代表型及比例为 ,可说明正交雄性亲本的B/d、b/D位于一条染色体上,且在形成配子时不发生交叉互换;研究人员进行了反交实验,后代表现型及比例为正常体色残翅:黑体色正常翅:正常体色正常翅:黑体色残翅= 0.42:0.42:0.08 :0.08,说明反交雌性亲本的 。以上正交和反交结果不同的现象 (填“是”或“不是”)伴性遗传,理由是 (答出 2 点)。 (3)用白眼正常平衡棒雄性与红眼钝圆平衡棒雌性杂交得到 F1,发现 F1 全为红眼且正常平衡棒:钝圆平衡棒= 1:1,说明亲本雌性的基因型为 ;用 F1 中钝圆平衡棒个体相互交配,后代中正常平衡棒:钝圆平衡棒=1:2,其原因可能是 。 (二)选考题:共44分。请考生从给出的物理题、化学题、生物题中每科任选一题做答。如果多做,则每学科按所做的第一题计分。 33.(15分) (1)(5分)下列说法正确的是( ) A. 空调机既能制热又能制冷,说明热传递不存在方向性 B. 第一类永动机不可能制成是因为它违背了能量的转化和守恒定律 C. 对于一定质量的理想气体,只要温度升高其内能就一定增大 D. 用温度计测量温度是根据热平衡的原理 E. 随着科技的发展,热机的效率定能达到100% (2)(10分)如图所示,粗细均匀的U型玻璃管在竖直平面内放置其中AB段水平,左右两管均竖直。右侧玻璃管内封闭一定质量的理想气体,气柱长度L=10cm,左侧玻璃管开口且足够长。室温为27℃时,左右两管内水银柱的高度均为h=10cm。求:右管内封闭气体为多少摄氏度时,两侧管内水银柱高度差为5cm(已知大气压强p0=75cmHg)。 35.(16分)铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下: 已知: ①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表 金属离子 Fe2+ Fe3+ Cu2+ Mn2+ 开始沉淀 7.5 2.7 5.6 8.3 完全沉淀 9.0 3.7 6.7 9.8 ②Ksp[Fe(OH)3]=4.0×10-38 (1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有_____________(任写一种)。 (2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式: ________________________________________________。 (3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为___________,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为________mol/L。 (4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_______________________________。 (5)“赶氨”时,最适宜的操作方法是______________________。 (6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(写化学式)。 (7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是______________________________________________________________________。 37.(13分)水稻(2N=24)为一年生植物,花非常小且为两性花,大部分自花授粉并结种子。 (1)在水稻种子中,淀粉等物质主要储存在 中。我国科学家通过测定水稻体细胞中 条染色体DNA上所有碱基对的序列,在世界上首次完成了水稻基因组测序工作。 (2)将普通水稻放在适宜浓度的NaNO3溶液中培养,一段时间后培养液中的NO3-浓度下降、Na+浓度增高。培养液中Na+浓度增高的原因是 。 (3)杂交水稻的产量、抗病性等许多性状都要优于普通水稻,我国大力培育、推广杂交水稻是为了获得 。水稻的雄性不育植株是隐性突变体,不能产生可育花粉,但能产生正常雌配子。利用雄性不育株培育杂交水稻的优点是 。 (4)若水稻长穗性状由两对等位基因(B/b和C/c)共同控制,两对等位基因都纯合时才表现为小穗性状。若BbCc植株自交,子一代中出现小穗性状的概率是1/2,可推测这两对基因的遗传 (填“遵循”或“不遵循”)基因的自由组合定律,理由是 。 (5)基因型为DD的水稻表现为多分蘖,Dd为二分蘖,dd为单枝无分蘖。现有一株二分蘖突变植株,其体细胞中基因(D、d)所在的一对同源染色体中有一条染色体缺失部分片断,已知含有缺失片段染色体的花粉有50%败育。若该植株自交,后代个体表现型及比例为 ,则缺失片段染色体是D所在的染色体且缺失片段中不包括D基因。 高三年级第四次双周练理综答案 物理部分:14.C 15.D 16.A 17.D 18.D 19.ACD 20.AB 21.BC 22. (1) C (2) 23. (1)电路图见解析; (2) 增大; (3)0.39 24.解析:本题考查的是电场中斜面上的弹簧类问题。涉及到匀变速直线运动、运用动能定理处理变力功问题、最大速度问题和运动过程分析。 (1)滑块从静止释放到与弹簧刚接触的过程中作初速度为零的匀加速直线运动,设加速度大小为a,则有 qE+mgsin=ma ① ② 联立①②可得 ③ (2)滑块速度最大时受力平衡,设此时弹簧压缩量为,则有 ④ 从静止释放到速度达到最大的过程中,由功能关系得 联立④⑤可得 25. 【详解】(1)滑块在B点,受到重力和支持力,在B点,根据牛顿第二定律有:F−mg=m,代入数据解得:F=20N, 由牛顿第三定律得:F′=20N. 从A到B,由动能定理得:mgR−W=mv2, 代入数据得:W=2J. (2)在CD间运动,有:mgsinθ=ma, 加速度为:a=gsinθ=10×0.6m/s2=6m/s2, 根据匀变速运动规律有:s=vt+at2 代入数据解得:t=s. (3)最终滑块停在D点有两种可能:a、滑块恰好能从C下滑到D.则有: mgsinθ•s−μ1mgcosθ•s=0−mv2, 代入数据得:μ1=1, b、滑块在斜面CD和水平地面间多次反复运动,最终静止于D点. 当滑块恰好能返回C有:−μ1mgcosθ•2s=0−mv2, 代入数据得到:μ1=0.125, 当滑块恰好能静止在斜面上,则有:mgsinθ=μ2mgcosθ, 代入数据得到:μ2=0.75. 所以,当0.125≤μ<0.75,滑块在CD和水平地面间多次反复运动,最终静止于D点. 综上所述,μ的取值范围是0.125≤μ<0.75或μ=1. 33. (1) BCD (2)若左管水银面比右管低5cm,气体温度为77摄氏度;若右管水银面比左管低5cm,气体温度为﹣33摄氏度。 【详解】以封闭气体为研究对象;初态压强P0=75cmHg,体积V0=LS,温度T0=(273+27)K=300K 若左管水银面比右管低5cm,其末态压强为:P1=(p0﹣h)cmHg=70cmHg 末态体积为:V1=(L+2.5)S=12.5S 根据理想气体状态方程得: 代入数据解得:T1=350K=77℃ 若右管水银面比左管低5cm,其末态压强为:P2=(p0+h)cmHg=80cmHg 末态体积为:V2=(L﹣2.5)S=7.5S 代入数据解得:T2=240K=﹣33℃ 化学部分:7.D 8.B 9.A 10.C 11.B 12.C 13.D 26.(14分) (1) ①Na2SO3 (2分) ②增大SO2与液体的接触面积 (2分) SO2+2OH-=SO32-+H2O (2分); (2)2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+ (2分) (3)①b (1分) c (1分) ②3MnSO4 Mn3O4+SO2↑+2SO3↑ (2分) (4)铝粉、镁条 (2分) 27.(14分)(1)将浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌,(2分) (2) Fe(OH)3 (2分)9.0×10-7mol·L-l (2分) (3) 3.8×10-2 (2分) 2Sc3++ 3H2C2O4===Sc2(C2O4)3↓+ 6H+(2分) (4)2Sc2(C2O4)3+3O22Sc2O3+12CO2(2分) (5)0.023V g(2分) 28.(14分)(1)+524.8kJ·mol-1(2分) (2)① AD (2分)②Ⅰ(1分) 该反应为放热反应,达平衡后,随温度升高,平衡逆向移动,CO2的转化率降低。(2分) (3)①b (1分) H2O+2e-=H2↑+O2- (2分) CO2+2e-=CO+O2- (2分) ②2:1(2分) 35.(16分) (1)充分搅拌,适当增加硫酸浓度,加热等符合题意的任一答案均可(2分) (2)2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O (2分) (3)3.7≤pH<5.6(2分) 4.0×10-11 (2分) (4)Mn2++HCO3-+NH3=MnCO3↓+NH4+ (2分); (5) 将溶液加热(2分) (6) (NH4)2SO4 (2分) (7) 取少量最后一次洗涤液于洁净的试管中,加入足量稀盐酸酸化,再加入BaCl2溶液,若无白色沉淀产生,则说明沉淀已洗净,反之未洗净。(其它合理答案也可)(2分) 生物部分:1~6 C A B D D B 29.(10分) (1)水和无机盐(或矿质营养或矿质元素)(答全才得分,2分) (2)土壤成分复杂,不利于控制是否含有所研究的元素(不能有效控制自变量)(1分) ;而培养液成分明确,能够控制其是否含有所研究的元素(能有效控制自变量)(1分)(1点1分,共2分) (3)实验思路:将生长状况相同的该种植物的幼苗平均分成若干组(1分),将各组幼苗分别培养在硝酸铵具有一定浓度梯度而其他成分相同的不同营养液中(1分),在相同且适宜环境中培养一段时间后(1分),观察各组幼苗的长势(生长状况)(1分)。(共4分) 预期实验结果:长势最好的幼苗所对应的硝酸铵浓度即为最适浓度(2分)。 30.(10分,除标注外每空2分) (1)叶绿素对绿光吸收最少,绿光被反射出来 (2)吸收光谱(或吸收峰值) (3)温度 <(1分) 乙(1分) 甲能利用更低浓度的二氧化碳进行光合作用 31.(9分,除标明外每空2分) (1)低温降低了与细胞呼吸有关的酶的活性 由于种子细胞进行细胞呼吸消耗O2,产生CO2,使得密闭容器内CO2浓度增加,O2浓度减少,在一定程度上抑制了种子的细胞呼吸 氧气(O2)(1分) (2)①水稻种子的生理状况应相同 ②每个温度下应有多粒且等量的水稻种子 32.(12分,除标注外每空1分) (1)基因的分离定律 基因突变 (2)正常体色残翅:黑体色正常翅=1:1(2分) B/d、b/D位于一条染色体上,且在 形成配子时发生了交叉互换(2分,1点1分) 不是 B/d和b/D均位于2 号染色体上,正交和反交各自的子代中雌雄个体的表现型及比例 没有差异(2分,1点1分) (3)EeXAXA E基因纯合致死(2分) 37.(13分,除标注外,每空2分) (1)胚乳(1分) 12(1分) (2)根细胞吸水的速率大于吸收Na+的速率 (3)杂种优势 无需进行人工去雄操作 (4)不遵循(1分) 若两对基因位于非同源染色体上,则子代出现小穗性状的概率是1/4 (5)多分蘖:二分蘖:单枝无分蘖 = 1:3:2查看更多