- 2021-04-15 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届湖北省宜昌一中高二上学期入学化学试卷 (解析版)
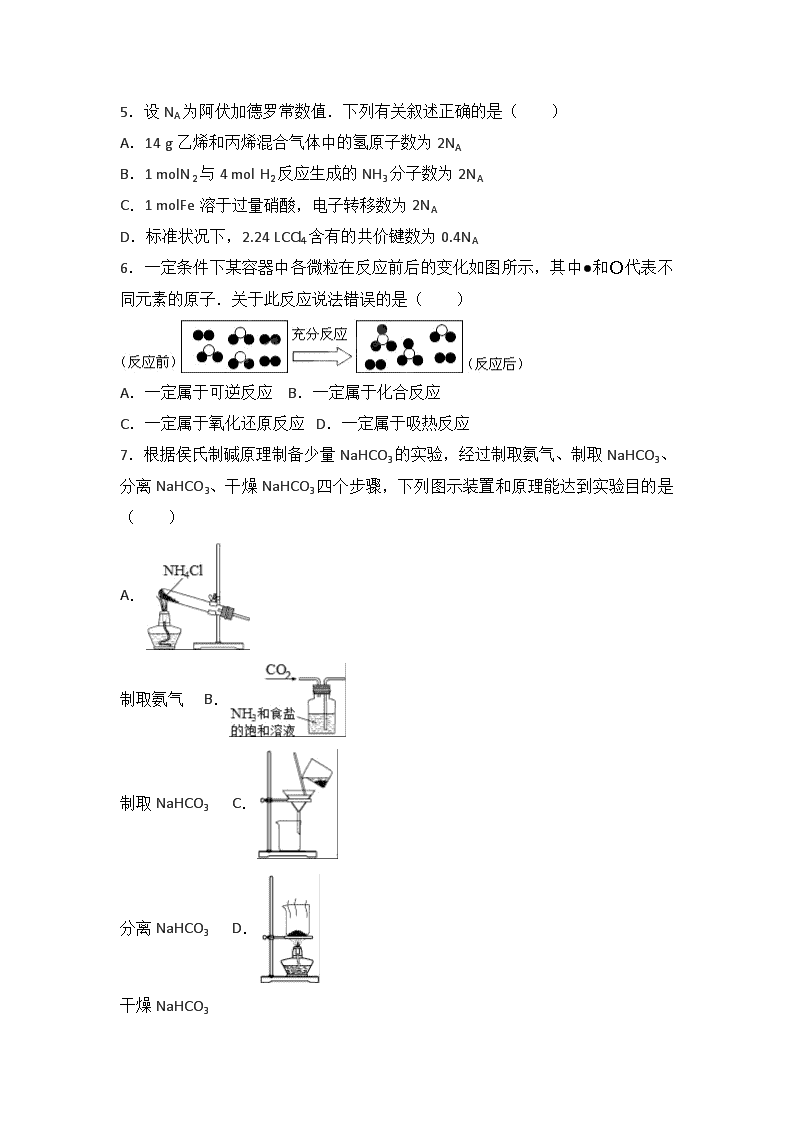
2016-2017学年湖北省宜昌一中高二(上)入学化学试卷 一、选择题:本题共16小题,每题3分,共48分.每题只有一个答案符合题意. 1.化学与生活密切相关,下列有关说法错误的是( ) A.可利用油脂水解制备甘油 B.食用油反复加热会产生芳香族化合物等有害物质 C.加热能杀死流感病毒是因为蛋白质受热变性 D.糖、油脂、蛋白质都能水解 2.下列物质分类正确的是( ) A.SO2、SiO2、CO均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体 C.烧碱、冰醋酸、四氯化碳均为电解质 D.福尔马林、水玻璃、氨水均为混合物 3.食品干燥剂应无毒、无味、无腐蚀性及环境友好.下列说法错误的是( ) A.硅胶可用作食品干燥剂 B.P2O5不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 4.下表中对应关系正确的是( ) A 由蛋白质得到氨基酸 由淀粉得到葡萄糖 均发生了水解反应 B CH3CH3+Cl2CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl 均为取代反应 C 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O═HCl+HClO 均为水作还原剂的氧化还原反应 D Cl2+2Br﹣═2Cl﹣+Br2 Zn+Cu2+═Zn2++Cu 均为单质被还原的置换反应 A.A B.B C.C D.D 5.设NA为阿伏加德罗常数值.下列有关叙述正确的是( ) A.14 g乙烯和丙烯混合气体中的氢原子数为2NA B.1 molN2与4 mol H2反应生成的NH3分子数为2NA C.1 molFe溶于过量硝酸,电子转移数为2NA D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA 6.一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和○代表不同元素的原子.关于此反应说法错误的是( ) A.一定属于可逆反应 B.一定属于化合反应 C.一定属于氧化还原反应 D.一定属于吸热反应 7.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的是( ) A. 制取氨气 B. 制取NaHCO3 C. 分离NaHCO3 D. 干燥NaHCO3 8.a、b、c、d为短周期元素,a的原子中只有1个电子,b2﹣和c+的电子层结构相同,d与b同族.下列叙述错误的是( ) A.a与其他三种元素形成的二元化合物中其化合价均为+1 B.b与其他三种元素均可形成至少两种二元化合物 C.c的原子半径是这些元素中最大的 D.d与a形成的化合物的溶液呈弱酸性 9.下列有关性质的比较,不能用元素周期律解释的是( ) A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3 10.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族.下列说法正确的是( ) A.元素X、W的简单阴离子具有相同的电子层结构 B.由Y、Z两种元素组成的化合物是离子化合物 C.W的简单气态氢化物的热稳定性比Y的强 D.原子半径:r(X)<r(Y)<r(Z)<r(W) 11.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( ) A.Zn为电池的负极 B.正极反应式为2FeO42﹣+10H++6e﹣=Fe2O3+5H2O C.该电池放电过程中电解质溶液浓度不变 D.电池工作时OH﹣向负极迁移 12.图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42﹣) 13.在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表.下列判断不正确的是( ) 0.600 0.500 0.400 0.300 318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50 a 4.50 b 2.16 1.80 1.44 1.08 A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变 C.b<318.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同 14.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列物质,能加快反应速率但又不影响氢气生成的是( ) A.KNO3 B.CH3COONa C.CuSO4 D.Na2CO3 15.分子式为C4H8Cl2的有机物共有(不含立体异构)( ) A.7种 B.8种 C.9种 D.10种 16.已知:SO32﹣+I2+H2O=SO42﹣+2I﹣+2H+.某溶液中可能含有Na+、NH4+、K+、I﹣、SO32﹣、SO42﹣,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( ) A.肯定不含I﹣ B.肯定含SO42﹣ C.肯定含有SO32﹣ D.肯定含有NH4+ 二、非选择题:本题共4小题,共52分. 17.如表为元素周期表的一部分. 碳 氮 Y 铝 X 硫 Z 请回答下列问题: (1)Z元素在周期表中的位置为 . (2)表中元素原子半径最大的非金属是(元素符号) . (3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 ; a.Y单质与H2S溶液反应,溶液变浑浊 b.在氧化还原反应中,1molY单质比1molS得电子多 c.Y和S两元素的简单氢化物受热分解,前者的分解温度高 (4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为 . (5)向氯化铝溶液中加入过量氨水,离子方程式为 . (6)将SO2通入稀硝酸中,反应的离子方程式为 . 18.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理. (1)SO2与过量NaOH溶液反应后的产物化学式 . (2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为 . (3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl﹣、OH﹣和SO42﹣.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响). ①提出合理假设. 假设1:只存在SO32﹣; 假设2:既不存在SO32﹣也不存在ClO﹣; 假设3: . ②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L﹣1H2SO4、1moL•L﹣1NaOH、0.01mol•L﹣1KMnO4、淀粉﹣KI溶液、紫色石蕊试液. 实验步骤 预期现象和结论 步骤1:取少量吸收液于试管中,滴加3moL•L﹣1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. 步骤2: 步骤3: 19.乙烯是非常重要的有机物.请回答下列问题: (1)乙烯官能团的名称是 ; (2)用化学方程式表示乙烯的两种不同类别的性质(有机物用结构简式表示) ① ; ② ; (3)如果用乙烯制作燃料电池,KOH作电解液.写出正负极反应式: 正极 ; 负极 ; (4)相比较燃烧,形成原电池的相关说法正确的是 A.形成原电池后能量利用率更高 B.电池负极有火焰而正极没有 C.电池工作时,电解液pH不变 D.两极电极材料可以相同 (5)丁烷裂解有有两种方式,并同时进行.一是裂解为乙烯和乙烷;二是裂解为甲烷和丙烯.现有1mol丁烷,加热裂解,一段时间后,测得混合气体中含丁烷0.4mol.此时混合气体平均相对分子质量为 . 20.有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L﹣1的HCl溶液,产生CO2气体的体积(标准状况)与所加入盐酸的体积之间的关系如图所示: (1)甲溶液中的溶质是 ,其物质的量之比为 . (2)乙溶液中的溶质是 ,在标准状况下吸收CO2气体的体积为 . (3)原NaOH溶液的物质的量浓度为 . 2016-2017学年湖北省宜昌一中高二(上)入学化学试卷 参考答案与试题解析 一、选择题:本题共16小题,每题3分,共48分.每题只有一个答案符合题意. 1.化学与生活密切相关,下列有关说法错误的是( ) A.可利用油脂水解制备甘油 B.食用油反复加热会产生芳香族化合物等有害物质 C.加热能杀死流感病毒是因为蛋白质受热变性 D.糖、油脂、蛋白质都能水解 【考点】物质的组成、结构和性质的关系. 【分析】A.油脂为高级脂肪酸甘油酯; B.食用油反复加热生成致癌物质; C.高温下蛋白质发生变性; D.单糖不能发生水解. 【解答】解:A.油脂为高级脂肪酸甘油酯,可水解生成甘油,故A正确; B.食用油反复加热生成芳香族化合物等致癌物质,故B正确; C.高温下蛋白质发生变性,则加热能杀死流感病毒,故C正确; D.单糖不能发生水解,而二糖、多糖、油脂、蛋白质都能水解,故D错误; 故选D. 2.下列物质分类正确的是( ) A.SO2、SiO2、CO均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体 C.烧碱、冰醋酸、四氯化碳均为电解质 D.福尔马林、水玻璃、氨水均为混合物 【考点】酸、碱、盐、氧化物的概念及其相互联系;混合物和纯净物;分散系、胶体与溶液的概念及关系;电解质与非电解质. 【分析】酸性氧化物是能与碱反应生成盐和水的氧化物, 分散质微粒直径在1nm﹣100nm形成的分散系为胶体, 电解质是水溶液中或熔融状态下能导电的化合物, 不同物质组成的为混合物. 【解答】解:A、CO和碱不能反应,属于不成盐氧化物,故A错误; B、稀豆浆属于胶体,硅酸、氯化铁溶液不是胶体,故B错误; C、四氯化碳属于非电解质,故C错误; D、福尔马林是甲醛的水溶液、水玻璃是硅酸钠的水溶液、氨水是氨气的水溶液均为混合物,故D正确; 故选D. 3.食品干燥剂应无毒、无味、无腐蚀性及环境友好.下列说法错误的是( ) A.硅胶可用作食品干燥剂 B.P2O5不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 【考点】真题集萃;常见的食品添加剂的组成、性质和作用. 【分析】A.硅胶具有吸水性,无毒; B.P2O5吸水转化为酸; C.六水合氯化钙不能吸水; D.具有吸水性的植物纤维无毒. 【解答】解:A.硅胶具有吸水性,无毒,则硅胶可用作食品干燥剂,故A正确; B.P2O5吸水转化为酸,导致食品变质,则P2O5不可用作食品干燥剂,故B正确; C.六水合氯化钙不能吸水,则不能作食品干燥剂,故C错误; D.具有吸水性的植物纤维无毒,则可用作食品干燥剂,故D正确; 故选C. 4.下表中对应关系正确的是( ) A 由蛋白质得到氨基酸 均发生了水解反应 由淀粉得到葡萄糖 B CH3CH3+Cl2CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl 均为取代反应 C 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O═HCl+HClO 均为水作还原剂的氧化还原反应 D Cl2+2Br﹣═2Cl﹣+Br2 Zn+Cu2+═Zn2++Cu 均为单质被还原的置换反应 A.A B.B C.C D.D 【考点】有机物的结构和性质;有机化学反应的综合应用. 【分析】A.蛋白质水解生成氨基酸,淀粉水解生成葡萄糖; B.CH2=CH2+HCl→CH3CH2Cl中双键转化为单键,为加成反应; C.2Na2O2+2H2O═4NaOH+O2↑、Cl2+H2O═HCl+HClO中,水不是氧化剂,也不是还原剂; D.Cl2+2Br﹣═2Cl﹣+Br2中单质被还原,Zn+Cu2+═Zn2++Cu中单质被氧化. 【解答】解:A.蛋白质水解生成氨基酸,淀粉水解生成葡萄糖,则均发生水解反应,故A正确; B.CH2=CH2+HCl→CH3CH2Cl中双键转化为单键,为加成反应,而为取代反应CH3CH3+Cl2CH3CH2Cl+HCl,故B错误; C.2Na2O2+2H2O═4NaOH+O2↑中Na2O2为氧化剂和还原剂、Cl2+H2O═HCl+HClO中Cl2为氧化剂和还原剂,水均不是氧化剂,也不是还原剂,故C错误; D.Cl2+2Br﹣═2Cl﹣+Br2中氯气得到电子被还原,Zn+Cu2+═Zn2++Cu中Zn失去电子被氧化,故D错误; 故选A. 5.设NA为阿伏加德罗常数值.下列有关叙述正确的是( ) A.14 g乙烯和丙烯混合气体中的氢原子数为2NA B.1 molN2与4 mol H2反应生成的NH3分子数为2NA C.1 molFe溶于过量硝酸,电子转移数为2NA D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA 【考点】阿伏加德罗常数. 【分析】A、乙烯和丙烯的最简式均为CH2; B、合成氨的反应为可逆反应; C、铁和过量的硝酸反应后变为+3价; D、标况下四氯化碳为液态. 【解答】解:A、乙烯和丙烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量为1mol,则含2NA个H原子,故A正确; B、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子个数小于2NA个,故B错误; C、铁和过量的硝酸反应后变为+3价,故1mol铁转移3NA个电子,故C错误; D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算器i物质的量和含有的共价键个数,故D错误. 故选A. 6.一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和○代表不同元素的原子.关于此反应说法错误的是( ) A.一定属于可逆反应 B.一定属于化合反应 C.一定属于氧化还原反应 D.一定属于吸热反应 【考点】化学基本反应类型. 【分析】A、可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物; B、有化合价变化的反应为氧化还原反应; C、化合反应:指的是由两种或两种以上的物质生成一种新物质的反应,有单质参加的化合反应一定是氧化还原反应; D、反应吸放热取决于反应物和生成物的总能量的相对大小. 【解答】解:A.反应前后存在相同的物质,说明反应物没有完全转化为生成物,故属于可逆反应,故A正确; B.2个和1个反应生成2个,故属于化合反应,故B正确; C.有单质参加的化合反应一定是氧化还原反应,故C正确; D.化合反应一般是放热反应,但也有吸热反应,即通过图示不能判断反应是吸热反应还是放热反应,故D错误, 故选D. 7.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的是( ) A. 制取氨气 B. 制取NaHCO3 C. 分离NaHCO3 D. 干燥NaHCO3 【考点】化学实验方案的评价. 【分析】A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵; B.气体通入方向错误; C.从溶液中分离碳酸氢钠固体,可用过滤的方法; D.碳酸氢钠不稳定,不能直接加热干燥. 【解答】解:A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵,制备氨气,应用氯化铵和氢氧化钙为反应物,故A错误; B.应将二氧化碳从长导管进入,否则将液体排出,故B错误; C.从溶液中分离碳酸氢钠固体,可用过滤的方法,故C正确; D.碳酸氢钠不稳定,不能直接加热干燥,可烘干,故D错误. 故选C. 8.a、b、c、d为短周期元素,a的原子中只有1个电子,b2﹣和c+的电子层结构相同,d与b同族.下列叙述错误的是( ) A.a与其他三种元素形成的二元化合物中其化合价均为+1 B.b与其他三种元素均可形成至少两种二元化合物 C.c的原子半径是这些元素中最大的 D.d与a形成的化合物的溶液呈弱酸性 【考点】原子结构与元素周期律的关系. 【分析】a、b、c、d为短周期元素,a的原子中只有1个电子,则a为H元素;b2﹣和c+的电子层结构相同,结合离子所得电荷可知b为O元素,c为Na;d与b同族,则d为S元素,结合元素化合物性质与元素周期律解答. 【解答】解:a、b、c、d为短周期元素,a的原子中只有1个电子,则a为H元素;b2﹣和c+的电子层结构相同,结合离子所得电荷可知b为O元素,c为Na;d与b同族,则d为S元素. A.H元素与Na形成化合物NaH,H元素为﹣1价,故A错误; B.O元素与H元素形成H2O、H2O2,与Na元素形成Na2O、Na2O2,与S元素形成SO2、SO3,故B正确; C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,所有元素中H原子半径最小,Na的原子半径最大,故C正确; D.d与a形成的化合物为H2S,H2S的溶液呈弱酸性,故D正确. 故选:A. 9.下列有关性质的比较,不能用元素周期律解释的是( ) A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3 【考点】元素周期律的作用;真题集萃. 【分析】A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强; B.同主族元素从上到下非金属性依次减弱; C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强; D.碳酸氢盐易分解,碳酸盐难分解. 【解答】解:A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:S>P,则酸性:H2SO4>H3PO4,能用元素周期律解释,故A不选; B.同主族元素从上到下非金属性依次减弱,则非金属性:Cl>Br,能用元素周期律解释,故B不选; C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,故C不选; D.碳酸氢盐易分解,碳酸盐难分解,所以热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,故D选. 故选D. 10.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族.下列说法正确的是( ) A.元素X、W的简单阴离子具有相同的电子层结构 B.由Y、Z两种元素组成的化合物是离子化合物 C.W的简单气态氢化物的热稳定性比Y的强 D.原子半径:r(X)<r(Y)<r(Z)<r(W) 【考点】原子结构与元素周期律的关系. 【分析】 Y是迄今发现的非金属性最强的元素,应为F,X原子的最外层有6个电子,且原子序数小于F,应为O元素,在周期表中Z位于IA族,由原子序数关系可知Z为Na元素,W与X属于同一主族,W应为S元素,结合对应物质的性质以及元素周期率知识解答该题. 【解答】解:Y是迄今发现的非金属性最强的元素,应为F,X原子的最外层有6个电子,且原子序数小于F,应为O元素,在周期表中Z位于IA族,由原子序数关系可知Z为Na元素,W与X属于同一主族,W应为S元素, A.元素X、W的简单阴离子分别为O2﹣、S2﹣,离子的电子层结构不同,故A错误; B.Y为F,Z为Na,由Y、Z两种元素组成的化合物为NaF,是离子化合物,故B正确; C.非金属性F>S,元素的非金属性越强,对应的氢化物越稳定,故C错误; D.原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,则半径r(F)<r(O)<r(S)<r(Na),故D错误. 故选B. 11.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( ) A.Zn为电池的负极 B.正极反应式为2FeO42﹣+10H++6e﹣=Fe2O3+5H2O C.该电池放电过程中电解质溶液浓度不变 D.电池工作时OH﹣向负极迁移 【考点】原电池和电解池的工作原理. 【分析】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,原电池发生工作时,Zn被氧化,为原电池的负极,K2FeO4具有氧化性,为正极,碱性条件下被还原生成Fe(OH)3,结合电极方程式以及离子的定向移动解答该题. 【解答】解:A.根据化合价升降判断,Zn化合价只能上升,故为负极材料,K2FeO4为正极材料,故A正确; B.KOH溶液为电解质溶液,则正极电极方程式为2FeO42﹣+6e﹣+8H2O=2Fe(OH)3+10OH﹣,故B错误; C.该电池放电过程中电解质溶液浓度减小,故错误; D.电池工作时阴离子OH﹣向负极迁移,故D正确. 故选AD. 12.图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO42﹣) 【考点】原电池和电解池的工作原理. 【分析】铜锌原电池中,Zn是负极,失去电子发生氧化反应,电极反应为Zn﹣2e﹣=Zn2+,Cu是正极,氢离子得电子发生还原反应,电极反应为2H++2e﹣=H2↑,据此解答. 【解答】解:铜锌原电池中,Zn是负极,失去电子发生氧化反应,电极反应为Zn﹣2e﹣=Zn2+,Cu是正极,氢离子得电子发生还原反应,电极反应为 2H++2e﹣=H2↑, A.Cu是正极,氢离子得电子发生还原反应,Cu棒的质量不变,故A错误; B.由于Zn是负极,不断发生反应Zn﹣2e﹣=Zn2+,所以溶液中c(Zn2+)增大,故B错误; C.由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,故C正确; D.SO42﹣不参加反应,其浓度不变,故D错误; 故选:C. 13.在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表.下列判断不正确的是( ) 0.600 0.500 0.400 0.300 318.2 3.60 3.00 2.40 1.80 328.2 9.00 7.50 a 4.50 b 2.16 1.80 1.44 1.08 A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变 C.b<318.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同 【考点】真题集萃;化学反应速率的影响因素. 【分析】A、由表可知温度由318.2→328.2℃,在浓度相同的情况下=0.4,由此解答; B、由表可知温度由318.2℃→b,浓度由0.3mol/L→0.5mol/L,速率相等; C、由表可知温度由328.2℃→b,在浓度相同的情况下,水解速率变小,所以温度降低; D、温度越高反应速率越快,所以蔗糖浓度减少一半所需的时间不同,温度高的所需时间短. 【解答】解:A、由表可知温度由318.2→328.2℃,在浓度相同的情况下=0.4,所以a==6,故A正确; B、由表可知温度由318.2℃→b,浓度由0.3mol/L→0.5mol/L,速率相等,都是1.80,所以v可能不变,故B正确; C、由表可知温度由328.2℃→b,在浓度相同的情况下,水解速率变小,所以温度降低,所以温度b<318.2,故C正确; D、温度越高反应速率越快,所以蔗糖浓度减少一半所需的时间不同,温度高的所需时间短,故D错误; 故选D. 14.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列物质,能加快反应速率但又不影响氢气生成的是( ) A.KNO3 B.CH3COONa C.CuSO4 D.Na2CO3 【考点】化学反应速率的影响因素. 【分析】增大反应物浓度、升高温度、增大反应物接触面积、形成原电池都加快反应速率,要使生成氢气总量不变,则稀盐酸不能和加入的物质反应生成其它气体.据此分析解答. 【解答】解:A.加入硝酸钾,酸性条件下,硝酸根离子和锌反应生成氮氧化物而不是氢气,故A不选; B.加入醋酸钠,醋酸钠和稀盐酸生成醋酸,醋酸是弱酸,电离程度较小,溶液中氢离子浓度减小,反应速率减小,故B不选; C.加入硫酸铜,锌和铜离子发生置换反应生成Cu,Zn、Cu和稀盐酸构成原电池,加快反应速率,且盐酸的物质的量不变,则生成氢气总量不变,故C选; D.加入碳酸钠,盐酸和碳酸钠反应生成二氧化碳,所以生成氢气总量减小,不符合条件,故D不选; 故选C. 15.分子式为C4H8Cl2的有机物共有(不含立体异构)( ) A.7种 B.8种 C.9种 D.10种 【考点】有机化合物的异构现象. 【分析】C4H8Cl2可以看作为C4H10中2个H原子被2个Cl原子取代,C4H10有CH3CH2CH2CH3、CH3CH(CH3)2两种,再结合定一移一法判断. 【解答】解:C4H8Cl2可以看作为C4H10中2个H原子被2个Cl原子取代,C4H10 有CH3CH2CH2CH3、CH3C(CH3)2两种, CH3CH2CH2CH3中,当两个Cl原子取代同一个C原子上的H时,有2种,当两个Cl原子取代不同C原子上的H时,有1、2,1、3,1、4,2、3四种情况,有故该情况有6种, CH3CH(CH3)2中,当两个Cl原子取代同一个C原子上的H时,有1种,当两个Cl原子取代不同C原子上的H时,有2种,故该情况有3种, 故共有9种, 故选:C. 16.已知:SO32﹣+I2+H2O=SO42﹣+2I﹣+2H+.某溶液中可能含有Na+、NH4+、K+、I﹣、SO32﹣、SO42﹣,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( ) A.肯定不含I﹣ B.肯定含SO42﹣ C.肯定含有SO32﹣ D.肯定含有NH4+ 【考点】常见离子的检验方法. 【分析】无色溶液中加入溴水仍然无色,说明溴水发生了反应,且产物无色,I﹣和SO32﹣均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32﹣;由于SO32﹣的还原性比I﹣强,故I﹣是否存在无法判断;因所有离子浓度相等,则根据电荷守恒可判断SO42﹣肯定没有,据此进行判断. 【解答】解:加入溴水仍然无色,说明溴水发生了反应,且产物无色,I﹣和SO32﹣均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32﹣,故C正确; 由于SO32﹣的还原性比I﹣强,故I﹣是否存在无法判断,故A错误; 因所有离子浓度相等,则根据电荷守恒可判断SO42﹣肯定没有,故B错误; 根据分析可知,无法判断是否含有铵根离子,故D错误; 故选C. 二、非选择题:本题共4小题,共52分. 17.如表为元素周期表的一部分. 碳 氮 Y 铝 X 硫 Z 请回答下列问题: (1)Z元素在周期表中的位置为 第三周期ⅤⅡA族 . (2)表中元素原子半径最大的非金属是(元素符号) Si . (3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 ac ; a.Y单质与H2S溶液反应,溶液变浑浊 b.在氧化还原反应中,1molY单质比1molS得电子多 c.Y和S两元素的简单氢化物受热分解,前者的分解温度高 (4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为 C3H4 . (5)向氯化铝溶液中加入过量氨水,离子方程式为 Al3++3NH3.H2O═Al(OH)3↓+3NH4+ . (6)将SO2通入稀硝酸中,反应的离子方程式为 3SO2+2H2O+2NO3﹣═3SO42﹣+2NO↑+4H+ . 【考点】位置结构性质的相互关系应用. 【分析】由元素周期表结构可知,X为Si元素,Y为O元素,Z为Cl元素, (1)Z为氯元素,其原子序数为17,含有3个电子层,最外层含有7个电子,据此判断其在周期表中的位置; (2)元素周期表中,同一周期从左向右,原子半径逐渐减小,同一主族从上到下,原子半径逐渐增大; (3)说明Y元素的非金属性比S元素的非金属性强,可以根据元素单质氧化性强弱或生成气体氢化物稳定性分析,而与得失电子数没有必然关系; (4)该烃分子中碳氢质量比为9:1,C、H的物质的量之比为3:4,根据“碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃”可知该烃的化学式,(5)氯化铝溶液中加入过量氨水,反应生成氢氧化铝和氯化铵; (6)SO2通入稀硝酸中反应生成硫酸、NO和水. 【解答】解:由元素周期表结构可知,X为Si元素,Y为O元素,Z为Cl元素, (1)Z为Cl元素,其原子序数为17,位于周期表中第三周期、ⅤⅡA族,故答案为:第三周期ⅤⅡA族; (2)同一周期从左向右,原子半径逐渐减小,同一主族从上到下,原子半径逐渐增大,则原子半径最大的为Si,故答案为:Si; (3)a.Y单质与H2S溶液反应,溶液变浑浊,说明氧气的氧化性比硫强,则说明Y元素的非金属性比S元素的非金属性强,故a正确; b.在氧化还原反应中,1molY单质比1molS得电子多,氧化性强弱与得失电子数没有必然关系,故b错误; c.元素的非金属性越强,氢化物的稳定性越强,Y和S两元素的简单氢化物受热分解,前者的分解温度高,说明Y的非金属性较强,故c正确; 故答案为:ac; (4)该烃分子中碳氢质量比为9:1,C、H的物质的量之比为: =3:4,根据“碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃”可知该烃的化学式为C3H4,Q的化学式为Mg2C3,Mg2C3与水反应生成氢氧化镁和C3H4,反应的化学方程式为:Mg2C3+4H2O=2Mg(OH)2+C3H4↑, 故答案为:C3H4; (5)氯化铝溶液中加入过量氨水,反应生成氢氧化铝和氯化铵,离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故答案为:Al3++3NH3.H2O═Al(OH)3↓+3NH4+; (6)SO2通入稀硝酸中反应生成硫酸、NO和水,离子反应为3SO2+2H2O+2NO3﹣═3SO42﹣+2NO↑+4H+,故答案为:3SO2+2H2O+2NO3﹣═3SO42﹣+2NO↑+4H+. 18.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理. (1)SO2与过量NaOH溶液反应后的产物化学式 Na2SO3 . (2)吸收尾气过程中,发生了很复杂的反应,其中Cl2只作氧化剂的氧化还原反应的离子方程式为 Cl2+SO32﹣+2OH﹣═2Cl﹣+SO42﹣+H2O . (3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl﹣、OH﹣和SO42﹣.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响). ①提出合理假设. 假设1:只存在SO32﹣; 假设2:既不存在SO32﹣也不存在ClO﹣; 假设3: 只有ClO﹣ . ②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3moL•L﹣1H2SO4、1moL•L﹣1NaOH、0.01mol•L﹣1KMnO4、淀粉﹣KI溶液、紫色石蕊试液. 实验步骤 预期现象和结论 步骤1:取少量吸收液于试管中,滴加3moL•L﹣1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. 步骤2: 步骤3: 【考点】性质实验方案的设计. 【分析】(1)氢氧化钠过量,二氧化硫和氢氧化钠反应生成亚硫酸钠和水; (2)利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理,其中Cl2只作氧化剂的氧化还原反应生成硫酸钠、氯化钠和水; (3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可假设1、溶液中可能存在只存在SO32﹣,2、既不存在SO32﹣也不存在ClO﹣,3、SO32﹣、ClO﹣都存在; ②根据所限制实验试剂和SO32﹣、ClO﹣的性质,先加入硫酸至酸性,若存在SO32﹣、ClO﹣,分别生成了H2SO3和HClO;因为HClO具有酸性和漂白性,选择紫色石蕊试液,证明有ClO﹣的存在; H2SO3具有还原性,选择具有强氧化性高锰酸钾溶液,证明SO32﹣的存在. 【解答】解:(1)SO2与过量NaOH溶液反应,因NaOH过量,故生成的是正盐,化学方程式为:SO2+2NaOH=Na2SO3+H2O; 故答案为:Na2SO3; (2)利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理,其中Cl2只作氧化剂的氧化还原反应的离子方程式为:Cl2+SO32﹣+2OH﹣═2Cl﹣+SO42﹣+H2O, 故答案为:Cl2+SO32﹣+2OH﹣═2Cl﹣+SO42﹣+H2O; (3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可提出以下假设: 假设1、溶液中可能存在只存在SO32, 假设2、既不存在SO32﹣也不存在ClO﹣, 假设3、SO32﹣和ClO﹣不能共存,所以另一种假设判断为只有ClO﹣; 故答案为:只有ClO﹣; ②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL﹣L﹣1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32﹣、ClO﹣,分别生成了H2SO3和HClO; 在A试管中滴加紫色石蕊试液,若先变红后褪色,证明有ClO﹣,否则无; 在B试管中滴加0.01mol•L﹣1KMnO4溶液,若紫红色褪去,证明有SO32﹣,否则无. 故答案为: 实验步骤 预期现象和结论 步骤2:在A试管中滴加紫色石蕊试液 若先变红后褪色,证明有ClO﹣,否则无 步骤3:在B试管中滴加0.01mol•L﹣1KMnO4溶液 若紫红色褪去,证明有SO32﹣,否则无 19.乙烯是非常重要的有机物.请回答下列问题: (1)乙烯官能团的名称是 碳碳双键 ; (2)用化学方程式表示乙烯的两种不同类别的性质(有机物用结构简式表示) ① CH2=CH2+Br2→CH2BrCH2Br ; ② CH2=CH2+3O22CO2+2H2O ; (3)如果用乙烯制作燃料电池,KOH作电解液.写出正负极反应式: 正极 O2+2H2O+4e﹣=4OH﹣ ; 负极 CH2=CH2﹣12e﹣+16OH﹣═2CO32﹣+10H2O ; (4)相比较燃烧,形成原电池的相关说法正确的是 AD A.形成原电池后能量利用率更高 B.电池负极有火焰而正极没有 C.电池工作时,电解液pH不变 D.两极电极材料可以相同 (5)丁烷裂解有有两种方式,并同时进行.一是裂解为乙烯和乙烷;二是裂解为甲烷和丙烯.现有1mol丁烷,加热裂解,一段时间后,测得混合气体中含丁烷0.4mol.此时混合气体平均相对分子质量为 36.25 . 【考点】原电池和电解池的工作原理;有机物的结构和性质. 【分析】(1)乙烯含有碳碳双键; (2)乙烯与溴水发生加成反应生成1,2﹣二溴乙烷; 乙烯燃烧生成二氧化碳和水; (3)乙烯在负极失去电子,氧气在正极得到电子; (4)燃料电池的电极材料可相同,能源利用率高; (5)发生C4H10→C2H4+C2H6、C4H10→CH4+C3H6,结合反应计算. 【解答】解:(1)乙烯官能团的名称是碳碳双键,故答案为:碳碳双键; (2)乙烯与溴水发生加成反应生成1,2﹣二溴乙烷,该反应为CH2=CH2+Br2→CH2BrCH2Br,发生氧化反应为CH2=CH2+3O22CO2+2H2O, 故答案为:CH2=CH2+Br2→CH2BrCH2Br;CH2=CH2+3O22CO2+2H2O; (3)在碱性溶液中,负极上为乙烯,失电子发生氧化反应,则负极反应为CH2=CH2﹣12e﹣+16OH﹣═2CO32﹣+10H2O,正极上为氧气,发生得电子的还原反应,正极反应为O2+2H2O+4e﹣=4OH﹣,故答案为:O2+2H2O+4e﹣=4OH﹣;CH2=CH2﹣12e﹣+16OH﹣═2CO32﹣+10H2O; (4)A.形成原电池后,燃料从外部补充,能量利用率更高,为环保高效电池,故A正确; B.电池正极、负极均没有火焰,故B错误; C.电池工作时,消耗KOH,电解液pH减小,故C错误; D.两极电极材料可以相同,如均为石墨或Pt电极,故D正确; 故答案为:AD; (5)1mol丁烷,加热裂解,一段时间后,测得混合气体中含丁烷0.4mol,则0.6mol丁烷分解,由C4H10→C2H4+C2H6、C4H10→CH4+C3H6可知,发生裂解反应后物质的量增加0.6mol,则混合气体的物质的量为1.6mol,此时混合气体平均相对分子质量为58÷1.6=36.25, 故答案为:36.25. 20.有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L﹣1的HCl溶液,产生CO2气体的体积(标准状况)与所加入盐酸的体积之间的关系如图所示: (1)甲溶液中的溶质是 NaOH、Na2CO3 ,其物质的量之比为 1:1 . (2)乙溶液中的溶质是 NaHCO3、Na2CO3 ,在标准状况下吸收CO2气体的体积为 112mL . (3)原NaOH溶液的物质的量浓度为 0.75mol/L . 【考点】离子方程式的有关计算. 【分析】当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑. (1)甲中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32﹣转化为HCO3﹣应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL﹣25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比; (2)乙中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32﹣转化为HCO3﹣应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3,从25mL~75mL消耗50mL盐酸时生成的二氧化碳,根据方程式进而计算生成二氧化碳的体积; (3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl),进而计算原氢氧化钠溶液的浓度. 【解答】解:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑. (1)甲中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32﹣转化为HCO3﹣应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL﹣25mL=25mL, 由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1; 故答案为:NaOH、Na2CO3,1:1; (2)乙中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32﹣转化为HCO3﹣应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3;从25mL~75mL消耗50mL盐酸时生成的二氧化碳,该阶段生成二氧化碳为0.05L×0.1mol/L=0.005mol,体积为0.005mol×22.4L/mol=0.112L=112mL, 故答案为:NaHCO3、Na2CO3;112mL; (3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度= =0.75mol/L, 故答案为:0.75mol/L. 2017年1月21日查看更多