- 2021-04-15 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺600分练习11化学实验基础含解析
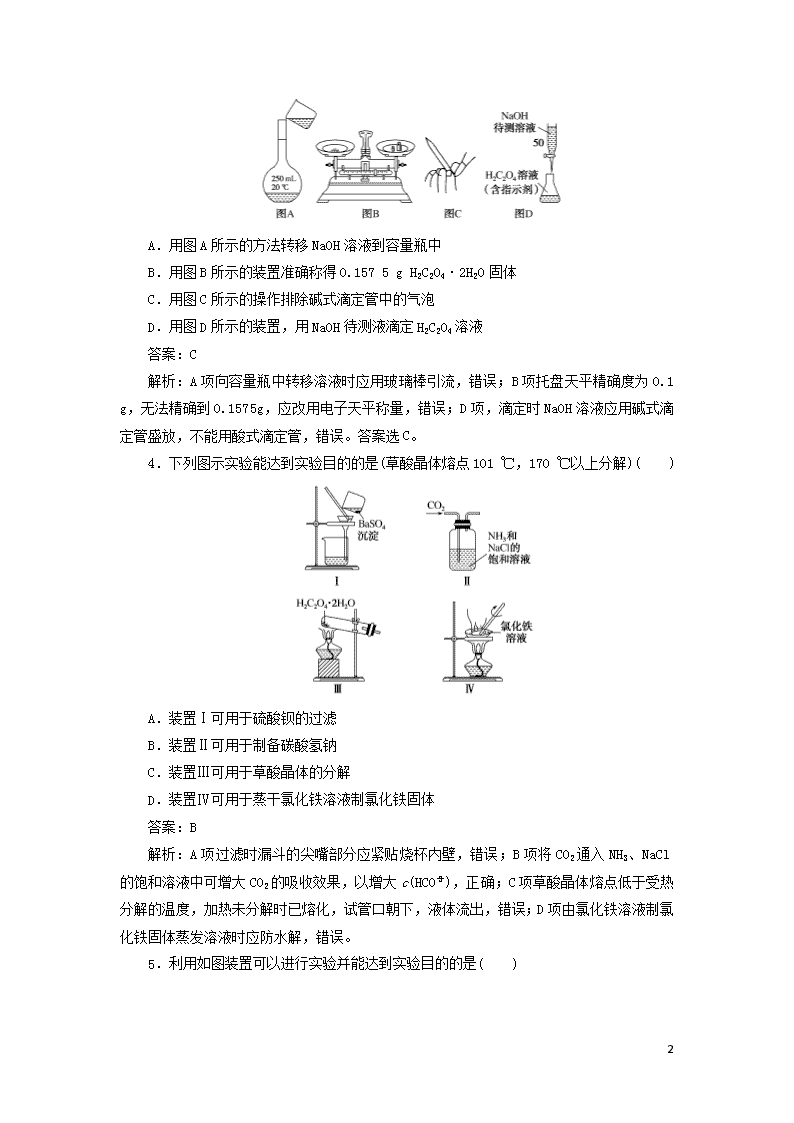
练11 化学实验基础 (A组) 1.下列相关实验操作正确的是( ) A.用量筒量取8.10 mL浓硫酸 B.配制500 mL 0.2 mol·L-1 Na2CO3溶液时,用托盘天平称取28.6 g Na2CO3·10H2O C.酸碱滴定实验中,盛装待测液的锥形瓶先用蒸馏水洗涤,后用待测液洗涤 D.由CuSO4溶液制备CuSO4·5H2O时,将溶液蒸发至剩余少量液体时,停止加热 答案:B 解析:用量筒量取液体的体积不能精确到0.01 mL,A项错误;配制500 mL 0.2 mol·L-1 Na2CO3溶液,所需Na2CO3·10H2O的质量为0.500 L×0.2 mol·L-1×286 g·mol-1=28.6 g,可以用托盘天平称取,B项正确;酸碱滴定实验中,盛装待测液的锥形瓶用蒸馏水洗涤后无需用待测液洗涤,C项错误;由CuSO4溶液制备CuSO4·5H2O,应将溶液蒸发浓缩至有晶体出现,D项错误。 2.如图所示装置,肯定不符合气密性要求的是( ) 答案:C 解析:A项用手握住试管,导管有气泡,说明气密性良好,正确;B项漏斗中液面差不变,说明气密性良好,正确;C项两侧液面水平,不能说明气密性良好,应使两侧有液面差,静置后液面差不变,说明气密性良好,错误;D项用手捂住烧瓶,导管中液面上升,说明气密性良好,正确。 3.NaOH标准溶液的配制和标定时,需经过NaOH溶液的配制、基准物质H2C2O4·2H2O称量以及用NaOH溶液滴定等操作。下列操作正确的是( ) 10 A.用图A所示的方法转移NaOH溶液到容量瓶中 B.用图B所示的装置准确称得0.157 5 g H2C2O4·2H2O固体 C.用图C所示的操作排除碱式滴定管中的气泡 D.用图D所示的装置,用NaOH待测液滴定H2C2O4溶液 答案:C 解析:A项向容量瓶中转移溶液时应用玻璃棒引流,错误;B项托盘天平精确度为0.1 g,无法精确到0.157 5 g,应改用电子天平称量,错误;D项,滴定时NaOH溶液应用碱式滴定管盛放,不能用酸式滴定管,错误。答案选C。 4.下列图示实验能达到实验目的的是(草酸晶体熔点101 ℃,170 ℃以上分解)( ) A.装置Ⅰ可用于硫酸钡的过滤 B.装置Ⅱ可用于制备碳酸氢钠 C.装置Ⅲ可用于草酸晶体的分解 D.装置Ⅳ可用于蒸干氯化铁溶液制氯化铁固体 答案:B 解析:A项过滤时漏斗的尖嘴部分应紧贴烧杯内壁,错误;B项将CO2通入NH3、NaCl的饱和溶液中可增大CO2的吸收效果,以增大c(HCO),正确;C项草酸晶体熔点低于受热分解的温度,加热未分解时已熔化,试管口朝下,液体流出,错误;D项由氯化铁溶液制氯化铁固体蒸发溶液时应防水解,错误。 5.利用如图装置可以进行实验并能达到实验目的的是( ) 10 选项 实验目的 X中试剂 Y中试剂 A 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 饱和食盐水 浓硫酸 B 用Cu与稀硝酸制取并收集纯净干燥的NO 水 浓硫酸 C 用CaO与浓氨水制取并收集纯净干燥的NH3 NaOH溶液 碱石灰 D CaCO3和稀盐酸制取并收集纯净干燥的CO2 饱和NaHCO3 溶液 浓硫酸 答案:D 解析:用MnO2和浓盐酸制取Cl2需要加热,故A错误;由于NO易被空气中的氧气氧化,所以不能使用排空气法收集NO,故B错误;碱石灰呈固态,不能使用Y装置盛放碱石灰,且NH3密度比空气小,集气瓶的导气管应“长进短出”,故C错误;CaCO3和稀盐酸制取的CO2含有HCl和水蒸气,饱和NaHCO3溶液可以除去HCl,浓硫酸可以干燥CO2,所以可以制取并收集纯净干燥的CO2,故D正确。 6.仅用下表提供的实验用品(规格、数量不限),能实现相应实验目的的是( ) 选项 实验用品(省略夹持装置) 相应实验 A 蒸发皿、玻璃棒、泥三角、三脚架 从食盐水中获得NaCl晶体 B 烧杯、玻璃棒、漏斗、滤纸 除去氢氧化铝胶体中的泥沙 C 烧杯、玻璃棒、胶头滴管、容量瓶 用胆矾配制100 mL 0.1 mol·L-1的硫酸铜溶液 D 蒸馏烧瓶、温度计、冷凝管、石棉网、牛角管、锥形瓶、酒精灯 用四氯化碳萃取溴水中的溴 答案:B 解析:A项从食盐水中获得NaCl晶体,应采取蒸发的方法,缺少酒精灯,错误;B项除去氢氧化铝胶体中的泥沙,应采取过滤的方法,题给仪器能实现过滤操作,正确;C项用胆矾配制100 mL 0.1 mol·L-1的硫酸铜溶液,缺少托盘天平,错误;D项用四氯化碳萃取溴水中的溴应为萃取分液法,主要仪器为分液漏斗、烧杯、玻璃棒等,而题给仪器为蒸馏实验所需仪器,错误。 7.下列实验操作与现象、目的或结论均正确且具有对应关系的是( ) 10 选项 实验操作与现象 目的或结论 A 过量NH3与Cl2混合有白烟生成 NH3与Cl2发生化合反应生成NH4Cl B 将C2H5OH与浓H2SO4在烧瓶中混合后加热至170 ℃,并将从瓶内逸出的物质通入酸性KMnO4溶液中 检验有无乙烯生成 C 向体积为100 mL、浓度均为0.01 mol·L-1的NaCl和Na2CrO4混合液中滴加0.01 mol·L-1 AgNO3溶液,先产生白色沉淀,后产生砖红色沉淀Ag2CrO4 相同温度下, Ksp(AgCl)< Ksp(Ag2CrO4) D 向溶液X中先滴加盐酸,无现象,再滴加BaCl2溶液,出现白色沉淀 溶液X中一定含有SO 答案:D 解析:过量NH3与Cl2混合有白烟生成是因为二者发生氧化还原反应,化学方程式为8NH3+3Cl2===6NH4Cl+N2,A错误;将C2H5OH与浓H2SO4在烧瓶中混合后加热至170 ℃,有乙烯生成,还可能有二氧化硫生成,且C2H5OH易挥发,而C2H5OH和二氧化硫均能与高锰酸钾溶液反应,B错误;因为AgCl和Ag2CrO4的组成类型不同,故先析出氯化银白色沉淀,不能说明Ksp(AgCl)小于Ksp(Ag2CrO4),C错误;向溶液X中先滴加盐酸,无现象,即可排除CO、SO、Ag+等,再滴加BaCl2溶液,出现白色沉淀,可确定溶液X中一定含有SO,D正确。 8.工业酸性废水中的Cr2O可转化为Cr3+除去,实验室用电解法模拟该过程,结果如表所示(实验开始时溶液体积为50 mL,Cr2O的起始浓度、电压、电解时间均相同)。 实验 ① ② ③ 电解条件 阴、阳极 均为石墨 阴、阳极均为石墨,滴加1 mL浓硫酸 阴极为石墨,阳极为铁,滴加1 mL浓硫酸 Cr2O的 去除率/% 0.922 12.7 57.3 下列说法不正确的是( ) A.对比实验①②可知,降低pH可以提高Cr2O的去除率 B.实验②中,Cr2O在阴极放电的电极反应式是Cr2O+6e-+14H+===2Cr3++7H2O C.实验③中,Cr2O的去除率提高的原因是Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O D.实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O被还原 10 答案:D 解析:对比实验①②可知,实验②中溶液的pH较小,Cr2O的去除率较高,所以降低pH可以提高Cr2O的去除率,A项正确;实验②中,Cr2O在阴极上得电子,发生还原反应,电极反应式为Cr2O+6e-+14H+===2Cr3++7H2O,B项正确;实验③中,Fe作阳极,失去电子生成Fe2+,Fe2+能与Cr2O发生反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,从而导致Cr2O的去除率提高,C项正确;实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O在阴极上被还原,但同时还有0.5 mol Cr2O被Fe2+还原,所以共有1.5 mol Cr2O被还原,D项错误。 (B组) 1.下列有关仪器使用方法或实验操作正确的是( ) A.做焰色反应实验时,铂丝可用玻璃棒、铁丝等代替 B.蒸发皿、坩埚、燃烧匙、烧瓶等仪器可直接加热 C.可以用酸式滴定管量取20.00 mL双氧水 D.用分液漏斗分离水和汽油时,先打开旋塞使水流出,再将汽油从下口放出 答案:C 解析:玻璃中含有硅酸钠,焰色反应呈黄色,对焰色反应的观察产生干扰,A错误;烧瓶不能直接加热,B错误;分离水和汽油时,先打开旋塞使水流出,再关闭旋塞,将汽油从分液漏斗的上口倒出,故D错误。 2.如图是某同学用含有铁锈的废铁屑制取氯化铁的装置(省略夹持装置,气密性良好)。下列说法正确的是( ) A.装置A中存在反应:2Fe3++Fe===3Fe2+ B.实验开始时,打开活塞a,盐酸快速流入装置A中 C.装置B中收集到的气体可直接点燃 D.反应后的烧杯中通入少量SO2,溶液颜色立即由棕黄色变为浅绿色 答案:A 解析:装置A中存在反应Fe+2H+===Fe2++H2↑、Fe2O3+6H+===2Fe3++3H2O、2Fe3++Fe===3Fe2+,A项正确;实验开始时,必须先打开K1 10 ,再打开活塞a,盐酸才能快速流入装置A中,B项错误;装置B中收集到的可燃性气体必须先验纯再点燃,C项错误;反应后的烧杯中含有铁离子和过量双氧水,必须通入足量的二氧化硫溶液颜色才能由棕黄色变为浅绿色,D项错误。 3.某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( ) 选项 A B C D 实验 步骤 制备NH3 制备NaHCO3 分离 NaHCO3 煅烧 NaHCO3 实验 装置 解释 或说 明 试剂X可选 择NH4Cl 从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率 该装置可用于分离 NaHCO3 无水CuSO4的作用是检验NaHCO3是否完全分解 答案:B 解析:NH4Cl加热分解不能用于制备氨气,A错误;氨的溶解度大,干燥管装置可防止倒吸,且生成HCO需通入足量CO2,故从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率,B正确;分离出NaHCO3应采用过滤的方法,C错误;无水CuSO4遇水变蓝,不能用于检验NaHCO3是否完全分解,D错误。 4.实验是科学探究的重要手段。下列实验装置或操作,现象和结论均正确的是( ) 序号 实验装置或操作 现象 结论 A 白磷先燃烧起来,红磷后燃烧 白磷的着火点比红磷低 B 长颈漏斗中出现一段稳定的水柱 装置气密性良好 C 左边试管中产生黄绿色气体,右边试管中溶液变黄色 氧化性:MnO>Cl2>Fe3+ 10 D 锥形瓶中产生大量气泡,烧杯中出现白色胶状物 非金属性:S>C>Si 答案:B 解析:选项A,白磷容易自燃,着火点低,红磷相对稳定,故应该将红磷放在更靠近火焰处,错误;选项B,关闭止水夹,向长颈漏斗中注水直到浸没导管口,长颈漏斗中出现一段稳定的水柱,说明装置气密性良好,正确;选项C,浓盐酸和高锰酸钾反应产生Cl2,左边试管中产生黄绿色气体,Cl2可以氧化Fe2+,也可以氧化Br-,最终溶液都可以呈黄色,无法判断Cl2、Fe3+的氧化性强弱,错误;选项D,比较元素非金属性强弱时,可通过比较各元素的最高价含氧酸的酸性强弱,实验中稀H2SO3应该替换成稀H2SO4,故错误。 5.已知20 ℃下Ksp[Mg(OH)2]=1.6×10-11,Ksp[Co(OH)2]=6.4×10-15,Co(OH)2为玫瑰红色难溶物,某同学进行下列实验: 实验操作 现象 实验一 将镁条用砂纸打磨光亮后置于饱和氯化钠溶液中,滴加几滴酚酞 有无色气体和较多白色沉淀产生,溶液变红色 实验二 取出镁条,将悬浊液加热 红色加深 实验三 冷却后滴加适量CoCl2溶液 部分白色难溶物变成玫瑰红色难溶物 依据上述实验操作及现象,下列说法不正确的是( ) A.镁条和水发生置换反应生成H2和Mg(OH)2 B.NaCl增大了Mg(OH)2(s)在20 ℃水中的溶解度 C.Mg(OH)2(s)Mg2+(aq)+2OH-(aq) ΔH>0 D.加入适量CoCl2溶液后,c(Mg2+):c(Co2+)=2 500:1 答案:B 解析:由实验一的现象知,镁条和水反应产生了H2和难溶物Mg(OH)2,故A正确;氯化钠对Mg(OH)2在水中的溶解度无影响,故B错误;由实验二加热悬浊液,红色更深,可知Mg(OH)2(s)在水中的溶解过程是吸热的,故C正确;在Mg(OH)2饱和溶液中滴加CoCl2溶液后,发生反应Mg(OH)2(s)+Co2+(aq)Co(OH)2(s)+Mg2+(aq),则c(Mg2+) :c(Co2+)=[c(Mg2+)·c2(OH-)]:[c(Co2+)·c2(OH-)]=Ksp[Mg(OH)2]:Ksp[Co(OH)2]=2500:1,故D正确。 6.实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如图所示,实验中Y装置产生白色沉淀。下列说法不正确的是( ) 10 A.滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2 B.Y中产生的白色沉淀是BaSO4或BaSO3 C.产生白色沉淀的原因可能是在酸性条件下SO2与NO反应生成了SO D.若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化 答案:B 解析:通入一段时间N2,是为了排除空气中O2的干扰,A项正确;由于NO在酸性条件下具有强氧化性,能将SO氧化为SO,所以Y中产生的白色沉淀是BaSO4,B项错误、C项正确;若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,且沉淀为BaSO4,说明Fe3+也能将SO2氧化,D项正确。 7.实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( ) A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性 B.实验结束后可向装置A的溶液中滴加KSCN溶液检验是否有Fe2+ C.装置D中品红溶液褪色可以验证SO2的漂白性 D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸 答案:B 解析:该实验探究铁与浓硫酸在加热条件下的反应,并验证SO2的性质,A装置即为铁与浓硫酸的反应装置,产生SO2;B、C、D装置分别是验证SO2的性质,E装置为尾气处理装置。装置B中酸性KMnO4溶液逐渐褪色,说明SO2被氧化,即体现了二氧化硫的还原性,故A项正确;KSCN溶液是用来检验是否有Fe3+,故B项错误;品红溶液用来检验物质的漂白性,故装置D中品红溶液褪色可以验证SO2的漂白性,C项正确;实验时将导管a插入浓硫酸中,可以使A中试管内压强与外界压强相等,即可防止装置B中的溶液倒吸,D项正确。 8.一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知: 10 Br2 CCl4 正十二烷 密度/(g·cm-3) 3.119 1.595 0.753 沸点/℃ 58.76 76.8 215~217 下列说法正确的是( ) A.用甲装置过滤时,需不断搅拌 B.丙装置中用正十二烷而不用CCl4,是因为其密度小 C.用乙装置将Br-氧化为Br2 D.可用装置丁进行蒸馏,先收集正十二烷再收集Br2 答案:C 解析:过滤时不需搅拌,A项错误;丙装置中用正十二烷而不用CCl4,是因为其沸点与溴相差大,萃取后的溶液可通过蒸馏而分离,B项错误;用乙装置利用氯气将Br-氧化为Br2,C项正确;可用装置丁进行蒸馏,先收集Br2再收集正十二烷,D项错误。 9.依据反应2KIO3+5SO2+4H2O===I2+3H2SO4+2KHSO4(KIO3过量),利用下列装置从反应后的溶液中制取碘的CCl4溶液并回收KHSO4。下列说法不正确的是( ) A.用①制取SO2 B.用②还原IO 10 C.用③从水溶液中提取KHSO4 D.用④制取I2的CCl4溶液 答案:C 解析:蒸发溶液应选蒸发皿,③中为坩埚,错误。 10.探究浓硫酸和铜的反应,下列装置或操作正确的是( ) A.用装置甲进行铜和浓硫酸的反应 B.用装置乙收集二氧化硫并吸收尾气 C.用装置丙稀释反应后的混合液 D.用装置丁测定余酸的浓度 答案:C 解析:浓硫酸和Cu在常温下不反应,需在加热条件下反应,A项错误;SO2的密度比空气大,收集时应长管进短管出,B项错误;反应后得到CuSO4和浓硫酸的混合液,稀释时应将其沿烧杯壁缓慢加入水中,并用玻璃棒不断搅拌,C项正确;利用滴定法测定余酸的浓度时,应用碱式滴定管盛装NaOH溶液,而图示用的是酸式滴定管,D项错误。 11.在生成、纯化溴苯并证明取代反应的实验过程中,下列操作未涉及的是( ) 答案:C 解析:分离反应后的混合物涉及到过滤,分液,蒸馏操作,未涉及蒸发。 10查看更多