河南省鹤壁市淇县第一中学2018-2019学年高二上学期第一次月考化学试题(重点班) Word版含答案
高二重点班第一次月考化学试题
一、单选题(每题3分,共60分)
1.下列说法不正确的是( )
A. pH<7的溶液不一定呈酸性
B. 在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等
C. 在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-)
D.用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏高
2.常温下,在20.0mL0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图。已知0.10mol•L-1氨水的电离度为1.32%,下列叙述错误的是( )
A. 该滴定过程应该选择甲基橙作为指示剂 B.M点对应的盐酸体积小于20.0mL
C. M点处的溶液中c(H+)=c(OH-) D.N点处的溶液中pH>12
3.已知下列热化学方程式:
(1)CH4(g) + 2O2(g)== CO2(g) + 2H2O(l) △H= - 890.0kJ/mol
(2)2C2H6(g) + 7O2(g )==4CO2 (g)+ 6H2O(l) △H= - 3119.6kJ/mol
(3) C2H4(g) + 3O2(g) == 2CO2(g) + 2H2O(l) △H= - 1411.0kJ/mol
(4) 2C2H2(g) + 5O2(g)== 4CO2(g) + 2H2O(l) △H= - 2599.2kJ/mol
(5)C3H8(g) + 5O2(g)== 3CO2(g) + 4H2O(l) △H= - 2219.9kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出2970.8kJ热量,则下列哪些组合是不可能的 ( )
A.CH4和C3H8 B.C2H4和C3H8 C.C2H6和C3H8 D.C2H6和CH4
4.常温下,pH=13的强碱溶液与pH=2的强酸溶液混和,所得混和溶液的pH=11,则强酸与强碱的体积比是( )
A. 9:1 B. 11:1 C. 1:11 D. 1:9
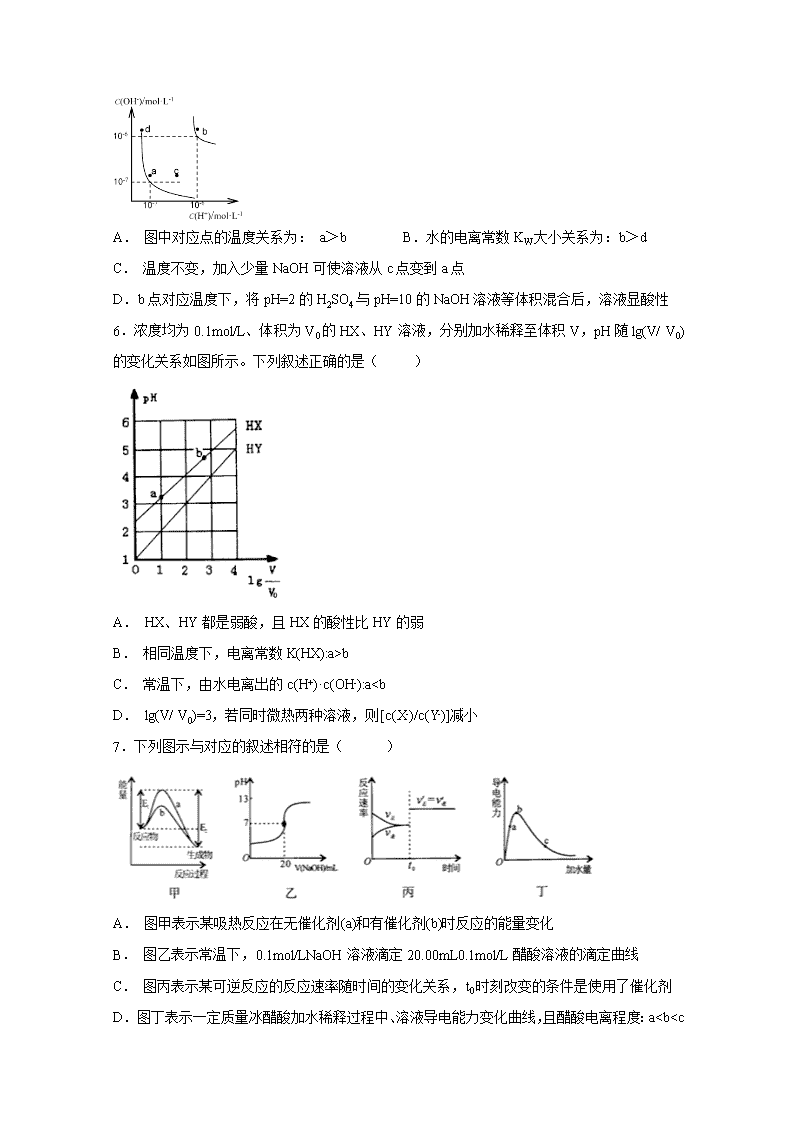
5.水的电离平衡曲线如下图所示。下列说法正确的是( )
A. 图中对应点的温度关系为: a>b B.水的电离常数KW大小关系为:b>d
C. 温度不变,加入少量NaOH可使溶液从c点变到a点
D.b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
6.浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )
A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a
B
B. A、B反应温度相同,但容积不同,且容积:A>B
C. a,b,c三点对应的平均相对分子质量:b>c>a
D. t2-t3时间段内,A、B两容器中平均反应速率相等
14.向两个体积可变的密闭容器中均充入1mol 的A2 和2mol的B2发生反应:A2(g)+2B2(g)2AB2(g) △H。维持两个容器的压强分别为p1和p2,在不同温度下达到平衡,测得平衡时AB2 的体积分数随温度的变化如图所示。
已知: 图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上;IV点不在曲线上
下列叙述正确的是( )
A. Ⅰ点和Ⅱ点反应速率相等 B. IV点时反应未到达平衡v(正)②>③
C. 其它条件不变的情况下,加入无水氯化钙CO2的转化率降低
D. 若起始CO2浓度为2mol·L一1、H2为4mol.L一1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.69
17.有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲:a(g)+b(g) 2c(g) ΔH1<0、乙: x(g)+3y(g) 2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y 的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c 的物质的量不变
18.汽车尾气净化器中发生的反应为2NO(g)+2CO(g)N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器
温度/(℃)
起始物质的量(mol)
平衡物质的量(mol)
NO
CO
N2
CO2
N2
CO2
I
400
0.2
0.2
0
0
0.12
II
400
0.4
0.4
0
0
III
300
0
0
0.1
0.2
0.075
下列说法正确是( )
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 mol•L-1·s-1
B. 该反应的ΔS<0、ΔH>0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
19.一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是 ( )
容器编号
温度/K
物质的起始浓度/mol/L
物质的平衡浓度/mol/L
c(CH3OH)
c(CO)
c(CH3COOH)
c(CH3COOH)
I
530
0.50
0.50
0
0.40
II
530
0.20
0.20
0.40
III
510
0
0
0.50
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中比容器I中的小
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH 转化率与容器III中CH3COOH 转化率之和小于1
20.在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是( )
A. 该反应的ΔH<0 B. T1时,该反应的平衡常数为1/16
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大 b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度 d.图中压强p17,选项B错误;C、反应前后气体的体积相等的反应,如:3A (g)⇌2C(g)+B(g),增大压强或减小压强,平衡不移动,所以图示可能为增大压强,催化剂能改变反应速率,也可能为使用了催化剂,选项C错误;D、醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大,所以醋酸电离程度大小顺序是c>b>a,选项D正确。答案选D。
8.C
【解析】A.pH=3的HNO3和pH=11的KOH,c(H+)=c(OH-)=10-3
mol/L,等体积混合恰好反应生成硝酸钾,溶液为中性,A错误;
B.pH=3的盐酸和pH=11的氨水,c(H+)=10-3mol/L,氨水浓度大于10-3mol/L,等体积混合时碱过量,溶液pH大于7,B错误;
C.pH=3的醋酸,醋酸的浓度大于10-3mol/L,pH=11的Ba(OH)2溶液中c(OH-)=10-3mol/L,等体积时酸过量,pH一定小于7,C正确;
D.pH=3的硫酸和pH=11的NaOH,c(H+)=c(OH-)=10-3mol/L,等体积混合恰好反应生成硫酸钠,溶液为中性,D错误;
10.D
【解析】甲不变,乙蒸发掉一半水,在丙中通入少量的CO2,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后溶液中的溶质均为NaCl,等体积等物质的量浓度的NaOH溶液中n(NaOH)相同,由原子守恒可知:n(NaOH)~n(H+)~n(NaCl),所以三者消耗盐酸的物质的量相同,由于盐酸的浓度相同,根据V=可知消耗盐酸的体积相同,即V甲=V乙=V丙,答案选A。
11.D
【解析】A.醋酸是弱酸,部分电离,pH=3的醋酸溶液比pH=11的NaOH溶液浓度大的多,a点时二者等体积反应,醋酸过量,溶液呈酸性,故A错误;
B.平衡常数K只与温度有关,和压强无关,所以B选项是错误的;
C.增大氢气的浓度,提高氮气的转化率,所以随H2起始体积分数增大,N2的转化率增大,即a点N2的转化率小于b点,所以C选项是错误的;
D.降低体系温度,正逆反应速率都减小,平衡向正反应方向移动,与图象相符,故D正确。
所以D选项是正确的。
12.D
【解析】A. 由图可知,温度较低时,肼和氧气主要发生的反应N2H4+O2 = N2+2H2O,A正确;B. 由图可知,在400℃到900℃之间,N2的产率逐渐减小、 NO 的产率逐渐升高,所以,900℃时,能发生 N2+O2 = 2NO,B正确;C. 由图可知,当温度高于900℃后,N2的产率与 NO 的产率都降低了,说明两个反应都是可逆反应,所以900℃时, N2的产率与 NO 的产率之和可能小于1,C正确;D. 该探究方案是将一定量的肼和氧气、在密闭容器中、在不同温度下达到平衡的实验,反应达到平衡需要一定的时间,所以不能不断升高温度,D不正确。本题选D。
13.A
【解析】A. 向A、B两个恒容密闭容器中分别加入等量的X,根据图像,A容器建立平衡需要的时间短,反应速率快,若A、B容积相同,反应温度不同,则温度:A>B,故A正确;B. 向A、B两个恒容密闭容器中分别加入等量的X,根据图像,A容器建立平衡需要的时间短,反应速率快,若A、B反应温度相同,但容积不同,则容积:A<B,故B错误;C. 向A、B两个恒容密闭容器中分别加入等量的X,发生X的分解反应,该反应为气体体积增大的反应,a,b,c三点分解的X的物质的量b>c>a,则气体的总物质的量b>c>a,气体的质量不变,对应的平均相对分子质量:b<c<a,故C错误;D. 根据图像,A容器建立平衡需要的时间短,反应速率快,t2-t3时间段内,A、B两容器中平均反应速率A>B,故D错误;故选A。
14.B
【解析】A2(g)+2B2(g)2AB2(g)正反应气体物质的量减小,根据图示,相同温度下,压强为p1时,达到平衡AB2的体积分数大于p2,所以p1>p2, Ⅱ点比Ⅰ点温度高、压强大,所以反应速率Ⅱ点大于Ⅰ点,故A错误;IV点对应的温度下,达到平衡AB2的体积分数减小,反应逆向进行,所以IV点时反应未到达平衡v(正)②>③,B正确;C. 其它条件不变的情况下,加入无水氯化钙可以吸收水,使化学平衡向正反应方向移动,所以CO2的转化率升高,C不正确;D. 若起始CO2浓度为2mol·L一1、H2为4mol.L一1,在图中曲线③氢碳比条件下进行,则400K时CO2的转化率为50%,则CO2的变化量为1 mol·L一1,H2的变化量为3mol.L一1,C2H5OH的变化量为0.5mol.L一1,H2O的变化量为1.5mol.L一1,该反应的平衡常数数值=1.69,D正确。本题选C。
17.D 【解析】A、恒温下向乙中通入z气体,平衡逆向进行,乙的气体增多,压强增大使甲压缩,甲的体积减小但平衡不移动,则c的物质的量浓度增大,选项A正确;B、恒温下向甲中通入惰性气体,甲中平衡不移动,乙中平衡因压缩而正向移动,故x、y的转化率增大,选项B正确;C、绝热下向乙中通入z气体,平衡逆向进行,逆向是放热反应,反应器中温度升高,选项C正确;D、绝热下向甲中通入惰性气体,乙中反应应正向移动,吸热,中间隔板是导热的,导致甲中反应也会移动,c的物质的量会改变,选项D错误。答案选D。
18.D【解析】分析:由表格中数据,400℃时I中,
2NO(g)+2CO(g) N2(g)+2CO2(g)
开始物质的量(mol) 0.2 0.2 0 0
转化物质的量(mol) 0.12 0.12 0.06 0.12
平衡物质的量(mol) 0.08 0.08 0.06 0.12
K==21.09, 以此解答。
详解: A. 容器I中达到平衡所需时间2s,则v(N2)==0.03 mol•L-1·s-1,故A错误;
B.该反应为气体体积减小的反应,则ΔS<0,I与III比较,III极限转化为反应物时,起始量相同,温度低时N2的平衡浓度大,可以知道降低温度平衡正向移动,正反应为放热反应,即ΔH<0,
C.I与II比较,温度相同、起始量为2倍关系,但II中压强大、平衡正向移动,则达到平衡时,体系中c(CO)关系: c(CO,容器II)<2c(CO,容器I),故C错误;
D.起始时向I中充入NO、CO、N2、CO2各0.1mol,QC==10V逆,所以D选项是正确的。
19.D 【解析】A.根据CH3OH(g)+CO(g) CH3
COOH(g) 可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,容器I中平衡时浓度之和为0.4+0.1+0.1=0.6 mol/L,因此达平衡时,容器II中平衡时浓度之和小于0.6 mol/L×1.2=0. 72 mol/L,容器I与容器II中的总压强之比大于0.6:0.72=5:6>3:4,故A错误;B.根据CH3OH(g)+CO(g) CH3COOH(g) 可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,则增大;C.根据CH3OH(g)+CO(g) CH3COOH(g) 可知,容器I中起始量与容器Ⅲ等效,但容器Ⅲ中的温度低,温度越低,反应速率越慢,因此达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故C错误;D. 根据CH3OH(g)+CO(g) CH3COOH(g) 可知,容器I中起始量与容器Ⅲ等效;该反应为放热反应,降低温度,平衡正向移动,CH3COOH的转化率减小,因此达平衡时,容器I中CH3OH 转化率与容器III中CH3COOH 转化率之和小于1,故D正确;
20.A
【解析】A. 根据图像,升高温度,c( NO2)减小,说明平衡逆向移动,因此正反应为放热反应,ΔH<0,故A正确;B. T1时,平衡是c( NO2)=0.2 mol/L,
SO2(g)+2NO(g)2NO2(g)+S(s)
起始(mol/L) 0.5 0.6 0 0
反应(mol/L) 0.1 0.2 0.2
平衡(mol/L) 0.4 0.4 0.2
该反应的平衡常数K==,故B错误;C. T1时,容器I平衡时气体的物质的量为0.4+0.4+0.2=1.0mol,容器Ⅱ中Qc==0.5<,说明反应正向移动,气体的物质的量小于0.5+1+0.5=2.0mol,因此达到平衡,总压强之比大于1:2,故C错误;D.根据上述分析,T1时,平衡时容器I中NO的体积分数为×100%=40%;容器I相当于起始时加入0.2mol二氧化氮和0.6mol二氧化氮,容器Ⅲ相当于起始时加入0.4mol二氧化硫和1.2mol一氧化氮,容器Ⅲ相当于容器I缩小体积的结果,根据方程式,增大压强,平衡正向移动,一氧化氮的物质的量减少,因此平衡时容器Ⅲ中NO的体积分数小于40%,若T2
查看更多