- 2021-04-15 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
包头专版2020中考化学复习方案主题三身边的化学物质专项07中和反应的实验探究课件
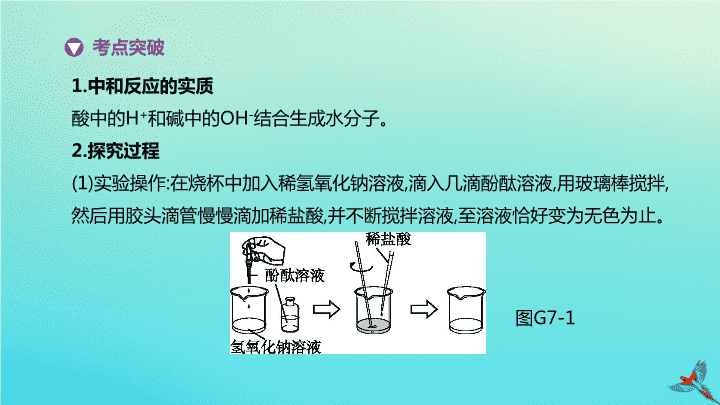
专项 (七) 中和反应的实验探究 主题三 身边的化学物质 1. 中和反应的实质 酸中的 H + 和碱中的 OH - 结合生成水分子。 2. 探究过程 (1) 实验操作 : 在烧杯中加入稀氢氧化钠溶液 , 滴入几滴酚酞溶液 , 用玻璃棒搅拌 , 然后用胶头滴管慢慢滴加稀盐酸 , 并不断搅拌溶液 , 至溶液恰好变为无色为止。 考点突破 图 G7-1 (2) 实验现象 : 溶液由 色变为 色。 (3) 实验分析 : 氢氧化钠能使酚酞溶液 , 盐酸不能使酚酞溶液变红色 , 滴加稀盐酸的过程中溶液颜色变浅 , 最后变为无色 , 说明氢氧化钠被滴入的稀盐酸中和了。 (4) 实验结论 : 氢氧化钠能与盐酸反应。反应的化学方程式为 。 红 无 变化 3. 中和反应后溶液中溶质成分的判断及检验 ( 以 NaOH 和 HCl 的反应为例 , 所加指示剂 : 酚酞溶液 ) NaCl HCl 、 NaCl 碳酸盐 NaOH 、 NaCl 1. 在老师的指导下对“酸和碱能否发生反应”进行了探究。 提出问题 酸与碱是否发生反应 ? 猜想假设 Ⅰ. 没有发生反应 ;Ⅱ. 发生了反应。 进行实验 方案一 : 甲组同学设计了如图 G7-3 所示的方案进行实验 , 滴加足量稀盐酸后 , 观察到 。 结论 : 猜想 Ⅱ 正确 , 反应的化学方程式为 。 典题训练 图 G7-3 溶液由红色变为无色 方案二 : 乙组同学设计了如图 G7-4 所示的方案进行实验 , 分别测出各溶液的 pH 。 结论 : 猜想 Ⅱ 正确。 质疑提高 小林同学认为 ( 填“甲组”或“乙组” ) 方案不合理 , 理由是 。 乙组 稀盐酸中有水 , 稀释后碱性溶液的 pH 也会减小 图 G7-4 实验延伸 实验后同学们将两组反应后的废液倒入同一洁净的烧杯中 , 发现溶液呈无色。同学们对这一现象产生浓厚的兴趣 , 又对烧杯中无色溶液的酸碱性展开了讨论。经过讨论 , 同学们一致认为溶液不可能呈 性 , 理由是 。 为此实验验证 : 实验操作 实验现象 实验结论 取少量无色 溶液加入 溶液呈酸性 拓展提升 老师要求同学们回收废液中的氯化钠 , 操作是 ( 指示剂忽略不计 ) 。 碱 碱性溶液能使无色酚酞变红 紫色石蕊溶液 紫色石蕊溶液变红 蒸发结晶 2. 某化学课堂围绕“酸碱中和反应” , 将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。 演示实验 将一定量稀盐酸加入到盛有氢氧化钙溶液的小烧杯中。该反应的化学方程式是 。 查阅资料 CaCl 2 溶液显中性。 提出问题 实验中未观察到明显现象 , 部分同学产生了疑问 : 反应后溶液中溶质的成分是什么 ? 猜想与假设 针对疑问 , 甲组同学猜想如下 : 猜想 Ⅰ: 只有 CaCl 2 ; 猜想 Ⅱ: 有 ; 猜想 Ⅲ: 有 CaCl 2 和 Ca(OH) 2 ; 猜想 Ⅳ: 有 CaCl 2 、 HCl 和 Ca(OH) 2 。 乙组同学对以上猜想提出质疑 , 认为猜想 Ⅳ 不合理 , 其理由是 。 [ 答案 ] CaCl 2 和 HCl HCl 和 Ca(OH) 2 不能共存 [ 解析 ] 当稀盐酸与氢氧化钙溶液恰好完全反应时 , 反应后溶液中的溶质只有 CaCl 2 ; 当其中一种反应物有剩余时 , 溶质可能为 CaCl 2 和 HCl 或 CaCl 2 和 Ca(OH) 2 ; 不可能为 CaCl 2 、 HCl 和 Ca(OH) 2 , 因为 HCl 和 Ca(OH) 2 不能共存。 实验探究 为了验证其余猜想 , 各小组按下列三个方案进行了探究。 实验方案 滴加 紫色石蕊 溶液 通入 CO 2 滴加 Na 2 CO 3 溶液 实验 操作 实验 现象 产生白色沉淀 实验 结论 溶液中含有 Ca(OH) 2 溶液中含有 Ca(OH) 2 溶液中含有 Ca(OH) 2 [ 答案 ] 石蕊溶液变蓝 溶液变浑浊 [ 解析 ] 溶液中含有 Ca(OH) 2 , 故显碱性 , 石蕊溶液遇碱变蓝 ; 二氧化碳能与 Ca(OH) 2 反应生成白色沉淀。 得出结论 通过探究 , 大家确定猜想 Ⅲ 是正确的。 评价反思 (1) 丙组同学认为加 Na 2 CO 3 溶液产生白色沉淀 , 不能证明溶液中一定含有 Ca(OH) 2 , 请你帮助他们说明原因 : ___________________________________ 。 (2) 在分析反应后所得溶液中溶质的成分时 , 除了考虑生成物外 , 还需要考虑 。 沉淀 , 不能证明一定含有 Ca(OH) 2 反应物是否过量 CaCl 2 与 Na 2 CO 3 反应也会生成白色 3. 小明在做“盐酸中和氢氧化钠”的实验时 , 实验前忘记向氢氧化钠溶液中滴加酚酞溶液 , 导致无法判断中和反应进行的程度 , 于是小明对反应后溶液的酸碱性进行了探究。 探究目的 确定反应后溶液的酸碱性。 猜想与假设 反应后溶液可能呈碱性 , 可能呈 , 也可能呈 。 [ 答案 ] 中性 ( 或酸性 ) 酸性 ( 或中性 ) [ 解析 ] 盐酸和氢氧化钠溶液进行中和实验时 , 若两种物质恰好完全反应 , 酸碱完全中和 , 反应后溶液呈中性 ; 若加入的盐酸量不足 , 则溶液中的氢氧化钠不能全部反应掉 , 溶液依然呈碱性 ; 若加入了过量的盐酸 , 盐酸有剩余 , 溶液呈酸性。 实验验证 实验操作 实验现象 实验结论 无色酚酞溶液 溶液呈碱性 , 使其呈碱性的微粒是 无色酚酞溶液不变色 溶液呈 [ 答案 ] 变红 OH - 中性或酸性 [ 解析 ] 因为结论是溶液呈碱性 , 则滴入的酚酞溶液应变红 ; 碱中含有 OH - , 其能使酚酞溶液变成红色 , 无色酚酞不变色 , 只能说明溶液不是碱性溶液 , 对于是酸性还是中性溶液无法判断。 继续验证 实验操作 实验现象 实验结论 粉末部分或全部消失 , 溶液变为黄色 溶液呈 , 反应的化学方程式是 溶液呈 [ 答案 ] 酸性 Fe 2 O 3 +6HCl 2FeCl 3 +3H 2 O 无明显现象 中性 [ 解析 ] 向乙中加入氧化铁粉末 , 观察到粉末部分或全部消失 , 溶液变为黄色 , 说明溶液呈酸性 , 氧化铁与盐酸反应生成氯化铁和水 , 其化学方程式为 Fe 2 O 3 +6HCl 2FeCl 3 +3H 2 O; 如果观察到无明显现象 , 说明氧化铁没反应 , 则溶液不呈酸性 , 证明溶液呈中性。 4. [2019 · 雅安 ] 某化学兴趣小组用实验室常用药品 ( 或溶液 ) 对“ NaOH 溶液与稀盐酸是否恰好完全反应”进行探究。 知识卡片 氯化钠溶液显中性 ; 氯化铜易溶于水。 实验探究 (1) 方案 Ⅰ: 某同学先向试管中加入约 2 mL NaOH 溶液 , 再滴入几滴酚酞溶液 , 溶液变红。然后慢慢滴入稀盐酸 , 边滴边振荡 , 直至溶液恰好变为无色。 ① 实验结论 : 。 ② 从微观的角度分析 , 该反应的实质是 。 ③ 在滴入稀盐酸的过程中 , 若观察到有少量气泡出现 , 请分析产生气泡的可能原因 ( 用化学方程式表示 ) 。 (2) 方案 Ⅱ: 实验步骤 实验现象 结论 取 2 mL NaOH 溶液于试管中 , 滴入一定量的稀盐酸 , 振荡后加入镁条 若 稀盐酸过量 若没有明显现象 NaOH 溶液与稀盐酸恰好完全反应 实验反思 (3) 另有同学提出方案 Ⅱ 不能证明 NaOH 溶液与稀盐酸恰好完全反应 , 其原因是 。 (4) 除以上方案外 , 下列哪些物质单独使用 , 也能证明“ NaOH 溶液与稀盐酸是否恰好完全反应” ( 填序号 ) 。 A. 铜片 B.pH 试纸 C. 氧化铜 D. 紫色石蕊溶液 [ 答案 ] (2) 有气泡产生 (3) 稀盐酸量不足的情况下 , 也无明显现象 (4)BD [ 解析 ] (2) 当稀盐酸过量时 , 加入镁条能与之反应生成氢气 , 则会看到有气泡产生。 (3) 当稀盐酸的量不足时 , 加入镁条也没有明显的实验现象 , 所以该方案不能证明 NaOH 溶液与稀盐酸恰好完全反应。 (4) 铜片与 NaOH 溶液和稀盐酸均不反应 , 无法说明 NaOH 溶液或稀盐酸有剩余 ;pH 试纸、紫色石蕊溶液遇 NaOH 溶液和稀盐酸会呈现不同颜色 , 可检验反应后溶液的酸碱性 , 可以判断两者是否恰好完全反应 ; 氧化铜能与稀盐酸发生反应 , 若 NaOH 溶液与稀盐酸恰好完全反应 , 则加入氧化铜无明显现象 , 但当稀盐酸的量不足时 , 加入氧化铜也无明显现象 , 故无法判断。查看更多