- 2021-04-14 发布 |
- 37.5 KB |
- 37页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学常用计量学案(全国通用)(2)
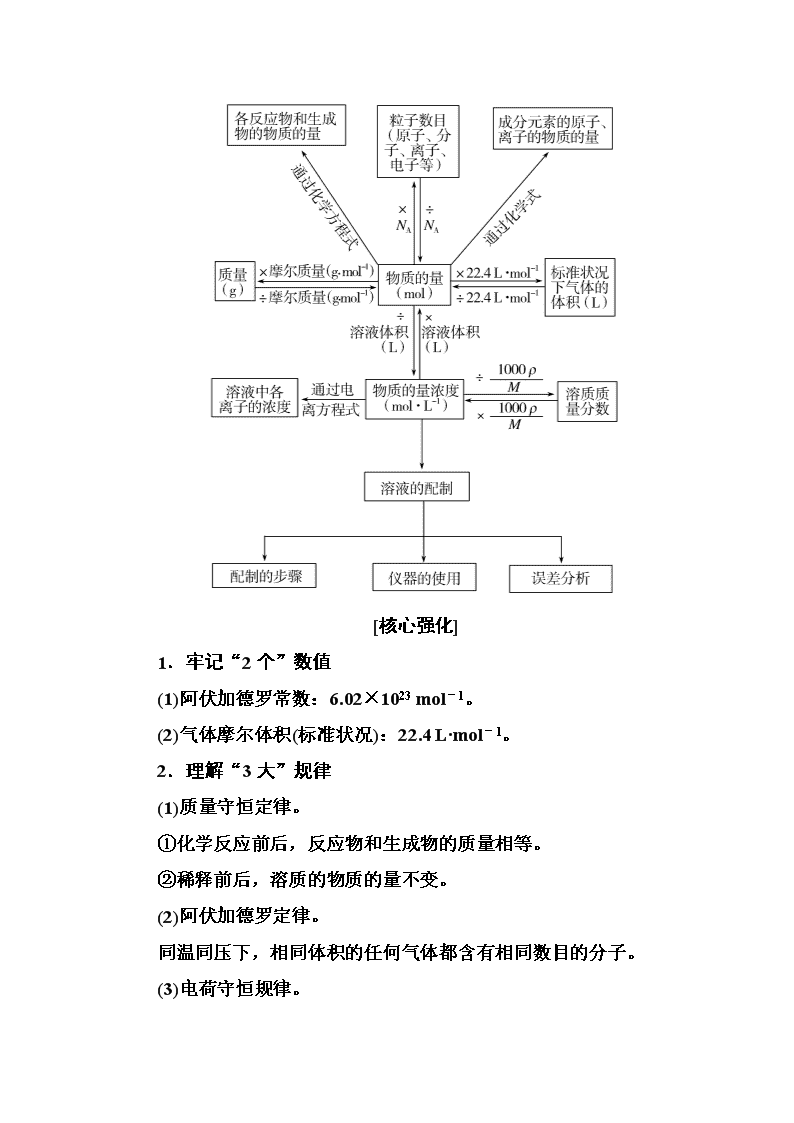
化学常用计量 [考纲要求]1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。2.根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)、物质的量浓度之间的相互关系进行有关计算。 [学科素养]1.宏观辨识与微观探析:能从元素和原子、分子水平认识物质的组成和构成微粒。2.平衡思想:能认识物质是变化的,并遵循质量守恒定律。3.证据推理:能基于证据对物质组成及其变化明确物质的量浓度的含义,掌握一定物质的量浓度溶液的配制及相关仪器的使用,掌握与阿伏加德罗常数相结合的有关计算和判断。 [网络构建] [核心强化] 1.牢记“2个”数值 (1)阿伏加德罗常数:6.02×1023 mol-1。 (2)气体摩尔体积(标准状况):22.4 L·mol-1。 2.理解“3大”规律 (1)质量守恒定律。 ①化学反应前后,反应物和生成物的质量相等。 ②稀释前后,溶质的物质的量不变。 (2)阿伏加德罗定律。 同温同压下,相同体积的任何气体都含有相同数目的分子。 (3)电荷守恒规律。 溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数。 3.牢记“6个”基本公式 (1)n=N/NA (2)n=m/M (3)n=V/Vm (4)c(B)=n/V (5)ω=×100% (6)c=(或ω=) 4.明确溶液配制过程中的“4个数据” (1)记录质量或体积的数据小数点后保留一位数字。 (2)选择合适规格的容量瓶,作答时要标明容量瓶规格。 (3)转移溶液时要洗涤烧杯2~3次。 (4)定容时液面距刻度线1~2 cm处,改用胶头滴管滴加。 考点一 阿伏加德罗常数的应用 [解析] 氯化铁的摩尔质量为162.5 g·mol-1,16.25 g FeCl3的物质的量为0.1 mol,铁离子水解生成的氢氧化铁胶体粒子是大量氢氧化铁微粒的聚集体,故氢氧化铁胶体粒子数小于0.1NA,A错误;标准状况下,22.4 L氩气(氩气分子为单原子分子)的物质的量为1 mol,Ar是18号元素,1 mol氩气分子含有18 mol质子,即质子数为18NA,B正确;甘油的摩尔质量为92 g·mol-1,92.0 g甘油的物质的量为1 mol,甘油(丙三醇)的结构简式为CHCH2—OHCH2—OHOH,1个丙三醇分子中含有3个羟基,故92.0 g甘油中含有羟基数为3.0NA,C错误;甲烷与氯气在光照下反应生成的有机产物有一氯甲烷(CH3Cl)、二氯甲烷、三氯甲烷和四氯化碳,故1.0 mol CH4与氯气在光照下反应生成的CH3Cl分子数小于1.0NA,D错误。 [答案] B 解答阿伏加德罗常数类题目的“3看” [分点突破] 角度:有关NA的正误判断 1.(2018·河北高阳中学月考)阿伏加德罗常数的值为NA,下列叙述中错误的是( ) ①标准状况下,2.24 L水中含有0.1NA个水分子 ②常温常压下,32 g SO2含有的分子数约为3.01×1023 ③2 mol NaOH的摩尔质量为80 g/mol ④H2的气体摩尔体积约为22.4 L/mol ⑤标准状况下,22.4 L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2 mol ⑥2 mol/L的CaCl2溶液中Cl-的数目为4NA ⑦常温常压下,1 mol氦气含有的原子数为NA ⑧11.2 L氯气中含有NA个氯原子 A.①③④⑥⑧ B.①④⑤⑥⑧ C.①②④⑥⑧ D.②③④⑤⑦ [解析] ① 中标准状况下,水不是气体,不能使用标准状况下的气体摩尔体积计算2.24 L水的物质的量,错误;②中常温常压下,32 g SO2的物质的量为0.5 mol,含有的分子数约为3.01×1023,正确;③中2 mol NaOH的摩尔质量为40 g/mol,摩尔质量与物质的量无关,错误;④中没有说明在标准状况下,H2的气体摩尔体积不一定为22.4 L/mol,错误;⑤中在标准状况下,22.4 L由N2和N2O组成的混合气体的物质的量为1 mol,1 mol混合气体中含有2 mol氮原子,正确;⑥中没有说明2 mol/L的CaCl2溶液的体积,无法计算溶液中氯离子的物质的量,错误;⑦中常温常压下,1 mol氦气含有1 mol氦原子,含有的原子数为NA,正确;⑧中没有说明在标准状况下,题中条件无法计算11.2 L氯气的物质的量,错误。 [答案] A 2.(2018·山东桓台二中月考)设NA为阿伏加德罗常数的数值,则下列说法中正确的是( ) A.500 mL 1 mol/L MgCl2溶液中含有Cl-数目为0.5NA B.标准状况下,22.4 L H2O所含分子数为1 mol C.17 g NH3含有的电子数为10NA D.36 g H2O与32 g CH4所含的氢原子数相等 [解析] A项,Cl-数目为0.5 L×1 mol/L×2×NA=NA,错误;B项,标准状况下,H2O为液态,错误;C项,17 g NH3为1 mol,含有的电子数为1×(7+3)×NA=10NA,正确;D项,36 g H2O为2 mol,含有的氢原子为4 mol, 32 g CH4为2 mol,含有的氢原子为8 mol,错误。 [答案] C 3.(2018·福建厦门期末)阿伏加德罗常数的值为NA,下列说法正确的是( ) A.用惰性电极电解KOH溶液,若阳极产生5.6 L气体,则电路中通过0.5NA电子 B.常温常压下,4.6 g NO2气体所含的分子数为0.1NA C.7.8 g Na2O2与足量的水(HO)反应生成的氧气所含的中子数为NA D.100 g 46%甲酸(HCOOH)水溶液所含的氧原子数为5NA [解析] A项,没有给出温度和压强,错误;B项,二氧化氮气体中存在着二氧化氮与四氧化二氮的可逆反应,错误;C项,7.8 g Na2O2与水反应生成0.05 mol氧气,生成的氧气中不含18O,因此生成的氧气所含中子的物质的量为0.8 mol,错误;D项,46 g甲酸的物质的量为1 mol,含有2 mol氧原子,54 g水的物质的量为3 mol,含有3 mol氧原子,因此溶液中所含氧原子的物质的量为5 mol,正确。 [答案] D 4.(2018·河北邢台质检)设NA为阿伏加德罗常数的数值。下列说法正确的是( ) A.5.6 g Fe与过量稀硝酸反应,转移的电子数为0.3NA B.标准状况下,2.24 L苯含C—H键的数目为0.6NA C.K37ClO3与浓H35Cl反应制得7.1 g氯气,则生成的Cl2分子数为0.1NA D.6.4 g Cu与40 mL 10 mol·L-1浓硝酸充分反应,生成的NO2分子数为0.2NA [解析] A项,铁与稀硝酸反应变为+3价,故5.6 g铁即0.1 mol铁反应时失去0.3 mol电子,正确;B项,标准状况下,苯不是气体,题中条件无法计算苯的物质的量,错误;C项,K37ClO3与浓H35Cl 反应生成的7.1 g氯气,物质的量不为0.1 mol,分子数不为0.1NA,错误;D项,40 mL 10 mol·L-1浓硝酸中含有硝酸的物质的量为0.4 mol,6.4 g铜的物质的量为0.1 mol,0.1 mol铜完全反应消耗浓硝酸的物质的量为0.4 mol,而浓硝酸随着反应的进行,逐渐变为稀硝酸,故硝酸的还原产物不仅有NO2,还有部分NO,错误。 [答案] A 5.设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.1 mol NaCl中,所有Na+的最外层电子总数为NA B.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L-1 C.电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA D.向0.2 mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗NA个OH- [解析] NaCl中Na+的最外层有8个电子,因此1 mol NaCl中,所有Na+的最外层电子总数为8NA,A错误;所得溶液中含NA个Na+,可得氢氧化钠的物质的量为1 mol,但这时候溶液不是1 L,所以物质的量浓度不是1 mol·L-1,B错误;阳极反应式为2Cl--2e-===Cl2↑,没有指明标准状况,无法计算电子数目,C错误;向0.2 mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗1 mol OH-,D正确。 [答案] D 阿伏加德罗常数常见考查的知识方向与速判技能 考点二 溶液的配制及误差分析 [解析] (1)配制Na2S2O3溶液还需要的玻璃仪器是用于量取一定体积蒸馏水的量筒;加热可以除去溶解的氧气,避免实验结果不准确。 (2)用容量瓶配制溶液时,不能将所称量固体直接放入容量瓶中溶解。 [答案] (1)量筒 氧气 (2)错误 溶液配制是一个重要的定量分析实验,在解答此种题型时,首先要关注配制过程中的注意事项: (1)计算所得数据所含的有效数字必须与量器的精确度一致,中学一般用托盘天平和量筒,所以必须保留到小数点后一位。 (2)溶解过程中若有较大温度变化,转移前必须冷却到室温。 (3)洗涤时需要洗涤烧杯和玻璃棒,洗涤所得洗涤液必须转移到容量瓶中。 (4)选取容量瓶时必须注明与所配溶液相对应的规格。 (5)定容时必须平视,定容的操作是“先用小烧杯直接加水至离刻度线1~2 cm处,然后改用胶头滴管滴加至刻度线”。 (6)判断配制终点的方法是“凹液面的最低点与视线水平相切”或“凹液面的最低点、刻度线和眼睛在同一水平线上”。 其次要进行科学的误差分析: (1)误差分析的思维流程 (2)视线引起误差的分析方法 ①仰视刻度线(图1),导致溶液体积偏大,结果偏低。 ②俯视刻度线(图2),导致溶液体积偏小,结果偏高。 [分点突破] 角度一:溶液的配制 1.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是( ) A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液 B.配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸 C.配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量5.85 g NaCl固体 D.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁 [解析] 量筒只能精确到0.1 mL,B错误。托盘天平只能精确到0.1 g,C错误。用胶头滴管定容时,滴管不能紧贴容量瓶内壁,以防蒸馏水附着在容量瓶刻度线以上的部分,引起误差,故D错误。 [答案] A 2.实验室要配制480 mL 0.2 mol·L-1 NaCl溶液,实验室只有含少量硫酸钠的氯化钠固体,设计如下方案,请回答下列问题: (1)固体A的化学式为____________。 (2)试剂2的名称为________,判断试剂2是否过量的方法_______________________________________________________, 操作3的名称________________。 (3)加入试剂1、3发生反应的离子方程式分别为__________、______________________________________________________。 (4)配制过程中不需要使用的化学仪器有________(填选项的字母)。 A.烧杯 B.500 mL容量瓶 C.漏斗 D.胶头滴管 (5)用托盘天平称取氯化钠,其质量为________g。 (6)下列主要操作步骤的正确顺序是________(填序号)。 ①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解; ②加水至液面离容量瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切; ③待冷却至室温后,将溶液转移到500 mL容量瓶中; ④盖好瓶塞,反复上下颠倒,摇匀; ⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。 (7)如果实验过程中缺少步骤⑤,会使配制出的NaCl溶液浓度________(填“偏高”、“偏低”或“不变”)。 [答案] (1)BaSO4、BaCO3 (2)碳酸钠 取上层清液滴加BaCl2溶液,无白色沉淀产生则未过量,反之过量 蒸发结晶 (3)Ba2++SO===BaSO4↓ 2H++CO===H2O+CO2↑ (4)C (5)5.9 (6)①③⑤②④ (7)偏低 角度二:误差分析 3.(1)用质量分数为98%的浓硫酸(密度为1.84 g·cm-3)配制250 mL浓度为0.5 mol·L-1的硫酸溶液,选用到的仪器正确的是( ) (2)在容量瓶的使用方法中,下列操作中不正确的是________,造成浓度偏大的为________。(填写标号) A.使用容量瓶前检查它是否漏水 B.容量瓶用蒸馏水洗净后,再用待配溶液润洗 C.配制溶液时用量筒量取浓硫酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平 D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次 [解析] (1)需要量取的浓硫酸体积V=≈6.8 mL,故不能选用100 mL量筒,应选用10 mL量简,A项错误;配制体积为250 mL的溶液只能选取250 mL规格的容量瓶,B项正确;该实验不需称量固体药品,C项错误;配制溶液用不到锥形瓶,D项错误。 (2)容量瓶用蒸馏水洗净后,不能再用待配溶液润洗,这样会使所配溶液的浓度偏大;用量筒量取的浓硫酸,应先在烧杯中稀释,冷却后再转移到容量瓶中,在容量瓶中稀释是错误的,会造成溶液温度高,所加水量小,浓度偏大。 [答案] (1)B (2)BC BC 考点三 以物质的量为核心的计算 [解析] 注意混合液分成两等份,由Mg2++2OH-===Mg(OH)2↓、Ba2++SO===BaSO4↓可知原溶液中n(Mg2+)=mol=a mol、n (SO)=2b mol,依据电荷守恒可知原溶液中n(K+)=2n(SO)-2n(Mg2+)=2(2b-a)mol。 [答案] D 以物质的量为核心进行计算的“一、二、三” [分点突破] 角度一:有关气体的计算 1.(2018·上海静安区二模)同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的( ) A.质量 B.密度 C.碳原子数 D.原子总数 [解析] 根据阿伏加德罗定律,同温同压下,两个容积相等的贮气瓶中气体的物质的量相等,一个装有C2H4,另一个装有C2H2和 C2H6的混合气体,两瓶气体中分子总数相等,每个分子含有的碳原子数相等,因此碳原子总数相等,故选C。由于不能确定第二个贮气瓶中C2H2和C2H6的比例,则无法确定氢原子数和原子总数,因此原子总数不一定相等,质量不一定相等,密度不一定相等。 [答案] C 2.(2018·承德二模)如图所示装置,室温下密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左移,恢复原温度后,活塞右移并停留于容器的中央,则原来H2、O2的体积比最接近于( ) ①2∶7 ②5∶4 ③4∶5 ④7∶2 A.①② B.③④ C.②④ D.①③ [解析] 反应前左右压强相等,气体的物质的量之比等于体积之比,设空气的物质的量为1 mol,则开始时氢气、氧气的混合气体为3 mol。反应后恢复至原来的温度,活塞正好停留在容器的中央,说明反应后左右气体的物质的量相等,则右室中剩余气体为1 mol。 若剩余的气体为氢气,参加反应的气体共2 mol,由2H2+O22H2O可知,氧气为2 mol×= mol,故氢气为3 mol- mol= mol,故H2、O2的体积比为 mol∶ mol=7∶2。 若剩余的气体为氧气,参加反应的气体共2 mol,由2H2+O2 2H2O可知,氢气为2 mol×= mol,故氧气为3 mol- mol= mol,故H2、O2的体积比为 mol∶ mol=4∶5,所以原来H2、O2的体积比最接近的为③④。 [答案] B 解答有关气体体积的计算题,常根据公式n=V/22.4 L·mol-1(标准状况)或阿伏加德罗定律及其推论,把气体体积关系转化为物质的量的关系进行计算。灵活运用阿伏加德罗定律及其推论是解答该类题目的关键。 角度二:有关浓度的计算 3.标准状况下,将42.3 L HCl完全溶解于蒸馏水中,得到1.0 L溶液。下列叙述正确的是( ) A.得到的盐酸的物质的量浓度为≈1.89 mol/L B.得到的盐酸的密度为≈1.07 g/cm3 C.得到的盐酸的质量分数为 ×100%≈6.4% D.缺少数据,不能计算出盐酸的物质的量浓度、密度及质量分数 [解析] 根据标准状况下的气体体积及所得溶液体积可计算其物质的量浓度,A项正确、D项错误;1.0 L溶液中所含溶剂的体积小于1 L,即水的质量小于1000 g,B、C项错误。 [答案] A 4.V L Fe2(SO4)3的溶液中含有a g SO,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( ) A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1 [解析] a g SO的物质的量为 mol,因此V L Fe2(SO4)3溶液中Fe3+的物质的量为× mol= mol,从中取出0.5V L后n(Fe3+)= mol×= mol,即稀释到2V L后溶液中Fe3+的物质的量浓度为= mol·L-1。 [答案] A 角度三:化学反应中的计算问题 5.已知硫酸铝铵晶体的化学式可表示为Al2(NH4)2(SO4)4·24H2O,其受热易分解,400 ℃时硫酸铝铵能够稳定存在。取4.53 g硫酸铝铵晶体,加热过程中所得固体质量与温度的变化关系如图所示。根据图中数据的变化,推断下列说法中不正确的是( ) A.硫酸铝铵晶体在50 ℃下不易分解 B.硫酸铝铵晶体加热到400 ℃时会分解生成Al2(NH4)2(SO4)4 C.物质C的化学式为Al2(SO4)3 D.物质D的化学式为Al2O3 [解析] 根据图示可知,约100 ℃时硫酸铝铵晶体开始分解,所以在50 ℃下硫酸铝铵晶体可以稳定存在,A项说法正确。4.53 g硫酸铝铵晶体的物质的量n[Al2(NH4)2(SO4)4·24H2O]=4.53 g÷906 g·mol-1=0.005 mol,该晶体中含有结晶水的物质的量为0.005 mol×24=0.12 mol;受热分解过程中,固体中一定含有铝元素,根据信息,400 ℃时硫酸铝铵未分解,所以A转化为B的过程中,固体质量的减少量是结晶水的质量,减少的结晶水的物质的量为(4.53 g-2.46 g)÷18 g·mol-1=0.115 mol;固体中剩余结晶水的物质的量为0.12 mol-0.115 mol=0.005 mol,所以物质B的化学式为Al2(NH4)2(SO4)4·H2O,B项说法错误。根据Al元素质量守恒,可以推出物质C为Al2(SO4)3,物质D为Al2O3,C、D项正确。 [答案] B 6.葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下: (已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI) 按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g·L-1。 [解析] 根据滴定反应的化学方程式:SO2+I2+2H2O===H2SO4+2HI,可计算葡萄酒中抗氧化剂的残留量,即SO2的含量为 =0.16 g·L-1。 [答案] 0.16 考向一 有关阿伏加德罗常数的多角度判断 1.(2018·全国卷Ⅱ)NA代表阿伏加德罗常数的值。下列说法正确的是( ) A.常温常压下,124 g P4中所含P—P键数目为4NA B.100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA C.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA D.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA [解析] A项,124 g P4是1 mol,所含P—P键的数目是6NA;B项,由于Fe3+水解,所含Fe3+数目小于0.1NA;C项,一个甲烷和一个乙烯分子中都含有4个H原子,标准状况下11.2 L混合气体为 0.5 mol,故混合气体中的氢原子数为2NA;D项,SO2与O2的反应属于可逆反应,生成的SO3不是2 mol。 [答案] C 2.(2017·全国卷Ⅱ)阿伏加德罗常数的值为NA。下列说法正确的是( ) A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH的数量为0.1NA B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA [解析] A项,因铵根离子水解,其数量小于0.1NA,错误;B项,2.4 g Mg为0.1 mol,与硫酸完全反应后转移的电子数为0.2NA,错误;C项,标准状况下,2.24 L任何气体所含有的分子数都为0.1NA,错误;D项,H2(g)+I2(g)??2HI(g),反应前后气体物质的量不变,正确。 [答案] D 3.(2017·全国卷Ⅲ)NA为阿伏加德罗常数的值。下列说法正确的是( ) A.0.1 mol的11B中,含有0.6NA个中子 B.pH=1的H3PO4溶液中,含有0.1NA个H+ C.2.24 L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2NA个P—Cl键 [解析] A项,硼原子的质子数为5,11B的中子数为6,故0.1 mol 的11B中含有中子数为0.6NA,正确;B项,未指明溶液体积,无法计算H+的个数,错误;C项,标准状况下苯为液体,故2.24 L(标准状况)苯的物质的量不为0.1 mol,生成的CO2分子也不是0.6NA,错误;D项,PCl3+Cl2??PCl5,这是一个可逆反应,1 mol PCl3与1 mol Cl2不可能完全反应生成1 mol PCl5,故增加的P—Cl键数目小于2NA,错误。 [答案] A 4.(2016·全国卷Ⅰ)设NA为阿伏加德罗常数值。下列有关叙述正确的是( ) A.14 g乙烯和丙烯混合气体中的氢原子数为2NA B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA C.1 mol Fe溶于过量硝酸,电子转移数为2NA D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA [解析] A项,乙烯和丙烯的最简式均为CH2,14 g乙烯和丙烯混合气体中相当于含有1 mol CH2,则其氢原子数为2NA,正确;B项,合成氨的反应是可逆反应,则1 mol N2与4 mol H2反应生成的NH3分子数小于2NA,错误;C项,铁和过量硝酸反应生成硝酸铁,故1 mol Fe溶于过量硝酸,电子转移数为3NA,错误;D项,标准状况下CCl4为液态,故2.24 L CCl4的物质的量不是0.1 mol,则其含有的共价键数不是0.4NA,错误。 [答案] A 考向二 溶液配制过程中仪器使用及过程分析 5.判断下列说法是否正确,正确的打“√”,错误的打“×” (1)(2017·全国卷Ⅲ改编)取20.00 mL盐酸,可在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL 后,将剩余盐酸放入锥形瓶( ) (2)(2016·浙江卷)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至刻度线( ) (3)(2016·海南卷)向容量瓶转移液体时,引流用的玻璃棒可以接触容量瓶刻度线以下内壁( ) [答案] (1)× (2)√ (3)√ 考向三 以物质的量为中心的计算 6.(1)(2017·全国卷Ⅱ)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:MnO+H++H2C2O4―→Mn2++CO2↑+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为________。 (2)(2016·全国卷Ⅰ)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数) (3)(2016·全国卷Ⅱ)联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1 kg的联氨可除去水中溶解的O2________kg。 [解析] (1)5Ca2+~5H2C2O4~2KMnO4,n(KMnO4)=0.0500 mol/L×36.00 mL×10-3 L·mL-1=1.80×10-3 mol,n(Ca2+)=4.50×10-3 mol,水泥中钙的质量分数为×100%=45.0%。 (2)NaClO2在杀菌消毒的过程中被还原为Cl-,则1 mol NaClO2得到电子的物质的量为4 mol,1 mol Cl2被还原为Cl- 时得到电子的物质的量为2 mol,故1 g NaClO2得到电子的物质的量为4/90.5 mol,根据“有效氯含量”的定义可知,NaClO2的有效氯含量为1.57。 (3)联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,发生的反应为N2H4+O2===N2+2H2O,理论上1 kg的联氨可除去水中溶解的氧气为1 kg÷32 g·mol-1×32 g·mol-1=1 kg。 [答案] (1)45.0% (2)1.57 (3)1 题型特点:选择题 填空题 考向评析:阿伏加德罗常数主要考查判断分子、原子、离子、电子等微粒数目,如物质所含粒子数目、转移电子数目、水解或电离造成离子浓度改变或数目变化等,形式灵活、范围广泛;溶液的配制主要考查仪器的使用及误差分析;而Ⅱ卷中的计算则以含量的测定、化学式的确定等,主要是通过方程式(一个或多个)完成计算。 答题启示:二轮复习时,对于阿伏加德罗常数判断类题目应注意隐含条件的挖掘,而Ⅱ卷计算应注重计算技巧(如关系式法)的灵活运用,加强计算能力的培养。 专题跟踪训练(二) 能力练(20分钟 50分) 一、选择题(每小题6分,共42分) 1.(2018·山东济宁期末)对于温度、压强一定的气体,下列数值中与其物质的量无关的是( ) A.质量 B.体积 C.分子数目 D.气体摩尔体积 [解析] 温度和压强一定时,气体摩尔体积为一定值,与物质的量无关,故符合题意。 [答案] D 2.(2018·上海浦东模拟)如图是氨气与氯化氢反应的装置。抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( ) A.气体反应物的总体积为0.224 L B.生成物的分子个数为0.005NA C.产物中的N—H键个数为0.02NA D.加水溶解后所得溶液中NH数目为0.005NA [解析] A项,未知气体所处的状态时,气体反应物的总体积无法确定,错误;B项,生成物为离子化合物NH4Cl,不存在分子,错误;D项,溶液中NH部分水解,错误。 [答案] C 3.(2018·吉林长春一测)设阿伏加德罗常数的值为NA,则下列说法中正确的是( ) A.0.1 mol HCl分子中含有的H+数目为0.1NA B.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA C.3 mol单质Fe完全转变为Fe3O4,失去的电子数为8NA D.0.1 mol·L-1的NaHCO3溶液中含有的HCO的数目一定小于0.5NA [解析] HCl是共价化合物,只有溶于水时才能完全电离,A项错误;标准状况下HF呈液态,不能用标准状况下的气体摩尔体积进行计算,B项错误;Fe3O4中Fe的化合价可认为是+,则3 mol单质铁完全转变为Fe3O4,失去的电子数为8NA,C项正确;题中没有给出溶液的体积,不能计算HCO的数目,D项错误。 [答案] C 4.(2018·东北三省四市一模)洁厕灵和84消毒液混合使用会发生反应:NaClO+2HCl===NaCl+Cl2↑+H2O,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是( ) A.每生成1 mol氯气,转移的电子数为2NA B.1 mol NaCl含有的电子数为28NA C.1 L 0.2 mol·L-1 NaClO溶液中含有的次氯酸根离子数为0.2NA D.标准状况下,将22.4 L HCl溶解在0.5 L水中,形成2 mol·L-1的盐酸 [解析] 根据该反应中氯元素的化合价变化可知,生成1 mol Cl2时转移1 mol电子,A项错误;1 mol NaCl中含1 mol Na+和1 mol Cl-,Na+和Cl-的电子数分别为10和18,故1 mol NaCl中含28 mol电子,B项正确;1 L 0.2 mol·L-1的NaClO溶液中含0.2 mol NaClO,但由于ClO-水解,故溶液中ClO-数目小于0.2NA,C项错误;标准状况下22.4 L HCl的物质的量为1 mol,溶解在0.5 L水中,所得溶液体积不为0.5 L,则盐酸的浓度不为2 mol·L-1,D项错误。 [答案] B 5.(2018·陕西西安一中模拟)实验室里需要用到480 mL 0.10 mol·L-1的硫酸铜溶液,下列实验用品及实验操作都正确的是( ) 选项 容量瓶容积 固体质量 实验操作 A 480 mL 硫酸铜:7.68 g 加入500 mL水 B 480 mL 胆矾:12.0 g 配成500 mL溶液 C 500 mL 硫酸铜:8.0 g 加入500 mL水 D 500 mL 胆矾:12.5 g 配成500 mL溶液 [解析] 配制480 mL 0.10 mol·L-1的硫酸铜溶液,由于实验室没有480 mL的容量瓶,故需要选用500 mL的容量瓶,即实际配制的溶液是500 mL 0.10 mol·L-1的硫酸铜溶液,配制500 mL 0.10 mol·L-1的硫酸铜溶液,需要硫酸铜的物质的量为0.10 mol·L-1×0.5 L=0.05 mol,需要硫酸铜的质量为160 g·mol-1 ×0.05 mol=8.0 g,需要胆矾的质量为250 g·mol-1×0.05 mol=12.5 g。没有480 mL的容量瓶,A、B项错误;将硫酸铜加入500 mL水中,得到的溶液体积不是500 mL,配制的不是500 mL 0.10 mol·L-1的硫酸铜溶液,C项错误;12.5 g胆矾的物质的量为0.05 mol,配成500 mL溶液,所得溶液的浓度为0.10 mol·L-1,D项正确。 [答案] D 6.(2018·辽宁葫芦岛六校模拟)下列叙述错误的是( ) A.10 mL质量分数为98%的浓H2SO4,用10 mL水稀释后,H2SO4的质量分数大于49% B.配制0.1 mol·L-1的Na2CO3溶液500 mL,需要称量Na2CO3固体质量为5.3 g C.在标准状况下,将22.4 L氨气溶于1 L水中,得到1 mol·L-1的氨水 D.向两份完全一样的稀烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O 的物质的量相等(保持温度不变) [解析] 设稀释前浓硫酸的密度为ρ g·cm-3,根据质量分数的定义,稀释后H2SO4的质量分数为×100%=×100%,因为浓硫酸的密度大于水的密度,故稀释后H2SO4的质量分数大于49%,A项正确;Na2CO3固体的质量为0.1 mol·L-1×0.5 L×106 g·mol-1=5.3 g,B项正确;将1 mol氨气溶于1 L水中,所得溶液的体积不是1 L,C项错误;根据钠元素守恒,所得溶液均恰好饱和时,投入的Na2O2和Na2O的物质的量之比为1∶1,D项正确。 [答案] C 7.(2018·湖南浏阳一中等五校联考)将5.6 L CO2气体缓慢通过一定量的Na2O2固体后,得到3.36 L气体(气体体积均在标准状况下测定),所得气体的质量为( ) A.3.8 g B.4.8 g C.5.4 g D.6.6 g [解析] 设参加反应的CO2气体的体积为a,生成的O2的体积为b,则: 2CO2+2Na2O2===2Na2CO3+O2 气体体积减小ΔV 2 1 1 a b 5.6 L-3.36 L=2.24 L 解得a=4.48 L,b=2.24 L,所以3.36 L气体中CO2体积为5.6 L-4.48 L=1.12 L,O2的体积为2.24 L,则3.36 L气体的质量为×44 g/mol+×32 g/mol=5.4 g,C正确。 [答案] C 二、非选择题(8分) 8.(2018·河南开封模拟)实验室配制100 mL 1.0 mol·L-1的硫酸,回答下列问题: (1)所需98%的浓硫酸(密度为1.84 g·mL-1)的体积是________mL(精确到小数点后一位)。量取时应选择最大量程为________mL的量筒。 A.5 B.10 C.20 D.100 (2)配制过程和主要步骤依次是: A.量取 B.稀释 C.转移 D.________ E.振荡 F.________ G.摇匀 (3)步骤B的操作方法是_________________________________ ______________________________________________________。 进行该操作后,________(填“能”或“不能”)马上进行操作C。 (4)上述(2)中F操作的方法是____________________________ ______________________________________________________。 (5)操作B、C均要用到的玻璃仪器是________,若进行C操作时未用该仪器,导致有溶液外流,出现这种情况后,正确的处理方法是___________________________________________________。 (6)将浓硫酸按所需体积准确量取后,在空气中放置一段时间后再进行B、C、D、E、F、G操作,则所配溶液的浓度将________(填“大于”、“等于”或“小于”)1.0 mol·L-1。 [解析] (1)98%浓硫酸的物质的量浓度c=1000ρw/M=1000×1.84×98%/98 mol·L-1= 18.4 mol·L-1,设需要的浓硫酸的体积为V mL,根据稀释前后溶质的物质的量不变可知:18.4 mol·L-1×V×10-3 L=1.0 mol·L-1×100×10-3 L,解得V=5.4 ;应根据大而近的原则来选择量筒,根据所需的浓硫酸的体积可知,应选取量筒的规格为10 mL,故选B。(2)配制过程和主要步骤依次是量取、稀释、移液、洗涤、振荡、定容、摇匀。(3)步骤B的操作方法是将浓硫酸沿着烧杯内壁慢慢倒入盛有水的烧杯中,并不断用玻璃棒进行搅拌;进行该操作后,不能马上进行操作C,要等溶液冷却到室温再进行移液。(4)定容的操作方法是:将蒸馏水注入容量瓶,当液面距离瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切。(5)操作B、C均要用到的玻璃仪器是玻璃棒,若进行C操作时未用该仪器,导致有溶液外流,出现这种情况后,正确的处理方法是重新配制。(6)将浓硫酸按所需体积准确量取后,在空气中放置一段时间后再进行B、C、D、E、F、G操作,则所配溶液的浓度不变,因为后面的操作中也要加水。 [答案] (1)5.4 B (2)洗涤 定容 (3)将浓硫酸沿着烧杯内壁慢慢倒入盛有水的烧杯中,并不断用玻璃棒进行搅拌 不能 (4)将蒸馏水注入容量瓶,当液面距离瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切 (5)玻璃棒 重新配制 (6)等于 拔高练(25分钟 50分) 一、选择题(每小题6分,共24分) 1.(2018·山东德州期末)下列判断中一定正确的是( ) A.11.2 L HCl气体其物质的量为0.5 mol B.等质量的O2与O3中,氧原子的个数比为3∶2 C.分别用H2O2、KMnO4分解制O2,当制得等质量O2 时,转移电子数之比为1∶2 D.10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl-物质的量浓度比为1∶3 [解析] A项,没有给出氯化氢的温度和压强,因此无法确定其物质的量,错误;B项,两者均由O原子组成,因此等质量的两种物质中,含有的氧原子个数相等,错误;C项,H2O2中O元素的化合价为-1价,高锰酸钾中O元素的化合价为-2价,因此生成等质量氧气时,转移电子数之比为1∶2,正确;D项,两溶液中氯离子浓度相等,错误。 [答案] C 2.NA代表阿伏加德罗常数的值。下列说法正确的是( ) A.相同物质的量的OH-和CH中含有相同数目的电子 B.苯与液溴反应生成1 mol溴苯,消耗0.5NA个Br2 C.常温下CH3COONH4溶液的pH=7,则0.5 mol·L-1的CH3COONH4溶液中NH浓度为0.5 mol·L-1 D.a g C2H4和C3H6的混合物中,所含碳氢键的数目为 [解析] 1个OH-中含有10个电子,1个CH中含有8个电子,相同物质的量的OH-和CH中含有的电子数目不同,A错误;在该取代反应中,当生成1 mol溴苯时,消耗1 mol Br2,B错误;CH3COONH4是弱酸弱碱盐,由于NH水解,其浓度小于0.5 mol·L-1,C错误;C2H4与C3H6的最简式都为CH2,故该混合物中所含氢原子的物质的量为×2 mol,所含碳氢键的数目与氢原子的数目相同,都为×NA,D正确。 [答案] D 3.(2018·四川成都龙泉中学考试)溶液的配制过程能引起浓度偏高的是( ) ①用1 g 98%的浓硫酸加4 g水配成体积比为1∶4的硫酸 ②配制一定物质的量浓度的硫酸时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线 ③在98 mL无水乙醇中加入2 g碘片溶解后配成2%的碘酒 ④在80 mL水中加入18.4 mol·L-1的硫酸20 mL,配制3.68 mol·L-1的硫酸 ⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水 ⑥10%的硫酸和90%的硫酸等体积混合配制50%的硫酸 A.①③⑤ B.②④⑤ C.③④⑥ D.④⑤⑥ [解析] ①浓硫酸的密度大于1 g·mL-1,水的密度是1 g·mL-1,用1 g 98%的浓硫酸加4 g水配成1∶4(体积比)的硫酸,浓硫酸的体积和水的体积比小于1∶4,导致所配制溶液浓度偏小;②配制一定物质的量浓度的硫酸时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线,这是因为摇匀时部分溶液附着在了刻度线上方的瓶壁上,故所配制溶液浓度不变;③乙醇的密度小于1 g·mL-1,故在98 mL无水乙醇中加入2 g碘片溶解后形成的溶液碘的质量分数大于2%;④在80 mL水中加入18.4 mol·L-1的硫酸20 mL,所得混合溶液体积小于100 mL,所以所配制溶液的浓度高于3.68 mol·L-1;⑤5x%的氨水与x%的氨水等质量混合时所得溶液溶质的质量分数为(5x%+x%)/2=3x%,等体积混合时,由于5x%的氨水的密度小于x%的氨水的密度,故所得溶液溶质的质量分数小于3x%;⑥90%和10% 的两种硫酸等体积混合后,所得溶液溶质的质量分数大于50%。故本题选C。 [答案] C 4.(2018·黑龙江哈尔滨六中检测)T ℃时,NaCl的溶解度为a g,取该温度下的饱和氯化钠溶液V mL,测得其密度为ρ g·cm-3,则下列表达式正确的是( ) A.w(NaCl)=% B.n(NaCl)= mol C.c(NaCl)= mol·L-1 D.n(NaCl)= mol [解析] 该饱和氯化钠溶液的质量分数w(NaCl)=×100%=%,A项错误;V mL饱和氯化钠溶液的质量为ρ g·cm-3×V mL=ρV g,氯化钠的质量分数为×100%,则该溶液中含有的氯化钠的物质的量为= mol,B项错误,D项正确;该饱和氯化钠溶液的浓度为 mol÷(V×10-3 L)= mol·L-1,C项错误。 [答案] D 二、非选择题(26分) 5.(12分)(2018·河南中原名校联考)请回答下列问题: (1)下列所给出的几组物质中:含有分子数最少的是______(填序号,下同);标准状况下体积最小的是________。 ①1 g H2 ②2.408×1023个CH4分子 ③10.8 g H2O ④标准状况下6.72 L CO2 (2)溶液导电能力取决于自由移动离子的浓度和所带电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强。现有浓度均为1 mol·L-1的以下电解质溶液:①K2CO3②AgNO3③NaHSO4④Al2(SO4)3⑤H2SO4⑥Ba(OH)2。这些溶液中导电能力最强的是________(填序号,下同),导电能力最弱的是________。 (3)在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。该混合溶液中CuCl2的物质的量浓度为________mol·L-1。 [解析] (1)①n(H2)=0.5 mol;②n(CH4)=0.4 mol;③n(H2O)=0.6 mol;④n(CO2)=0.3 mol;物质的量越少,分子数越少,故最少的是④;标准状况下水为液态,故体积最小的是③。(2) 溶液中自由移动的离子浓度越大,所带电荷数越多,导电性越强,反之越弱,因此这些溶液中导电能力最强的是硫酸铝;导电能力最弱的是AgNO3。(3)据溶液中的电荷守恒:c(Na+)+2c(Mg2+)+2c(Cu2+)=c(Cl-),1.0 mol·L-1+0.5 mol·L-1×2+2c(Cu2+)=3 mol·L-1,c(Cu2+)=0.5 mol·L-1,c(CuCl2)=0.5 mol·L-1。 [答案] (1)④ ③ (2)④ ② (3)0.5 6.(14分)(2018·河北衡水二中测试)某化学研究性学习小组配制含有NH、Cl-、K+、SO的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水; 提供的实验仪器有:①药匙、②托盘天平、③烧杯、④玻璃棒、⑤胶头滴管、⑥量筒。 请回答下列问题: (1)该植物培养液中,NH的物质的量浓度为________。 (2)该研究小组配制该植物培养液时,还需用到的实验仪器是________(填字母)。 A.450 mL容量瓶 B.500 mL容量瓶 C.两个250 mL容量瓶 (3)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=________g,m[(NH4)2SO4]=________g。 (4)乙同学用所提供药品中的三种进行配制,请帮助该同学选用三种物质(填化学式):________________、________________、________________。 (5)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是________(填字母)。 A.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 B.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶 C.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线 D.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线 [解析] (1)根据溶液呈电中性有:c(NH)+c(K+)=c(Cl-)+2c(SO),则c(NH)=c(Cl-)+2c(SO)-c(K+)=0.8 mol·L-1。(2)实验所用容量瓶规格应该等于或略大于实验所需配制溶液的体积,实验室没有450 mL的容量瓶,且用容量瓶配制溶液时,需一次完成,应选用500 mL容量瓶。(3)配制该溶液所需的溶质质量应该按配制500 mL溶液来计算,所需氯化钾和硫酸铵的物质的量均为0.2 mol,对应的质量分别为14.9 g、26.4 g。(4)由题知,该植物培养液中,n(NH)=2n(Cl-)=2n(K+)=2n(SO),若用三种物质来配制,三种物质应该为硫酸铵、氯化铵、硫酸钾,且物质的量之比为1∶2∶1。(5)A项,未洗涤烧杯和玻璃棒,会有部分溶质残留在烧杯和玻璃棒上,使所配溶液浓度偏低,正确;B项,转移时部分溶液溅出容量瓶,使溶质损失,所配溶液浓度偏低,正确;C项,加水时溶液凹液面高于容量瓶刻度线,说明所配溶液体积偏大,浓度偏低,正确;D项,俯视读数时,实际液面低于容量瓶刻度线,所配溶液体积偏小,浓度偏高,错误。 [答案] (1)0.8 mol·L-1 (2)B (3)14.9 26.4 (4)(NH4)2SO4 NH4Cl K2SO4 (5)ABC查看更多