- 2021-04-14 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西专用2020版高考化学二轮复习专题能力训练12物质结构与性质选修含解析
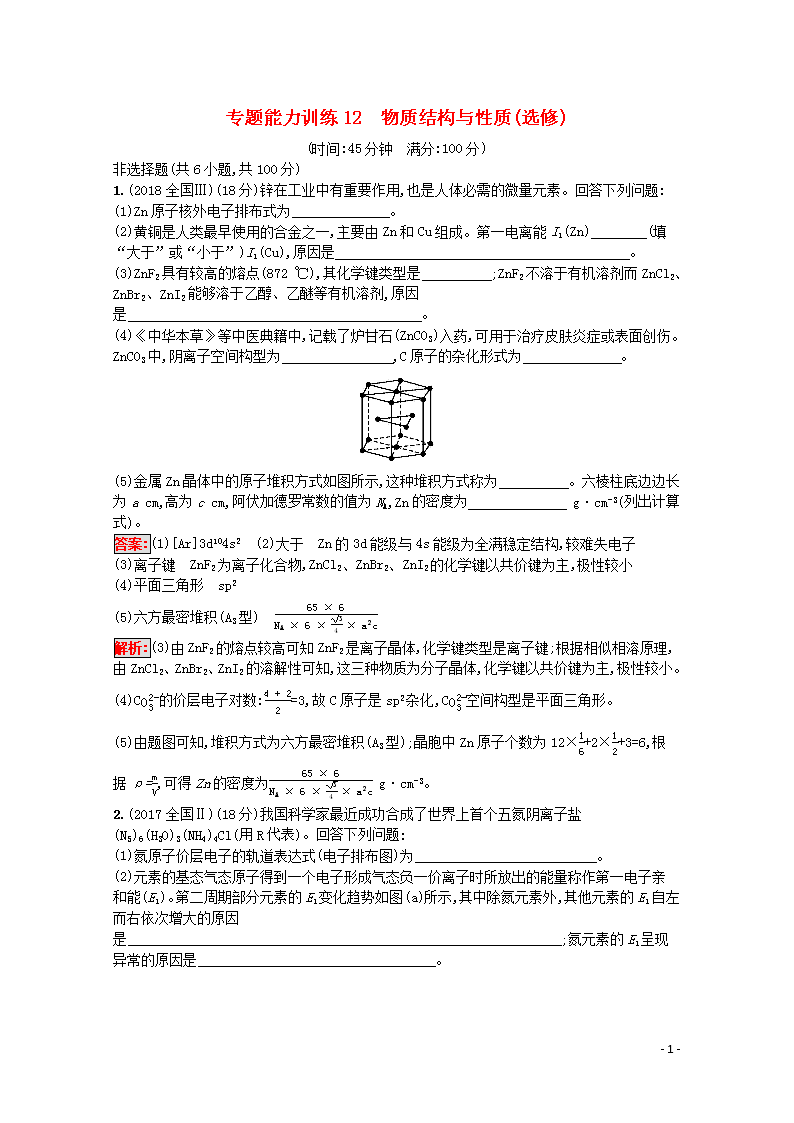
专题能力训练12 物质结构与性质(选修) (时间:45分钟 满分:100分) 非选择题(共6小题,共100分) 1.(2018全国Ⅲ)(18分)锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题: (1)Zn原子核外电子排布式为 。 (2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) (填“大于”或“小于”)I1(Cu),原因是 。 (3)ZnF2具有较高的熔点(872 ℃),其化学键类型是 ;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是 。 (4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为 ,C原子的杂化形式为 。 (5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为 。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为 g·cm-3(列出计算式)。 答案:(1)[Ar]3d104s2 (2)大于 Zn的3d能级与4s能级为全满稳定结构,较难失电子 (3)离子键 ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小 (4)平面三角形 sp2 (5)六方最密堆积(A3型) 65×6NA×6×34×a2c 解析:(3)由ZnF2的熔点较高可知ZnF2是离子晶体,化学键类型是离子键;根据相似相溶原理,由ZnCl2、ZnBr2、ZnI2的溶解性可知,这三种物质为分子晶体,化学键以共价键为主,极性较小。 (4)CO32-的价层电子对数:4+22=3,故C原子是sp2杂化,CO32-空间构型是平面三角形。 (5)由题图可知,堆积方式为六方最密堆积(A3型);晶胞中Zn原子个数为12×16+2×12+3=6,根据ρ=mV,可得Zn的密度为65×6NA×6×34×a2c g·cm-3。 2.(2017全国Ⅱ)(18分)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题: (1)氮原子价层电子的轨道表达式(电子排布图)为 。 (2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是 ;氮元素的E1呈现异常的原因是 。 - 6 - 图(a) 图(b) (3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。 ①从结构角度分析,R中两种阳离子的相同之处为 ,不同之处为 。(填标号) A.中心原子的杂化轨道类型 B.中心原子的价层电子对数 C.立体结构 D.共价键类型 ②R中阴离子N5-中的σ键总数为 个。分子中的大π键可用符号Πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π66),则N5-中的大π键应表示为 。 ③图(b)中虚线代表氢键,其表示式为(NH4+)N—H…Cl、 、 。 (4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为 。 答案:(1) (2)从左到右原子半径减小,元素非金属性增强,得电子能力增强 N的2p能级处于半充满状态 (3)①ABD C ②5 Π56 ③(H3O+)O—H…N(N5-) (NH4+)N—H…N(N5-) (4)y=d×(a×10-7)3×NAM 解析:(1)氮原子位于第二周期第ⅤA族,价电子是最外层电子,其价电子排布图为。 (2)根据图(a)可知,同周期从左到右,元素的原子半径逐渐减小,元素非金属性增强,得到电子能力增强,因此同周期从左到右元素的第一电子亲和能(E1)增大;N原子的2p能级处于半充满状态,原子结构相对稳定,故氮元素的E1呈现异常。 (3)①根据图(b)可知,阳离子分别为NH4+和H3O+,NH4+中的中心原子N形成4个σ键,孤电子对数为5-1-4×12=0,价层电子对数为4,杂化类型是sp3;H3O+中的中心原子O形成3个σ键,孤电子对数为6-1-32=1,其VSEPR模型是正四面体形,价层电子对数为4,杂化类型是sp3,离子空间构型是三角锥形,故二者相同之处为ABD,不同之处为C。②根据图(b)可知,N5- - 6 - 中的σ键总数为5;根据信息可知N5-中的大π键应表示为Π56;③图(b)所示结构中还有的氢键是(H3O+)O—H…N(N5-)和(NH4+)N—H…N(N5-)。 (4)一个晶胞体积为(a×10-7)3 cm3,一个晶胞的质量为yMNA g,根据密度的定义式可得d=yMNA(a×10-7)3 g·cm-3,解之y=dNA(a×10-7)3M。 3.(18分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解。 (1)卤族元素位于周期表的 区;溴的价电子排布式为 。 (2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是 。 (3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。 氟 氯 溴 碘 铍 第一电离能(kJ·mol-1) 1 681 1 251 1 140 1 008 900 (4)已知高碘酸有两种形式,化学式分别为H5IO6()和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6 (填“>”“<”或“=”)HIO4。 (5)已知ClO2-为角形,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为 。 (6)下图为碘晶体晶胞结构。有关说法中正确的是 。 碘晶体晶胞 A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构 B.用均摊法可知平均每个晶胞中有4个碘原子 C.碘晶体为无限延伸的空间结构,是原子晶体 D.碘晶体中的碘原子间存在非极性键和范德华力 (7)已知CaF2晶体(见下图)的密度为ρ g·cm-3,NA为阿伏加德罗常数的值,相邻的两个Ca2+的核间距为a cm,则CaF2的相对质量可以表示为 。 氟化钙晶胞 - 6 - 答案:(1)p 4s24p5 (2)氢键 (3)碘 (4)< (5)sp3杂化 (6)A (7)22a3ρ NA 解析:(1)溴位于第四周期第ⅦA族,所以价电子数为7;(3)应注意铍不属于卤素原子;(4)后者的非羟基氧为3个,前者只有1个,所以后者酸性强;(5)中心原子氯原子形成两个σ键,孤电子对数=7-2×2+12=2,sp3杂化;(6)在立方体的顶面上,有5个I2,4个方向相同,结合其他面考虑可知A项正确;每个晶胞中有4个碘分子,B项错误;此晶体是分子晶体,C项错误;碘原子间只存在非极性共价键,范德华力存在于分子与分子之间,D项错误;(7)一个晶胞中含有Ca2+为顶点(1)+面心(3)=4;含有F-为8个;相邻的Ca2+是顶点与面心的距离最短,所以该晶胞的棱长为2a cm,一个晶胞的体积为22a3 cm3,一个晶胞的质量为4×MNA g,依据ρ=晶胞质量晶胞体积列式计算。 4.(16分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。 (1)肼(N2H4)可用作火箭燃料,其原理是N2O4(l)+2N2H4(l)3N2(g)+4H2O(g),若反应中有4 mol N—H键断裂,则形成的π键有 mol。 (2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的立体构型为 。 (3)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构见图a。写出该反应的化学方程式: 。 (4)叠氮化钠(NaN3)分解反应为2NaN3(s)2Na(l)+3N2(g),下列有关说法正确的是 (填序号)。 A.常温下,N2很稳定,是因为N的电负性大 B.钠晶胞结构见图b,每个晶胞含有2个钠原子 C.第一电离能(I1):N>O>P>S D.NaN3与KN3结构类似,晶格能:NaN3查看更多