- 2021-04-14 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
杭州专版2020中考化学复习方案课时训练04水和溶液
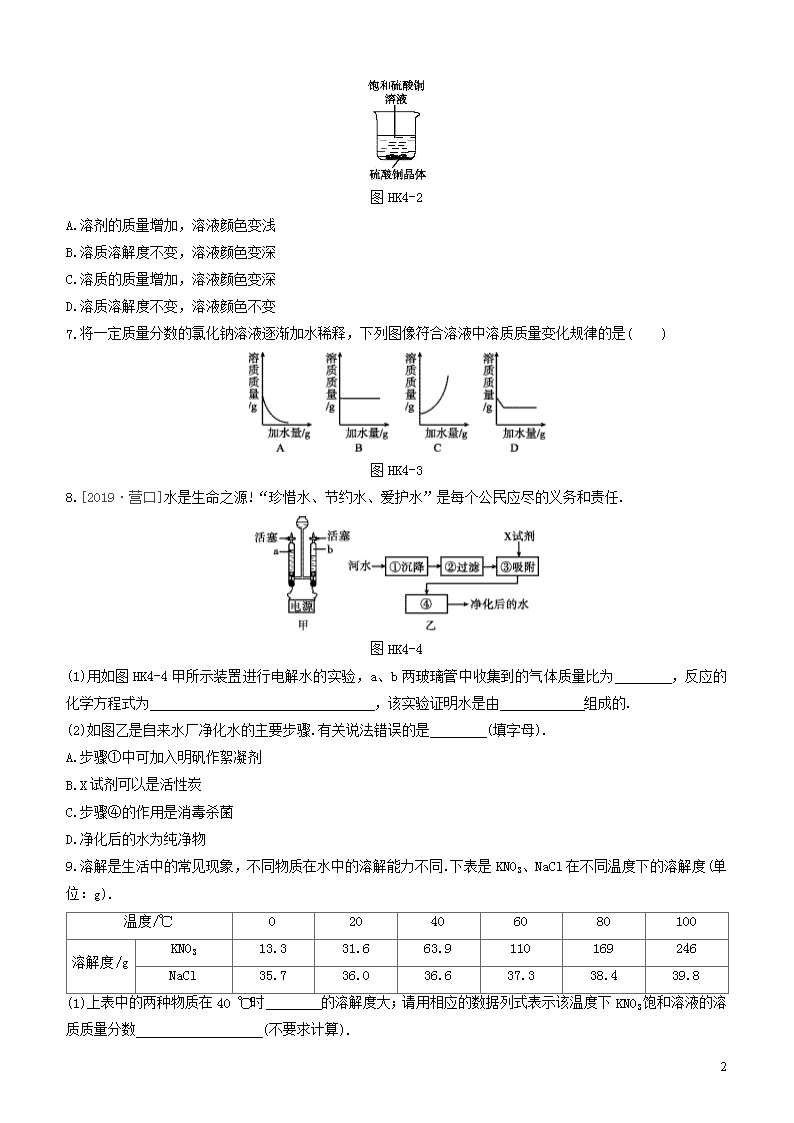
课时训练(四) 水和溶液 (限时:45分钟) |基础过关| 1.下列关于水的性质的说法错误的是 ( ) A.水能溶解所有的物质 B.水在通电时能分解 C.水能与一些氧化物反应 D.液态水的密度比冰的密度大 2.关于水在化学实验中的作用,下列说法错误的是 ( ) A.水可用于有活塞(开关)结构的仪器和装置的查漏 B.在尾气处理中,可用水吸收一氧化碳 C.盛放白磷的试剂瓶中水的作用是“水封” D.铁丝燃烧实验中,水用来降低产物的温度 3.[2019·百色]溶液的知识广泛用于生产、生活中.下列有关溶液说法正确的是 ( ) A.碘溶于水得到碘酒 B.溶液是均一的、稳定的混合物 C.洗涤剂去油污的原理是溶解 D.植物油加入水中可得溶液 4.[2018·宜昌]下列物质溶于水的过程中,溶液温度会明显降低的是 ( ) A.氯化钠 B.硝酸铵 C.浓硫酸 D.氢氧化钠 5.[2018·温州]某“天气瓶”通过樟脑在酒精溶液中的结晶情况反映气温变化.如图HK4-1为该“天气瓶”在三种不同气温下的状况,则瓶内溶液一定为相应气温下樟脑饱和溶液的是 ( ) 图HK4-1 A.甲、乙 B.甲、丙 C.乙、丙 D.甲、乙、丙 6.一定温度下,向烧杯中加入一定质量的水,仅有部分晶体溶解.所得溶液与原溶液相比,说法正确的是 ( ) 7 图HK4-2 A.溶剂的质量增加,溶液颜色变浅 B.溶质溶解度不变,溶液颜色变深 C.溶质的质量增加,溶液颜色变深 D.溶质溶解度不变,溶液颜色不变 7.将一定质量分数的氯化钠溶液逐渐加水稀释,下列图像符合溶液中溶质质量变化规律的是( ) 图HK4-3 8.[2019·营口]水是生命之源!“珍惜水、节约水、爱护水”是每个公民应尽的义务和责任. 图HK4-4 (1)用如图HK4-4甲所示装置进行电解水的实验,a、b两玻璃管中收集到的气体质量比为 ,反应的化学方程式为 ,该实验证明水是由 组成的. (2)如图乙是自来水厂净化水的主要步骤.有关说法错误的是 (填字母). A.步骤①中可加入明矾作絮凝剂 B.X试剂可以是活性炭 C.步骤④的作用是消毒杀菌 D.净化后的水为纯净物 9.溶解是生活中的常见现象,不同物质在水中的溶解能力不同.下表是KNO3、NaCl在不同温度下的溶解度(单位:g). 温度/℃ 0 20 40 60 80 100 溶解度/g KNO3 13.3 31.6 63.9 110 169 246 NaCl 35.7 36.0 36.6 37.3 38.4 39.8 (1)上表中的两种物质在40 ℃时 的溶解度大;请用相应的数据列式表示该温度下KNO3饱和溶液的溶质质量分数 (不要求计算). 7 (2)请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法: . (3)20 ℃时,将20 g NaCl放入50 g水中,所得溶液的质量是 g. (4)从NaCl溶液中得到NaCl晶体的方法是 . 10.如图HK4-5是配制一定量的质量分数为0.9%的NaCl溶液的过程示意图.结合图回答问题. 图HK4-5 (1)请指出图中两处明显的错误,说明改正方法. 错误①: , 改正: ; 错误②: , 改正: . (2)若按照上述图示操作(假定再无其他错误),则所配制溶液的质量分数 (填“大于”“小于”或“等于”)0.9%. (3)若将(1)中的错误更正后重新配制溶液,测得溶液的质量分数大于0.9%.请你分析可能的原因(写两条): ; . 11.实验室一瓶新购进的浓硫酸,其标签的部分内容如图HK4-6所示. 图HK4-6 (1)若该瓶硫酸还没有开瓶使用,瓶内溶质的质量为 g(计算结果保留到0.1,下同). (2)若要配制9.8%的稀硫酸400 g,则需用该浓硫酸的质量为 g. |走进重高| 1.[2019·扬州]1800年,人类电解水获得成功.某同学利用如图HK4-7所示装置进行该实验时,发现左、右两侧试管内气体体积比略大于2∶1.下列说法错误的是 ( ) 图HK4-7 已知:①相同条件下,气体的体积比等于气体的分子个数比; ②常温常压时,1 L水可溶解0.031 L O2、0.57 L O3. 7 A.水在通电时能发生化合反应 B.实验中若加入少量NaOH溶液,则导电性增强 C.从实验结果可以确定,相同条件下,H2在水中的溶解度比O2的小 D.若右侧试管内产生少量O3,也会使左、右两侧试管内气体体积比略大于2∶1 2.用硫酸铜进行如图HK4-8所示的实验,对所得溶液的分析正确的是 ( ) 图HK4-8 A.三种溶液中溶质溶解度一样 B.②溶液是不饱和溶液 C.③溶液颜色最深 D.温度不同,无法比较①③溶液的溶质质量分数 3.[2018·宁波]20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量.记录数据如表: 实验小组 第一组 第二组 第三组 第四组 水的质量/g 50 50 50 50 所取NaCl的质量/g 15 20 25 30 剩余NaCl的质量/g 0 2 7 12 下列说法错误的是 ( ) A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl B.用蒸发的方法可以使不饱和溶液变成饱和溶液 C.第二组所得溶液的溶质与溶剂的质量比为9∶25 D.相同温度下,NaCl在水里的溶解度与水的质量无关 4.[2018·滨州]小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠、量取水的操作规程进行操作(图HK4-9所示为小芳操作时的读数,其他操作都正确).小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1 g/cm3)约为 ( ) 图HK4-9 A.12.4% B.17.2% C.16.9% D.12.5% 7 5.下列关于溶液的说法正确的是 ( ) A.某温度下两种不同物质的溶液,溶质质量分数相同,则这两种物质的溶解度一定相同 B.溶质质量分数为10%的200 mL某溶液,密度为1.2 g/cm3,其中含溶质24 g C.饱和溶液析出晶体后,溶质的质量分数一定减小 D.不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大 6.某温度下,向100 g饱和澄清石灰水中加入5.6 g生石灰,充分反应后,恢复到原来的温度时,下列说法正确的是 ( ) A.沉淀的质量为5.6 g B.溶质的质量分数不变 C.溶液中Ca2+的总数不变 D.饱和石灰水的质量等于98.2 g 7.[2019·金华]甲是60 ℃的蔗糖溶液,按如图HK4-10所示进行操作.以下分析错误的是 ( ) 图HK4-10 A.甲一定是不饱和溶液 B.丙和丁一定是饱和溶液 C.乙的溶质质量分数一定比甲大 D.甲和丙的溶质质量分数一定不相等 8.太湖水经苏州胥江水厂处理的大致流程如下: 图HK4-11 (1)从沉淀池中出来的水经过沙滤池的操作称为 ,经沙滤池后的水在灭菌池中被通入的臭氧(O3)进行杀菌处理,再经一系列后续处理成为自来水进入千家万户;在深度处理区炭滤池中活性炭的作用是 . (2)有人做了如图HK4-12的甲、乙两个实验.因在乙实验中得到一批有色沉淀,于是就说“自来水没有纯水好”.某校兴趣小组同学为验证上述说法的真伪,又增做丙和丁两个对比实验 (均在室温下). 图HK4-12 项目 甲 乙 丙 丁 与电源正极相连的电极附近区域 现象不 明显 有小气泡产生,渐有有色沉淀生成,沉淀颜色逐渐加深 有刺激性气味的较多气泡产生,且有较多有色沉淀生成 有小气泡产生 与电源负极相连的电极附近区域 现象不 明显 有小气泡产生 有较多气泡产生 有小气泡产生,渐有少量沉淀生成 7 ①上述实验中能量转换的形式为 . ②由上述4个对比实验可知: (填序号)装置中水样的导电能力最强.在上述对比实验中生成有色沉淀的主要原因是 . (3)水厂的检测人员用浑浊度仪测出该厂自来水中颗粒物的量为0.55;用pH仪测出水质的 度为7.66,此时水质呈弱 性.这是因为自来水中含有多种天然水溶解的对人体有益的微量元素的缘故,且在合格标准内. 9.食盐不仅是生活必需品,也是生产氯气和烧碱的重要原料.如图HK4-13所示,20 ℃时在混合溶液中,随着氢氧化钠含量的变化,氯化钠达到饱和状态时其溶质质量分数的变化曲线.已知曲线上A、B、C、D四个点的坐标分别为:A(0,26.5);B(14.0,15.0);C(18.8,11.7);D(38.0,2.0). 图HK4-13 试计算和填空: (1)20 ℃时氯化钠在水中的溶解度为 g,D点处氯化钠的溶解度是 g(计算结果精确到小数点后1位). (2)20 ℃时曲线C点处溶液中钠元素的质量分数是 (计算结果精确到0.1%). (3)若现有20 ℃时,满足曲线上B点指标的溶液,可用 的方法尽可能地降低氯化钠的含量,达到提纯氢氧化钠的目的. 7 【参考答案】 基础过关 1.A 2.B 3.B 4.B 5.C 6.D 7.B 8.(1)8∶1 2H2O2H2↑+O2↑ 氢元素和氧元素 (2)D 9.(1)KNO3 63.9 g63.9 g+100 g×100% (2)降低温度(或加入KNO3等合理即可) (3)68 (4)蒸发结晶 10.(1)瓶塞正放在桌面上 瓶塞应倒放在桌面上 氯化钠放在托盘天平的右盘称量 称量NaCl时,药品要放在托盘天平的左盘 (2)小于 (3)称量NaCl的实际质量比计算质量大 加入水的实际量比计算量小(合理即可) 11.(1)901.6 (2)40.0 走进重高 1.A 2.C 3.A 4.A 5.B 6.B 7.D [解析]甲溶液恒温蒸发20 g水后没有晶体析出,则甲溶液一定是不饱和溶液,故A正确;丙溶液中有固体剩余,丁溶液是过滤后所得溶液,所以二者一定都是饱和溶液,故B正确;甲溶液恒温蒸发20 g水后,乙溶液中没有晶体析出,溶液中的溶剂减少,所以乙溶液的溶质质量分数一定比甲大,故C正确;无法确定甲溶液和丙溶液的溶质质量分数大小,故D错误. 8.(1)过滤 吸附色素和异味 (2)①电能→化学能 ②丙 在通电情况下,铜电极与溶液中的某些离子发生了反应 (3)酸碱 碱 9.(1)36.1 3.3 (2)15.4% (3)蒸发结晶 7查看更多