江苏沭阳如东中学2020~2021高二年级第一学期期中模拟试题
期中模拟综合卷一(选修4 一二四章)
一、单项选择题
1、下列有关生活中化学的叙述,不正确的是 ( )
A.钢铁在海水中比在河水中更易生锈
B.大力开发和应用氢能源有利于实现“低碳经济”
C.严禁乱丢废电池,以防止重金属污染土壤和水源
D.为防止铁制品生锈,可以在铁制品表面焊接一些小铜块
2、已知:①H+(aq)+OH−(aq)=H2O(l) ΔH1= -57.3kJ·mol−1,②H2(g)+1/2O2(g)=H2O(g) ΔH2=-241.8 kJ·mol−1,下列有关说法不正确的是 ( )
A.向含0.1mol NaOH的溶液中加入一定体积的1mol·L−1乙二酸(二元
弱酸),反应中的能量变化如图所示
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol−1
C.若反应②中水为液态,则同样条件下的反应热:ΔH<ΔH2
D.只根据反应②不能得出H2的燃烧热
3、 N2(g)与H2(g)在铁催化剂表面经历如图过程生成NH3(g),下列说法正确的是( )
A.Ⅰ中1 129 kJ为该反应过程的活化能
B.N2(g)+3H2(g)⇌2NH3(g)
ΔH=2×(324+389+460-1 129)kJ·mol-1
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g) ⇌2NH3(g) ΔH>0
4、溴与氢气在一定条件下反应的热化学方程式如下:
①Br2(g)+H2(g)⇌2HBr(g) ΔH= -Q1 kJ·mol−1
②Br2(l)+H2(g)⇌2HBr(g) ΔH= -Q2 kJ·mol−1
下列说法正确的是
A.Q1
-Q1 kJ·mol−1
D.向1mol Br2(g)中加入1mol H2(g)在该条件下充分反应,放出Q1 kJ热量
5、通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s)+H2O(g) = CO(g)+H2(g) △H1= a kJ/mol
②CO(g)+H2O(g) = CO2(g)+H2(g) △H2= b kJ/mol
③CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H3= c kJ/mol
④2CH3OH(g) = CH3OCH3(g)+H2O(g) △H4= d kJ/mol
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应的
D.反应的
9
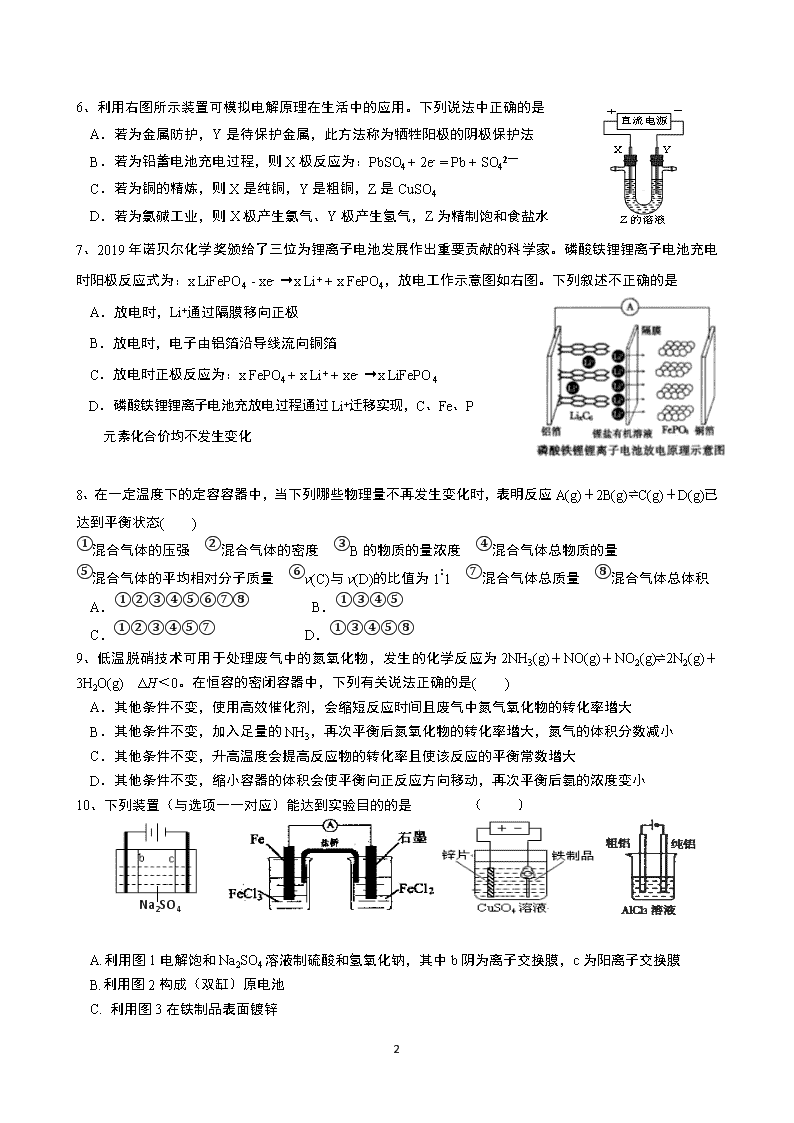
6、利用右图所示装置可模拟电解原理在生活中的应用。下列说法中正确的是
A.若为金属防护,Y是待保护金属,此方法称为牺牲阳极的阴极保护法
B.若为铅蓄电池充电过程,则X极反应为:PbSO4 + 2e- = Pb + SO42—
C.若为铜的精炼,则X是纯铜,Y是粗铜,Z是CuSO4
D.若为氯碱工业,则X极产生氯气、Y极产生氢气,Z为精制饱和食盐水
7、2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为:x LiFePO4 - xe- →x Li+ + x FePO4,放电工作示意图如右图。下列叙述不正确的是
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:x FePO4 + x Li+ + xe- →x LiFePO4
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P
元素化合价均不发生变化
8、在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)⇌C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量
⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1∶1 ⑦混合气体总质量 ⑧混合气体总体积
A.①②③④⑤⑥⑦⑧ B.①③④⑤
C.①②③④⑤⑦ D.①③④⑤⑧
9、低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g)⇌2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( )
A.其他条件不变,使用高效催化剂,会缩短反应时间且废气中氮气氧化物的转化率增大
B.其他条件不变,加入足量的NH3,再次平衡后氮氧化物的转化率增大,氮气的体积分数减小
C.其他条件不变,升高温度会提高反应物的转化率且使该反应的平衡常数增大
D.其他条件不变,缩小容器的体积会使平衡向正反应方向移动,再次平衡后氨的浓度变小
Na2SO4
10、下列装置(与选项一一对应)能达到实验目的的是 ( )
A.利用图1电解饱和Na2SO4溶液制硫酸和氢氧化钠,其中b阴为离子交换膜,c为阳离子交换膜
B.利用图2构成(双缸)原电池
C. 利用图3在铁制品表面镀锌
9
D.利用图4实现粗铝的精炼
高温
二、不定项选择题
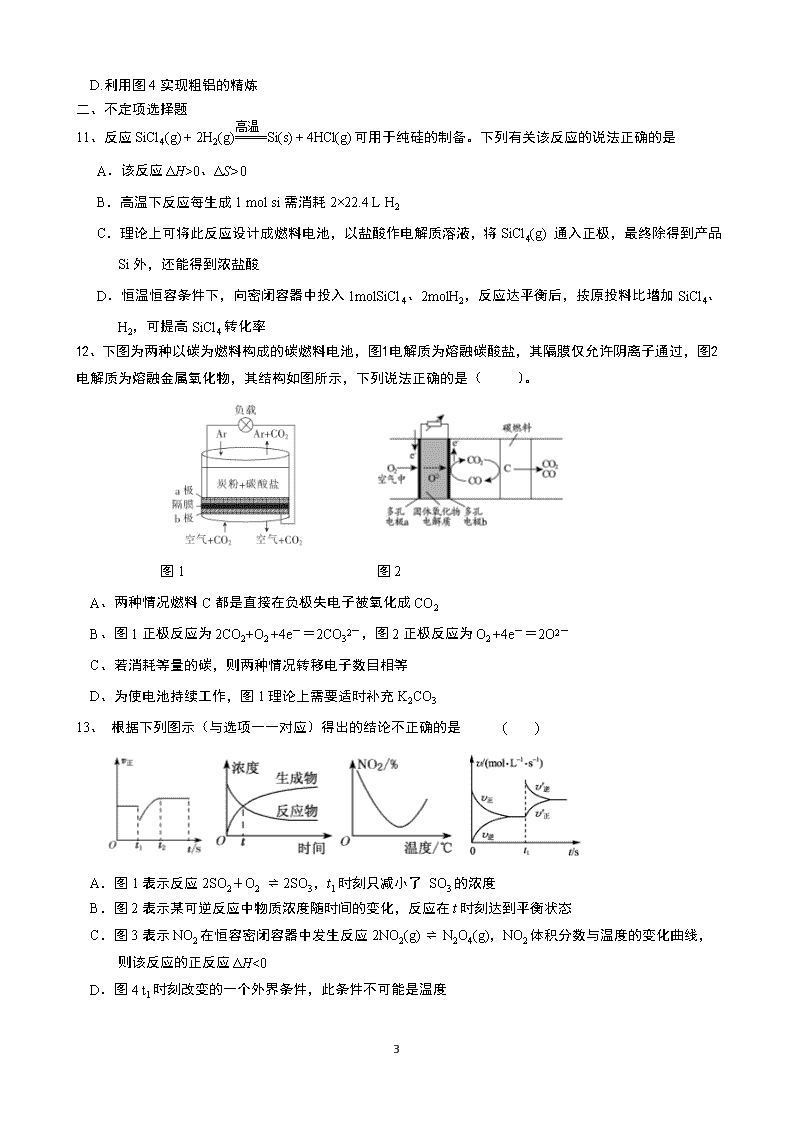
11、反应SiCl4(g) + 2H2(g)====Si(s) + 4HCl(g)可用于纯硅的制备。下列有关该反应的说法正确的是
A.该反应ΔH>0、ΔS>0
B.高温下反应每生成1 mol si需消耗2×22.4 L H2
C.理论上可将此反应设计成燃料电池,以盐酸作电解质溶液,将SiCl4(g) 通入正极,最终除得到产品
Si外,还能得到浓盐酸
D. 恒温恒容条件下,向密闭容器中投入1molSiCl4、2molH2,反应达平衡后,按原投料比增加SiCl4、
H2,可提高SiCl4转化率
12、下图为两种以碳为燃料构成的碳燃料电池,图1电解质为熔融碳酸盐,其隔膜仅允许阴离子通过,图2电解质为熔融金属氧化物,其结构如图所示,下列说法正确的是( )。
图1 图2
A、两种情况燃料C都是直接在负极失电子被氧化成CO2
B、图1正极反应为2CO2+O2 +4e-=2CO32-,图2正极反应为O2 +4e-=2O2-
C、若消耗等量的碳,则两种情况转移电子数目相等
D、为使电池持续工作,图1理论上需要适时补充K2CO3
13、 根据下列图示(与选项一一对应)得出的结论不正确的是 ( )
A.图1表示反应2SO2+O2 ⇌ 2SO3,t1时刻只减小了 SO3的浓度
B.图2表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
C.图3表示NO2在恒容密闭容器中发生反应2NO2(g) ⇌ N2O4(g),NO2体积分数与温度的变化曲线,
则该反应的正反应ΔH<0
D.图4 t1时刻改变的一个外界条件,此条件不可能是温度
9
14、温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是 ( )
A.增大H2O(g)浓度,平衡正向移动,平衡常数增大
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),
反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
15、工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。右图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是 ( )
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 mol CH3OH,
平衡向正方向移动
D. c点状态下再通入1 molCO和4 mol H2,
新平衡中CH3OH的体积分数增大
二、 非选择题
16、某实验小组研究可逆反应AsO+2I-+2H+ ⇌ AsO+I2+H2O时,设计了如图所示的原电池。
(1)电池工作时,盐桥中的阴离子向________(填“C1”或“C2”)极移动;
若向B池中滴加NaOH溶液,平衡向________(填“正反应”或“逆反应”)方向移动,
此时C2极的电极反应式为__________________________________。
(2)下列判断正确的是________(填字母)。
a.电流表指针为0时,该反应处于平衡状态
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态
c.AsO、AsO浓度相等时,该反应处于平衡状态
9
(3)该反应的平衡常数表达式为K=______________。
若升高温度,K增大,则正反应的ΔH________(填“>”“<”或“=”)0。
17、CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5 L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3 mol的H 2O,在催化剂存在和800 ℃的条件下加热,发生如下反应:CO(g)+H2O(g) ⇌ CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如下图:
(1)根据图上数据,该温度(800 ℃)下的平衡常数K=____________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______(填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3 mol的水蒸气,重新达到平衡后,H2O的转化率________(填“升高”“降低”或“不变”)。
(4)在催化剂和800 ℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09 mol/L;c(CO2)=c(H2)=0.13 mol/L,则此时正、逆反应速率的大小:v正____(填“>”“<”或“=”)v逆。
温度/℃
300
727
1 227
lg K
6.17
2.87
1.24
Ⅱ.还原法炼铅,包含反应PbO(s)+CO(g) ⇌ Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
(5)该反应的ΔH____(填“>”“<”或“=”)0。
(6)当lg K=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______;若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______(填“增大”“减小”或“不变”)。
18、汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
9
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ⇌2CO2(g) ΔH5;
2H2O(g)+4NO(g)+3O2(g) ⇌ 4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。
请解释ts后NO降解率下降的可能原因_____________________。
(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4) TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,
写出阳极的电极反应式 ____________________。
19、CO2/ HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1) CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入
9
H2生成HCOO−,其离子方程式为 ;
其他条件不变,HCO3−转化为HCOO−的转化率随温度的变化如图所示。反应温度在40℃~80℃范围内,
HCO3−催化加氢的转化率迅速上升,其主要原因是 。
(1) HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如题20图−2所示,两电极区间用允许K+、
H+通过的半透膜隔开。
①电池负极电极反应式为 ;
放电过程中需补充的物质A为 (填化学式)。
②如图所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其
反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下, HCOOH分解生成CO2和H2可能的反应机理如图所示。
①HCOOD催化释氢反应除生成CO2外,还生成 (填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点
是 。
20、 (1)利用如图装置电解制备LiOH,两电极均为惰性电极,电解液分别为LiOH和LiCl溶液。B极区
电解液为 溶液(填化学式),阳极电极反应式为 ,
电解过程中Li+向_____电极迁移(填“A”或“B”)。
A
B
电源
阳离子交换膜
H2
气体
(2)利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。电极A极反应式为:
9
(3)某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。电极A为 极,NO在其表面反应为: 。
(4)氯碱工业以电解精制饱和食盐水的方法制取氯气、二氧化氯、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。精制饱和食盐水从图中______(选填“a”“b”“c”或“d”,下同)位置补充,氢氧化钠溶液从图中______位置流出。电解时阳极除了产生氯气,还可能产生ClO2,请写出生成ClO2电极反应式 。
(5)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
______ ________。
21.氨气具有广泛用途,工业上利用反应N2(g)+3H2(g)⇄2NH3(g) ΔH<0合成氨,其基本合成过程如下:
(1)某小组为了探究外界条件对反应的影响,以c0 mol·L-1 H2参加合成氨的反应,在a、b两种条件下分别达到平衡,测得H2的浓度与反应时间的关系如图甲所示。请回答下列问题:
①a条件下,0~t0的平均反应速率v(N2)=________mol·L-1·min-1。
②相对a而言,b可能改变的条件是________________。
③在a条件下,t1时刻将容器容积压缩至原来的,t2时刻重新建立平衡状态。请在图中画出t1~t2时刻
c(H2)的变化曲线。
(2)某小组往一恒温恒压容器中充入9 mol N2和23 mol H2,模拟合成氨的反应,图乙为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60 MPa下达到平衡。
①此时N2的平衡分压为________MPa,H2的平衡分压为________MPa。(分压=总压×物质的量分数)
9
②列式计算此时的平衡常数Kp=________。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是
________________________________________________________________________
9