- 2021-04-14 发布 |
- 37.5 KB |
- 5页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习元素周期表及其应用学案
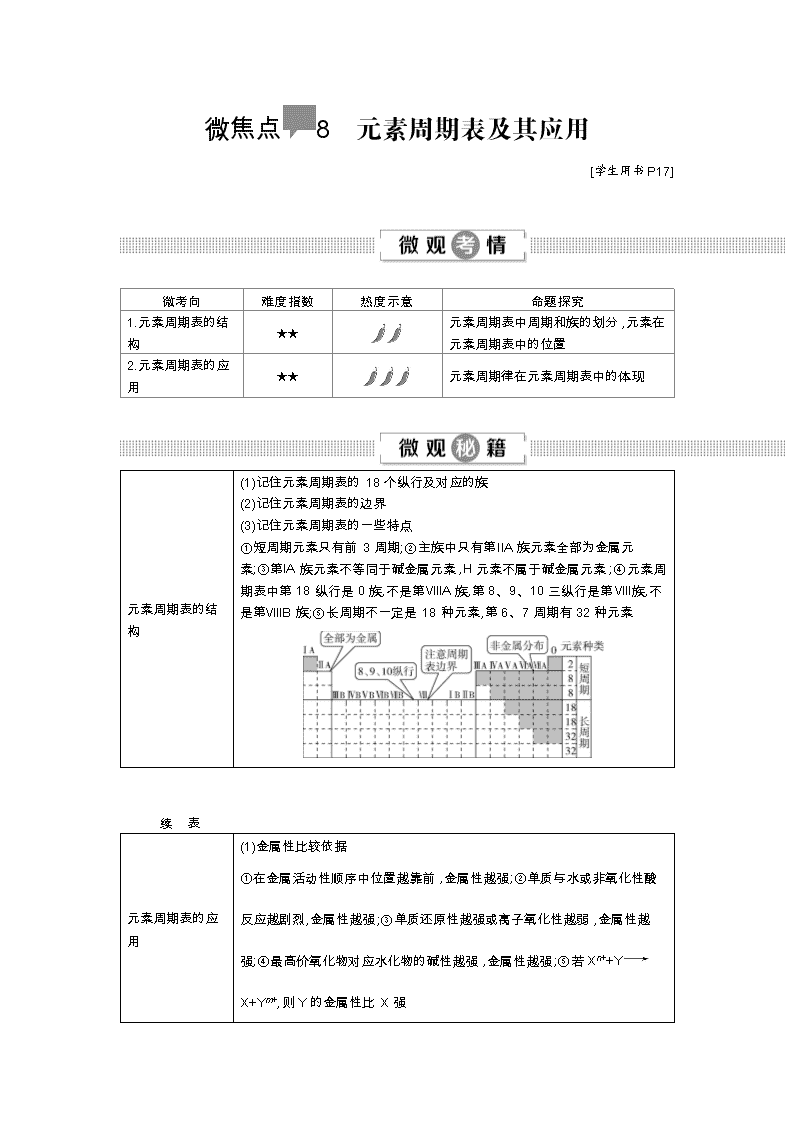
微焦点8 元素周期表及其应用 [学生用书P17] 微考向 难度指数 热度示意 命题探究 1.元素周期表的结构 ★★ 元素周期表中周期和族的划分,元素在元素周期表中的位置 2.元素周期表的应用 ★★ 元素周期律在元素周期表中的体现 元素周期表的结构 (1)记住元素周期表的18个纵行及对应的族 (2)记住元素周期表的边界 (3)记住元素周期表的一些特点 ①短周期元素只有前3周期;②主族中只有第ⅡA族元素全部为金属元素;③第ⅠA族元素不等同于碱金属元素,H元素不属于碱金属元素;④元素周期表中第18纵行是0族,不是第ⅧA族,第8、9、10三纵行是第Ⅷ族,不是第ⅧB族;⑤长周期不一定是18种元素,第6、7周期有32种元素 续 表 元素周期表的应用 (1)金属性比较依据 ①在金属活动性顺序中位置越靠前,金属性越强;②单质与水或非氧化性酸反应越剧烈,金属性越强;③单质还原性越强或离子氧化性越弱,金属性越强;④最高价氧化物对应水化物的碱性越强,金属性越强;⑤若Xn++YX+Ym+,则Y的金属性比X强 (2)非金属性比较依据 ①与H2化合越容易,气态氢化物越稳定,非金属性越强;②单质氧化性越强,阴离子还原性越弱,非金属性越强;③最高价氧化物对应水化物的酸性越强,非金属性越强;④An-+BBm-+A,则B的非金属性比A强 元素周期表的结构 [典例导考1](2017·4月选考,14)W、X、Y、Z四种短周期元素,它们在周期表中的位置如图所示,下列说法不正确的是( ) W X Y Z A.Z、Y、X的原子半径依次减小,非金属性依次降低 B.Z、Y、W的最高价氧化物对应水化物的酸性依次降低 C.WH4与Z元素的单质在一定条件下可能发生化学反应 D.W的位置是第2周期第ⅣA族 【审】 (1)看清题目要求:选择不正确的说法;(2)考查元素周期律在周期表中的应用。 【切】 根据题图可确定题中元素是在短周期右侧,考查对周期表知识的掌握。 【解】 (1)周期表最右边一列是零族元素,由此可确定W、X、Y、Z分别是碳、氧、硫、氯四种元素。(2)微粒半径大小比较主要看两个参数:①电子层数:一般来说,电子层数越多,半径越大。②核电荷数:电子层数相同时,核电荷数越大,半径反而越小。Y原子半径大于Z,且非金属性:X>Z>Y,A项错误。(3)最高价含氧酸的酸性强弱由元素的非金属性强弱决定。 【答】 A 【思】 微粒半径的判定方法,不仅仅适用于原子,对离子半径的判断照样适用。半径大小比较规律,可按“三看”规律来比较粒子半径的大小: “一看”电子层数:一般来说当电子层数不同时,电子层数越多,半径越大。 例如:r(Li)查看更多