- 2021-04-14 发布 |
- 37.5 KB |
- 18页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省南充高级中学2019-2020学年高一上学期期中考试试题(解析版)
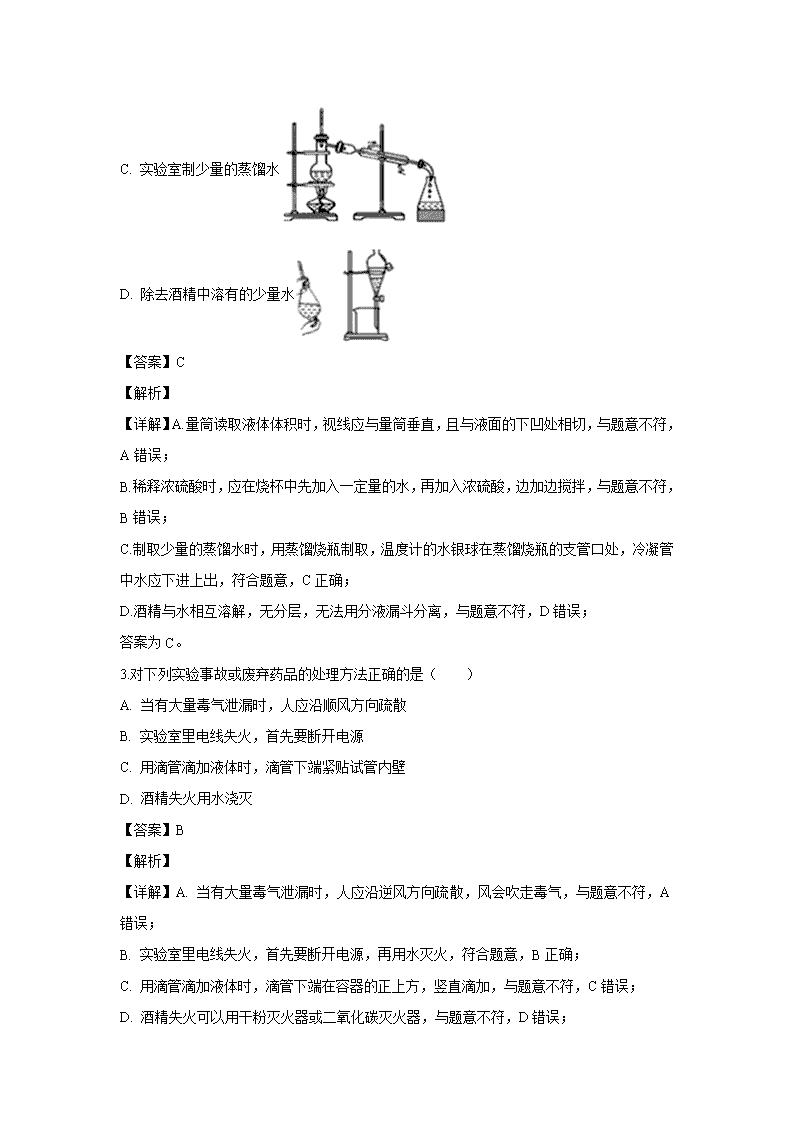
四川省南充高级中学2019-2020学年高一上学期期中考试试题 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 S-32 第Ⅰ卷(选择题 共50分) 一、选择题(下列各小题只有1个选项符合题目要求,每小题2分,共50分) 1.在盛装氢氧化钠固体和浓硫酸的试剂瓶上,都印有的警示标志是( ) A B C D 【答案】D 【解析】 【详解】氢氧化钠固体和浓硫酸均具有强腐蚀性。A.该警示标志为易燃液体,错误;B.该警示标志为剧毒品,错误;C.该警示标志为爆炸品,错误;D.该警示标志为腐蚀品,正确。 2.下列能达到实验目的的是( ) A. 读数 B. 稀释 C. 实验室制少量的蒸馏水 D. 除去酒精中溶有的少量水 【答案】C 【解析】 【详解】A.量筒读取液体体积时,视线应与量筒垂直,且与液面的下凹处相切,与题意不符,A错误; B.稀释浓硫酸时,应在烧杯中先加入一定量的水,再加入浓硫酸,边加边搅拌,与题意不符,B错误; C.制取少量的蒸馏水时,用蒸馏烧瓶制取,温度计的水银球在蒸馏烧瓶的支管口处,冷凝管中水应下进上出,符合题意,C正确; D.酒精与水相互溶解,无分层,无法用分液漏斗分离,与题意不符,D错误; 答案为C。 3.对下列实验事故或废弃药品的处理方法正确的是( ) A. 当有大量毒气泄漏时,人应沿顺风方向疏散 B. 实验室里电线失火,首先要断开电源 C. 用滴管滴加液体时,滴管下端紧贴试管内壁 D. 酒精失火用水浇灭 【答案】B 【解析】 【详解】A. 当有大量毒气泄漏时,人应沿逆风方向疏散,风会吹走毒气,与题意不符,A错误; B. 实验室里电线失火,首先要断开电源,再用水灭火,符合题意,B正确; C. 用滴管滴加液体时,滴管下端在容器的正上方,竖直滴加,与题意不符,C错误; D. 酒精失火可以用干粉灭火器或二氧化碳灭火器,与题意不符,D错误; 答案为B。 4.下列对实验过程的评价正确的是( ) A. 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 B. 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 C. 某无色溶液中滴入紫色石蕊试液显红色,说明该溶液一定是酸溶液 D. 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- 【答案】B 【解析】 【详解】A. 某固体中加入稀盐酸,产生了无色气体,无色气体可能是二氧化碳或二氧化硫等,则该固体可能是CaCO3,与题意不符,A错误; B. 向碘水中滴加CCl4,四氯化碳为无色液体,振荡静置后分层,CCl4层呈紫红色,碘溶解到四氯化碳中,说明可用CCl4从碘水中萃取碘,符合题意,B正确; C. 某无色溶液中滴入紫色石蕊试液显红色,说明该溶液显酸性,不一定是酸溶液,可以为强酸弱碱盐等,与题意不符,C错误; D. 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl-,与题意不符,D错误; 答案为B。 5.下列实验过程中出现的异常情况,其可能原因分析错误的是( ) 选项 异常情况 可能原因分析 A 蒸发结晶:蒸发皿破裂 将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 B 分液:分液漏斗中液体难以滴下 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 C 蒸馏:冷凝管破裂 冷凝管没有通水或先加热后通水 D 萃取:液体静置不分层 加入萃取剂的量较多 【答案】D 【解析】 【详解】A. 蒸发结晶时,由于蒸发皿局部温度过高导致蒸发皿破裂,可能原因为将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部,A正确; B. 分液漏斗外的气体不能进入,导致分液漏斗中的液体难以滴下,原因可能为没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐,B正确; C.蒸馏时,冷凝管的温度过高导致冷凝管破裂,原因可能为冷凝管没有通水或先加热后通水,C正确; D. 萃取时,两种液体相互溶解,导致静置不分层,D错误; 答案为D。 6.下列除去杂质的方法中,正确的是( ) 选项 物质(括号内为杂质) 去除杂质的方法 A NaCl(Na2CO3) 加入适量的Ca(OH)2溶液、过滤 B CaO(CaCO3) 加水、过滤 C Cu(Fe) 加过量CuSO4溶液、过滤 D H2SO4(HNO3) 加Ba(NO3)2溶液、过滤 【答案】C 【解析】 【详解】A. 加入适量的Ca(OH)2溶液除去NaCl中的碳酸钠时,会引入新的杂质离子,与题意不符,A错误; B. 加水除去碳酸钙时,氧化钙能与水反应,不能除杂,与题意不符,B错误; C. 杂质Fe可以硫酸铜反应生单质铜和硫酸亚铁溶液,符合题意,C正确; D. 除硝酸时,硝酸钡能与硫酸根离子反应,生成硝酸、硫酸钡,不能除杂,与题意不符,D错误; 答案为C。 7.下列叙述错误的是( ) ①摩尔是国际单位制中七个基本物理量之一; ②1 mol任何物质都含有约6.02×1023个原子;③6.02×1023就是阿伏加德罗常数;④氢原子的摩尔质量是1 g;⑤HCl的摩尔质量等于1 mol HCl分子的质量;⑥1 mol CO2中含有1 mol碳和2 mol氧。 A. ①②③ B. ②③④ C. ②③④⑥ D. 全部 【答案】D 【解析】 【详解】①中,摩尔不是物理量,是物质的量的单位,错误; ②中,1mol任何物质都含有约6.02×1023个结构粒子,不一定是原子,错误; ③中,阿伏加德罗常数是精确值,而6.02×1023mol-1为近似值,错误; ④中,H的摩尔质量为1g·mol-1,错误; ⑤中,摩尔质量与质量的单位不同,错误; ⑥中,1mol碳和2mol氧均未指明粒子种类,错误;符合题意的选项为D; 综上所述,本题选D。 8.设NA为阿伏加德罗常数的值,下列说法中正确的是( ) A. 标准状况下,18gH2O的体积约为22.4L B. 常温下,17gNH3中含有的电子数为10NA C. 1molCH4中含有的质子数约为6.02×1023 D. 1mol/LNaCl溶液中所含的Na+数为NA 【答案】B 【解析】 【详解】A. 标准状况下, H2O为非气态,无法用气体摩尔体积进行计算,与题意不符,A错误; B. 常温下,17gNH3的物质的量为1mol,含有的电子数为10NA,符合题意,B正确; C. 一个CH4分子中含有10个质子,则1molCH4中含有的质子数约为6.02×1024,与题意不符,C错误; D. 1mol/LNaCl溶液中未给定溶液体积,则无法确定含的Na+数目,与题意不符,D错误; 答案为B。 9.标准状况下,体积为1 L密闭容器中恰好可盛放n个N2分子和m个H2分子,则阿伏加德罗常数的值可近似表示为( ) A. 22.4(m+n) B. 22.4×6.02×1023(m+n) C. m+n D. 22.4(m+n)/(6.02×1023) 【答案】A 【解析】在标准状况下,1L氢气和氮气混合气体的物质的量为 = mol。所以 mol×NA=m+n,解得:NA=22.4(m+n)mol-1。答案选A。 10.下列有关气体体积的叙述中,正确的是( ) A. 不同的气体,若体积不同,则它们所含的分子数也不同 B. 一定温度和压强下,气体体积由构成气体的分子数决定 C. 一定温度和压强下,气体体积由构成气体的分子大小决定 D. 气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L 【答案】B 【解析】 【详解】A、根据分子数N=NAV/Vm可以知道,不同的气体,当体积不同时,因为气体所处的状态的气体摩尔体积未知,故分子数N可能相同,故A错误; B、一定温度和压强下,气体摩尔体积的数值确定,而气体体积V=nVm,故此时气体体积的大小取决与气体的物质的量即分子个数,故B正确; C、由于气体分子在很大的空间运动,分子本身相对于分子间隔很小,可以忽略不计,所以温度压强确定,则分子间距离确定,故气体摩尔体积的数值确定,而气体体积V=nVm,故此时气体体积的大小取决于气体的物质的量即分子个数,故C错误; D、气体摩尔体积是指单位物质的量的气体所占据的体积,数值和气体所处的状态有关,不一定为22.4L/mol,故D错误; 综上所述,本题选B。 11.等质量的CO和N2,下列叙述不正确的是( ) A. 密度一定相同 B. 分子数一定相同 C. 原子数一定相同 D. 物质的量一定相同 【答案】A 【解析】 【详解】A.密度ρ=M/Vm,由于气体摩尔体积不一定相同,则二者密度不一定相同,A错误; B.CO和N2的摩尔质量均为28g/mol,根据N=nNA=mNA/M可知,二者含有的分子数一定相同,B正确; C.CO和N2为双原子分子,根据选项B可知二者分子数相同,则含有原子数也一定相同,C正确; D.CO和N2的摩尔质量均为28g/mol,根据n=m/M可知二者的物质的量一定相等,D正确; 答案选A。 12.实验室有一瓶溶液,标签上标有溶液0.2mol/L BaCl2溶液的字样,下面对该溶液的叙述正确的是( ) A. 配制500mL该溶液,可将0.1mol BaCl2溶于500mL水中 B. Ba2+和Cl-的物质的量浓度都是0.2mol∙L-1 C. 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2mol∙L-1 D. 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.1mol∙L-1 【答案】C 【解析】 【详解】A.溶于500mL水为溶剂的体积,应为0.1 mol BaCl2溶于水配制500mL溶液,其浓度为0.2mol•L-1,A错误; B.由BaCl2 0.2mol•L-1及物质构成可知,Ba2+和Cl-的物质的量浓度分别为0.2 mol•L-1、0.4 mol•L-1,B错误; C.Cl-的物质的量浓度为0.4mol/L,稀释前后离子的物质的量不变,则将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.2mol∙L-1,C正确; D.溶液具有均一性,则从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.2 mol•L-1,D错误; 故合理选项是C。 13.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的Na+的物质的量浓度(单位:mol·L-1)为( ) A. (y-2x)/a B. (y-x)/a C. (2y-4x)/a D. (2y-2x)/a 【答案】C 【解析】试题分析:第一份溶液中发生的反应为BaCl2+H2SO4=BaSO4↓+2HCl,根据BaCl2~H2SO4知,n(H2SO4)=n(BaCl2)=xmol;第二份溶液中发生的反应为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2、NaCl+AgNO3=AgCl↓+NaNO3,根据BaCl2~2AgNO3知,和BaCl2反应的n(AgNO3)=2n(BaCl2)=2xmol,则剩余AgNO3和NaCl反应生成AgCl,根据NaCl~AgNO3知,和NaCl反应的硝酸银物质的量n(AgNO3 )=n(NaCl)=ymol-2xmol,则两种溶液中NaCl的物质的量为2ymol-4xmol,根据Na原子守恒知,n(Na+)=n(NaCl)=2ymol-4xmol,则原来混合溶液中c(Na+)==mol/L,故选C。 14.下列各组物质,按混合物、单质、化合物顺序排列的是( ) A. 碘酒、液态氧、烧碱 B. 熟石灰、白磷、生石灰 C. 氯化氢、钠、干冰 D. 胆矾、氮气、空气 【答案】A 【解析】 【详解】A. 碘酒为混合物,液态氧为单质,烧碱为化合物,符合题意,A正确; B. 熟石灰、生石灰均为化合物,白磷为单质,与题意不符,B错误; C. 氯化氢、干冰为化合物,钠为单质,与题意不符,C错误; D. 胆矾为化合物,氮气为单质,空气为混合物,与题意不符,D错误; 答案为A。 15.下列说法正确的是( ) A. 食盐溶液静置会分层,上层比下层咸 B. “冰水混合物”是一种分散系 C. 黄河入海口处三角洲的形成与胶体性质有关 D. 电泳现象说明胶体带电 【答案】C 【解析】 【详解】A.食盐易溶于水,静止后不分层,故A错误; B.冰、水均为H2O,冰水混合属于纯净物,而分散系均为混合物,故B错误; C.江河中的泥沙属于胶体分散系,江河入海口三角洲的形成与胶体的聚沉性质有关,故C 正确; D.胶体本身不带电,但是胶体能吸附带电的离子形成带电的胶体微粒,所以能发生电泳, 故D错误; 综上所述,本题选C。 16.下列有关胶体的说法中,不正确的是( ) A. 胶体、溶液、浊液的分类依据是分散质微粒直径大小 B. “卤水点豆腐”、“不同牌子的墨水不能混用”都与胶体的聚沉有关 C. 从颜色上无法区别氯化铁溶液和氢氧化铁胶体 D. 可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体 【答案】C 【解析】 【详解】A.按照分散质微粒直径的大小可以将分散系分成:溶液、胶体、浊液,故A正确; B.豆浆分散系属于胶体,加入可溶性氯化镁电解质发生聚沉;墨水分散系属于胶体,不同牌子的墨水混用易发生聚沉,故B正确; C.氯化铁溶液为黄色,氢氧化铁胶体为红褐色,从颜色上可以区别,故C错误; D.丁达尔效应是胶体特有的性质,常用来区别胶体和溶液,故D正确; 综上所述,本题选C。 17.下列物质中,能够导电的电解质是( ) A. Cu B. 熔融的MgCl2 C. 酒精 D. 蔗糖 【答案】B 【解析】 【分析】溶于水或熔融状态下能够导电的化合物是电解质,含有自由移动电子或离子的物质可以导电,据此判断。 【详解】A.Cu能导电,但Cu是单质不是化合物,所以Cu不是电解质也不是非电解质,故A错误; B.熔融的MgCl2中含有自由移动的镁离子和氯离子,所以能导电,熔融的MgCl2是能够导电的电解质,故B正确; C.酒精中没有自由移动的阴阳离子,所以不能导电,酒精是非电解质,故C错误; D.蔗糖中没有自由移动的阴阳离子,所以不能导电,蔗糖是非电解质,故D错误; 故答案选B。 18.实验过程中,下列溶液的导电能力变化不大的是( ) A. 醋酸溶液中滴入氨水至过量 B. Ba(OH)2溶液中滴入H2SO4溶液至过量 C. 向自来水中加入少量NaOH固体 D. NH4Cl溶液中加入NaOH固体至恰好反应 【答案】D 【解析】 【详解】A. 醋酸为弱电解质,溶液中滴入氨水后,与醋酸反应生成醋酸铵,醋酸铵为强电解质,溶液的导电性增强,与题意不符,A错误; B. Ba(OH)2溶液中滴入H2SO4溶液至过量,氢氧化钡为强电解质,滴入硫酸,反应生成硫酸钡和水,导电能力降低,与题意不符,B错误; C. 自来水为弱电解质,向自来水中加入少量NaOH固体,溶液的导电能力增强,与题意不符,C错误; D. NH4Cl为强电解质,溶液中加入NaOH固体至恰好反应,发生反应生成一水合氨和氯化钠,溶液的导电能力几乎不变,符合题意,D正确; 答案为D。 19.下列电离方程式的书写,正确的是( ) A. NH3·H2O==NH4+ + OH― B. H2SO4==2H+ + SO42― C. CuCl2== Cu2+ + Cl― D. NaHCO3==Na+ + H+ + CO32― 【答案】B 【解析】 【详解】A. NH3·H2O属于弱电解质,故电离方程式为:NH3·H2ONH4+ + OH-,错误;B. H2SO4属于强电解质,能完全电离,正确;C.电离方程式中原子以及电荷不守恒,其电离方程式应为:CuCl2== Cu2+ + 2Cl-,错误;D. NaHCO3属于盐类,能完全电离出Na+和HCO3-,而HCO3-不能完全电离出H+和CO32-,其电离方程式为:NaHCO3==Na+ + HCO3-,错误。 20.在下列各溶液中,离子一定能大量共存的是( ) A. 强碱性溶液中:K+、Mg2+、Cl−、SO42− B. 室温下,能使紫色石蕊溶液变红的溶液中:Na+、Fe3+、NO3−、SO42− C. 含有0.1 mol/L Ca2+的溶液中:Na+、K+、CO32−、Cl− D. 在无色透明溶液中:K+、Cu2+、NO3−、SO42− 【答案】B 【解析】 【分析】A、强碱性溶液中镁离子会沉淀; B、能使紫色石蕊溶液变红的溶液呈酸性,Na+、Fe3+、NO3−、SO42−不反应; C、碳酸钙难溶; D、铜离子呈蓝色; 【详解】A、强碱性溶液中镁离子会沉淀,故A错误; B、能使紫色石蕊溶液变红的溶液呈酸性,Na+、Fe3+、NO3−、SO42−不反应,故B正确; C、碳酸钙难溶,故C错误; D、铜离子呈蓝色,故D错误; 故选B。 21.下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( ) A. Cu(OH)2+HCl; Cu(OH)2+CH3COOH B. CaCO3+H2SO4; Na2CO3+HCl C. H2SO4+NaOH; H2SO4+Ba(OH)2 D. BaCl2+H2SO4; Ba(OH)2+Na2SO4 【答案】D 【解析】A、HCl为强电解质,而CH3COOH为弱电解质,写分子式,故A错误;B、 CaCO3难溶,写化学式,Na2CO3是可溶性强电解质,故B错误;C、H2SO4+NaOH;H2SO4+Ba(OH)2后者还生成BaSO4沉淀,故C错误;D、均可用Ba2++SO42―=BaSO4↓,故D正确;故选D。 22.下列离子方程式正确的是( ) A. 碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+HSO4-=SO42-+H2O+CO2↑ B. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++HCO3-+OH-=CaCO3↓+H2O C. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2O D. 用澄清石灰水检验二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O 【答案】D 【解析】 【详解】A. 碳酸氢钠溶液与硫酸氢钠溶液反应,硫酸氢钠为强电解质,溶液中完全电离成钠离子、氢离子和硫酸根离子,二者反应的离子方程式为HCO3-+H+=H2O+CO2↑,A错误; B. 向碳酸氢钙溶液中加入过量氢氧化钠,碳酸氢钙中钙离子与碳酸氢根离子的比例为1:2,则方程式为Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,B错误; C. 稀硫酸滴在铜片上,铜与稀硫酸不反应,C错误; D. 用澄清石灰水检验二氧化碳,澄清的石灰水变浑浊,离子方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,D正确; 答案为D。 23.某溶液中,若忽略水的电离,只含有下表中所示的四种离子,推测X离子及其个数b可能为( ) 离子 Na+ Al3+ Cl- X 个数 3a 2a a b A. OH-、8a B. NO3-、4a C. SO42-、4a D. SO42-、8a 【答案】C 【解析】 【详解】A. OH-与Al3+不能共存,与题意不符,A错误; B. NO3-可以共存,根据溶液呈电中性,N(NO3-)=8a,与题意不符,B错误; C. SO42-可以共存,根据溶液呈电中性,N(SO42-)=4a,符合题意,C正确; D. SO42-可以共存,根据溶液呈电中性,N(SO42-)=4a,与题意不符,D错误; 答案为C。 24.有体积相同的两份营养液其配方如下,试判断两份营养液中各离子浓度的关系是( ) KCl K2SO4 ZnSO4 ZnCl2 第一份 0.3mol 0.2mol 0.1mol — 第二份 0.1mol 0.3mol — 0.1mol A. 仅c(K+)相同 B. 仅c(Cl-)相同 C. 完全相同 D. 完全不同 【答案】C 【解析】 【详解】第一份溶液中,n(K+)=0.3+0.2×2=0.7mol,n(Zn2+)=0.1mol,n(SO42-)=0.2+0.1=0.3mol,n(Cl-)=0.3mol。第二份溶液中,n(K+)=0.1+0.3×2=0.7mol,n(Zn2+)=0.1mol,n(SO42-)=0.3mol,n(Cl-)=0.1mol+0.2mol=0.3mol。两溶液体积相同,所以两溶液中的离子浓度完全相同。故选C。 25.某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下: 步骤 操作 现象 (1) 用紫色石蕊试液检验 溶液变红 (2) 向溶液中滴加BaCl2和稀HC1 有白色沉淀生成 (3) 将(2)中所得混合物过滤,向滤液中加入AgN03溶液 和稀HN03 有白色沉淀生成 下列结论正确的是( ) A. 肯定含有的离子是②③⑥ B. 该实验无法确定是否含有③ C. 可能含有的离子是①③⑦ D. 肯定没有的离子是④⑤,可能含有的离子是② 【答案】B 【解析】 【分析】无色澄清溶液,可以知道溶液里没有Cu2+; (Ⅰ)用紫色石蕊试液检验,溶液变红,说明溶液显酸性,溶液里不含CO32-和HCO3-; (Ⅱ)向溶液中滴加BaCl2和稀HCl,有白色沉淀生成,此沉淀为BaSO4,说明溶液里有SO42-; (Ⅲ)将(Ⅱ)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3,此沉淀为AgCl,但无法说明溶液里有Cl-,因实验(2)中滴加了稀盐酸和氯化钡溶液,引入了Cl-;据以上分析解答。 【详解】无色澄清溶液,可以知道溶液里没有Cu2+; (Ⅰ)用紫色石蕊试液检验,溶液变红,说明溶液显酸性,溶液里不含CO32-和HCO3-; (Ⅱ)向溶液中滴加BaCl2和稀HCl,有白色沉淀生成,此沉淀为BaSO4,说明溶液里有SO42-; (Ⅲ)将(Ⅱ)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3,此沉淀为AgCl,但无法说明溶液里有Cl-,因实验(2)中滴加了稀盐酸和氯化钡溶液,引入了Cl-; 由以上分析可以知道溶液里一定存在②SO42-、⑥H+,一定不存在④HCO3-、⑤CO32-、⑦Cu2+,可能存在①Na+、③Cl-,所以选项B正确; 综上所述,本题选B。 第Ⅱ卷(非选择题 共50分) 二、填空题 26.回答下列问题。 (1)现有下列物质:①CO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水 请用序号回答下列问题:能导电的是___。属于电解质的是___。属于非电解质的是___。 (2)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为___mol/L。 (3)1.204×1024个H2SO4分子的物质的量为___mol,共含___个氢原子。将上述H2SO4溶于水配成600mL溶液,再加水稀释到1000mL,稀释后溶液的物质的量浓度为___mol/L。 (4)15.6gNa2R2中含0.4mol的Na+,则R的相对原子质量是___。 【答案】(1). ④⑥ (2). ②④⑤ (3). ①③ (4). 0.3mol/L (5). 2 (6). 2.408×1024(4NA) (7). 2 (8). 16 【解析】 【详解】(1)①CO2液态时不导电,化合物,为非电解质; ②液态氯化氢溶于水后导电,化合物,为电解质; ③CH4溶于水和液态时均不导电,化合物,为非电解质; ④熔融NaOH能导电,化合物,为电解质; ⑤NH4Cl固体不导电,溶于水能导电,化合物,为电解质; ⑥氨水为混合物,既不是电解质,也不是非电解质; 则能导电的是④⑥;属于电解质的为②④⑤;属于非电解质的为①③; (2)根据溶液呈电中性, c(Fe3+)3+ c(K+)1= c(SO42-)2,则c(K+)=0.3mol/L; (3)n(H2SO4)=N/NA=1.204×1024/6.02×1023=2mol;含有4mol氢原子,即氢原子个数为2.408×1024(4NA);c(H2SO4)=n/V=2mol/1L=2mol/L; (4)一个Na2R2中含2个Na+,含0.4mol Na+的Na2R2的物质的量为0.2mol,则M(Na2R2)=m/n=15.6g/0.2mol=78g/mol,则R的摩尔质量为(78 g/mol -23 g/mol×2)/2=16g/mol。 27.为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量): 称取粗盐 滤液精盐 (1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___。 (2)在第③步操作中,选择的除杂剂NaOH不能用KOH代替,理由是___。 (3)第④步中加入过量的Na2CO3的目的是___。 (4)在第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、___(填化学式)。 (5)写出第⑥步操作反应离子方程式:___、___。 【答案】(1). 加快粗盐溶解 (2). 会引入新杂质KCl (3). 除去Ca2+和Ba2+ (4). CaCO3、BaCO3 (5). OH-+H+=H2O (6). 2H++CO32-=H2O+CO2↑ 【解析】 【分析】(1)溶质溶解时,用玻璃棒搅拌可加速固体的溶解; (2)用KOH时会使溶液中增加新的杂质钾离子; (3)溶液中的钙离子、钡离子与Na2CO3生成碳酸钡、碳酸钙; (4)泥沙、氢氧化镁、硫酸钡、碳酸钙及碳酸镁均不溶于水; (5)加入盐酸时,与溶液中过量的氢氧化钠、碳酸钠反应。 【详解】(1)溶质溶解时,用玻璃棒搅拌可加速固体的溶解; (2)用KOH时会使溶液中增加新的杂质钾离子; (3)操作步骤③中,溶液中的阳离子有钙离子、钡离子,加入过量的Na2CO3可生成碳酸钡、碳酸钙; (4)粗盐中的泥沙、镁离子与氢氧根离子生产的氢氧化镁、硫酸钡及碳酸钙、碳酸镁均不溶于水; (5)加入盐酸时,与溶液中过量的氢氧化钠、碳酸钠反应的离子方程式为OH-+H+=H2O;2H++CO32-=H2O+CO2↑。 28.Ⅰ.简述氢氧化铁胶体的制备方法___。 Ⅱ.某化学实验需要480mL0.10mol·L-1Na2CO3溶液,某同学选用Na2CO3·10H2O晶体进行配制,简要回答下列问题: (1)实验时要用到的仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___。 (2)需用托盘天平称取Na2CO3·10H2O晶体的质量为___g。 (3)该实验的正确操作顺序是___(填字母代号)。 A.用托盘天平称取Na2CO3·10H2O晶体 B.上下颠倒摇匀 C.用胶头滴管加水至刻度线 D.洗涤所用仪器并将洗涤液转移进容量瓶 E.将所称取的晶体溶于蒸馏水并冷却至室温 F.将溶液转入容量瓶 (4)配制过程中,下列操作对所配溶液的浓度有什么影响,完成填空。 a.Na2CO3·10H2O晶体不纯,混有NaCl b.用“左码右物”的称量方法称量晶体 c.容量瓶中洗净后未干燥,残留少量水 d.未冷却至室温就转移定容 e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出 f.定容时,俯视刻度线 会引起所配溶液的浓度偏大的有___,无影响的有___(填序号)。 (5)向200mL所配的0.10mol·L-1Na2CO3溶液中加入20mL12.25%稀H2SO4(ρ=1.0g/cm3),理论上能收集到标准状况下的气体___mL。 【答案】(1). 向沸水中逐滴加入几滴饱和氯化铁溶液,继续加热至溶液呈红褐色 (2). 500mL容量瓶 (3). 14.3 (4). A E F D C B (5). df (6). c (7). 448 【解析】 【详解】Ⅰ.通常向沸水中逐滴加入几滴饱和氯化铁溶液,继续加热至溶液呈红褐色时制备氢氧化铁胶体; Ⅱ.(1)配制480mL溶液只能选用500mL的容量瓶,还需要托盘天平、量筒、烧杯、玻璃棒、胶头滴管等仪器; (2)配制500mL0.10mol·L-1Na2CO3溶液,需要0.05mol Na2CO3,即0.05mol Na2CO3·10H2O晶体,则质量为0.05mol×286g/mol=14.3g; (3)实验时的顺序为计算、称量、溶解、移液、洗涤、定容、摇匀,则正确顺序为AEFDCB; (4)a.Na2CO3·10H2O晶体不纯,混有NaCl,导致碳酸钠固体的质量减小,则碳酸钠的浓度偏小; b.固体读数为砝码+游码=14.3g,用“左码右物”的称量方法称量晶体,则晶体的质量为13.7g,碳酸钠固体的质量减小,则碳酸钠的浓度偏小; c.容量瓶中洗净后未干燥,残留少量水,溶质的质量及溶液的体积不变,则对浓度无影响; d.未冷却至室温就转移定容,根据热胀冷缩,溶液的体积偏小,导致浓度偏大; e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出,吸出的溶液中含有少量的溶质,导致溶质的质量偏小,浓度偏低; f.定容时,俯视刻度线,导致溶液的体积偏小,则浓度偏高; 综上所述,会引起所配溶液的浓度偏大df;无影响的c; (5)12.25%稀H2SO4的浓度c=1000×ρ×ω/M=(1000×1.0×12.25%/98)mol/L=1.25mol/L,20mL 溶液中硫酸的物质的量为0.025mol,200mL0.10mol·L-1Na2CO3溶液中碳酸钠的物质的量为0.02mol,硫酸过量,则生成二氧化碳的物质的量为0.02mol即标况下的体积为448mL。 29.现有三种物质A、B、C,其中有一种是酸,一种是碱,一种是盐,溶于水后电离,可以产生表中的离子: 阳离子 Na+ H+ Ba2+ 阴离子 OH- CO32- SO42- 为鉴别它们,分别完成以下实验,其结果如下: ①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应; ②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。 (1)根据①②实验事实可推断它们的化学式为:A___;B___;C___。 (2)写出下列反应的离子方程式: A溶液与C溶液反应:___; B与C反应至溶液呈中性:___。 (3)鉴别B溶液中阴离子的实验方法是___。 【答案】(1). Na2CO3 (2). H2SO4 (3). Ba(OH)2 (4). Ba2++CO32-=BaCO3↓ (5). 2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ (6). 取少量B的溶液于试管中,先加入盐酸,再加入BaCl2溶液,若生成白色沉淀,则溶液中含有SO42- 【解析】 【分析】Ba2+与CO32-、SO42-不能大量共存,可与氢氧根离子构成氢氧化钡,氢氧化钡为碱;H+与CO32-不能大量共存,可与硫酸根离子形成硫酸,则盐为碳酸钠;①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应,则X为二氧化碳,C为氢氧化钡,E为碳酸钡,B为硫酸,则A为碳酸钠。 【详解】(1)分析可知A、B、C分别为Na2CO3、H2SO4、Ba(OH)2; (2)碳酸钠与硫酸钡反应生成硫酸钡沉淀,离子方程式为Ba2++CO32-=BaCO3↓; 氢氧化钡与硫酸反应至溶液呈中性时,二者物质的量为1:1,生成硫酸钡沉淀和水,离子方程式为2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓。 (3)检验硫酸根离子时,应排除碳酸根及亚硫酸根离子的干扰,则应为取少量B的溶液于试管中,先加入盐酸,再加入BaCl2溶液,若生成白色沉淀,则溶液中含有SO42-。查看更多