- 2021-04-14 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江苏省马坝高级中学高二下学期期中考试化学试题 Word版
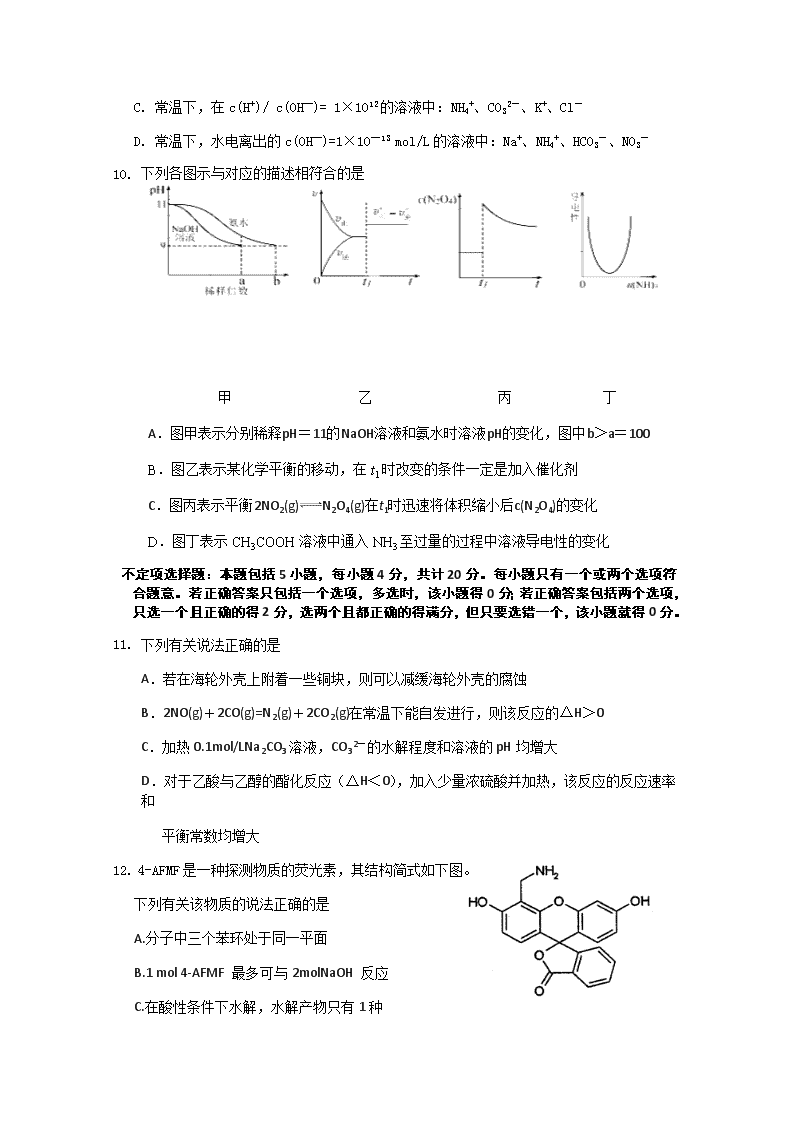
江苏省马坝高级中学2018—2019学年度第二学期期中考试 高二化学试题 可能用到的相对原子质量:H—1;;O—16;C—12;N—14;Na—23; 第Ⅰ卷(选择题 共50分) 单项选择题:本题包括10小题,每小题3分,共计30分。每小题只有一个选项符合题意。 1. 水是生命之源,生产生活都离不开水。下列有关说法正确的是( ) A. 水的电离是放热过程 B. 纯水的pH一定等于7 C.pH=4的盐酸和NH4Cl溶液中水的电离程度相同 D. 电解水制H2和O2时,可以向水中加入少量Na2SO4以增强溶液导电性 2. 下列有关氯元素及其化合物的表示正确的是( ) A.质子数为17、中子数为20的氯原子: B.氯离子(Cl-)的结构示意图: C.氯分子的电子式: D.对硝基甲苯的结构简式: 3. 下列事实不能用勒夏特列原理解释的是 A.实验室用排饱和食盐水方法收集氯气 B.氯水应保存在棕色细口瓶中,并处冷暗避光处保存 C.PH=3的醋酸溶液中加入CH3COONH4溶液,溶液PH增大 D.将铜粉和锌粉混合后加入稀硫酸中,产生气体的速率比不加铜粉快 4. 下列热化学方程式或说法正确的是 A.同温同压下,反应 H2(g)+Cl2(g) === 2HCl(g)在光照和点燃条件下的△H 不同 B.已知 H2(g)+F2(g)===2HF(g) △H=-270 kJ·mol-1,则 1 mol H2与 1 mol F2 反应生成 2 mol 液态氟化氢时放热大于 270 kJ C.甲烷的标准燃烧热为△H=-890.3kJ·mol-1,则其燃烧的热化学方程式可表示为: CH4(g) +2O2(g)===CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1 D.500℃、30MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成 NH3, 放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g)2NH3(g) △H=-38.6 kJ·mol-1 5. 用下列实验装置进行相应实验,装置及操作正确、且能达到实验目的是( ) A.甲:量取20.00mLKMnO4溶液 B. 乙:验证铁发生吸氧腐蚀 C. 丙:铁制品表面镀锌 D. 丁:设计铜锌原电池 6. 下列离子方程式中,正确的是 A.用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑ B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+ C.氯气通入冷水中:Cl2 +H2O Cl- +ClO- +2H+ D.Na2S溶液中S2-的水解:S2—+2H2O==H2S+2OH— 7. 在给定条件下,下列选项所示的物质间转化均能实现的是( ) A. B. Fe2O3FeCl3(aq)无水FeCl3 C. D. AgNO3(aq)[Ag(NH3)2]OH(aq)Ag 8. 一种微生物燃料电池如图所示,下列关于该电池的说法正确的是 A. a电极发生还原反应 B. H+由右室通过质子交换膜进入左室 C. b电极反应式为2NO3-+10e-+12H+N2↑+6H2O D. 电池工作时,电流由a电极沿导线流向b电极 9. 在给定环境中,下列各组离子一定大量共存的是 A . 甲基橙呈红色的溶液中:K+、Na+、S2-、AlO2- ]B=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3- C. 常温下,在c(H+)/ c(OH—)= 1×1012的溶液中:NH4+、CO32-、K+、Cl- D. 常温下,水电离出的c(OH—)=1×10—13 mol/L的溶液中:Na+、NH4+、HCO3-、NO3- 10. 下列各图示与对应的描述相符合的是 甲 乙 丙 丁 A.图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100 B.图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂 C.图丙表示平衡2NO2(g)N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 D.图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11. 下列有关说法正确的是 A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大 D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和 平衡常数均增大 12. 4-AFMF是一种探测物质的荧光素,其结构简式如下图。 下列有关该物质的说法正确的是 A.分子中三个苯环处于同一平面 B.1 mol 4-AFMF 最多可与2molNaOH 反应 C.在酸性条件下水解,水解产物只有1种 D.能与溴水、FeCl3溶液及稀硫酸发生反应 13. 根据下列实验操作和现象所得到的结论正确的是( ) 选项 实验操作和现象 实验结论 A 室温下,物质的量浓度相同的Na2CO3溶液和NaCN溶液,Na2CO3溶液的pH大于NaCN溶液 酸性:HCN>H2CO3 B 将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液,酸性KMnO4溶液褪色。 产生了乙烯 C 室温下,将pH相同的HA与HB的稀溶液分别加水稀释相同的倍数,所得溶液的pH:pH(HA)>pH(HB) 酸性:HA>HB D 将蔗糖和硫酸的混合液加热,再向其中加入新制的Cu(OH)2悬浊液,加热煮沸,无砖红色沉淀 蔗糖未水解 14.室温下,下列溶液中微粒的物质的量浓度关系正确的是 A.新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-) B.pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) C.0.1mol·L-1HCl溶液与0.2 mol·L-1 NH3·H2O溶液等体积混合pH>7: c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-) D.0.1mol·L-1K2C2O4溶液与0.2 mol·L-1KHC2O4溶液等体积混合: 4c(K+)=3[c(C2O42-)+c(HC2O4-)+c(H2C2O4) ] 15. —定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应: 2NO(g)+2CO(g) N2(g)+2CO2(g) 各容器中起始物质的量浓度与反应温度如下表所示, 反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。 容器 温度/℃ 起始物质的量浓度/mol·L-1 NO(g) CO(g) N2 CO2 甲 T1 0.10 0.10 0 0 乙 T1 0 0 0.10 0.20 丙 T2 0.10 0.10 0 0 下列说法正确的是 A.该反应的正反应为吸热反应 B.乙容器中反应达到平衡时,N2的转化率大于40% C.达到平衡时,乙容器中的压强一定大于甲容器的2倍 D.丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)>v(逆) 第Ⅱ(非选择题 共70分) 16(14分)以硅孔雀石[主要成分为 CuCO3•Cu(OH)2、CuSiO3•2H2O,含 SiO2、FeCO3、Fe2O3 等杂质]为原料制备CuCl2的工艺流程如下: 已知:SOCl2+H2O SO2↑+2HCl↑ ⑴“酸浸”时盐酸与CuCO3•Cu(OH)2反应的化学方程式为 ▲ , 为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反 应温度;③ ▲ ; ⑵滤渣2的主要成分为 ▲ (填化学式); ⑶“氧化”时发生反应的离子方程式为 ▲ ; ⑷试剂X的作用是调节溶液的PH,试剂X可以是 ▲ ; A.CuSO4 B.Cu2(OH)2CO3 C.NaOH D.CuO “调pH”时,PH不能过高,其原因是 ▲ ; ⑸“加热脱水”时,加入SOCl2的目的是 ▲ 。 17(10分)化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成: ⑴D中的含氧官能团名称为 ▲ ▲ (写两种)。 ⑵F→G的反应类型为 ▲ 。 ⑶写出同时满足下列条件的C的一种同分异构体的结构简式 ▲ 。 ①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应; ③分子中只有4种不同化学环境的氢。 ⑷E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式 ▲ 。 ⑸G→H的反应方程式为 ▲ 。 18(14分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为: 4NH4++6HCHO===3H++6H2O+(CH2)6N4H+[(滴定时,1 mol (CH2)6N4H+与1 mol H+相当)], 然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验: 步骤Ⅰ:称取样品1.500 g。 步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。 步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇 匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。 按上述操作方法再重复2次。 ⑴根据步骤Ⅲ填空: ①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分 数____▲____(填“偏高”、“偏低”或“无影响”)。 ②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积___▲___(填“偏 大”、“偏小”或“无影响”)。 ③滴定时边滴边摇动锥形瓶,眼睛应观察____________▲______________。 A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化 ④滴定达到终点时的现象为 ▲ 。 ⑤滴定结束时俯视滴定管读数,则测得样品中氮的质量分数___▲__(填“偏高”、“偏低” 或“无影响”)。 ⑵ 滴定结果如下表所示: 滴定次数 待测溶液的体积/mL 标准溶液的体积 滴定前的刻度/mL 滴定后的刻度/mL 1 25.OO 1.02 21.03 2 25.00 2.00 21.99 3 25.00 0.2 25.02 若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数是多少?(写出解题过程) ▲ 19(14分)研究电解质在水溶液中的平衡能了解它的存在形式。 ⑴常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH 随MOH溶液的体积变化如图甲所示(溶液体积变化忽略不计)。 ①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)= ▲ mol•L-1。 ②常温下一定浓度的MA稀溶液的pH=a,则a ▲ 7(填“>”、“<”或“=”),用离子方程式表 示其原因为 ▲ ; ③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是 ▲ ; ④K点时,溶液中c(H+)+c(M+)—c(OH—)=__▲__mol•L-1。 ⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100mol•L—1的H2C2O4、NaOH混合溶 液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图乙所示。 ①Q点:c(H2C2O4)_ ▲___c(HC2O4—)(填“>”、“<”或“=”) ②该温度下HC2O4-的电离常数K= ▲ 。 20(18分)氨是化学实验室及化工生产中的重要物质,应用广泛. ⑴已知25℃时:N2(g)+O2(g)2NO(g)△H=+183kJ/mol 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol 4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=﹣1164.4kJ/mol 则N2(g)+3H2(g)2NH3(g)△H= ▲ ; ⑵在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表: N2[] H2 NH3 投料Ⅰ 1.0mol/L 3.0mol/L 0 投料Ⅱ 1.0mol/L 2mol/L 1.0mol/L ①按投料Ⅰ进行反应,测得达到化学平衡化学平衡常数为0.1,则该温度下合成氨反应的平衡常数表达式为 ▲ ; ②按投料Ⅱ进行反应,起始时反应进行的方向为 ▲ (填“正向”或“逆向”); ③若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 ▲ ; a.NH3是N2浓度的2倍 b.容器中气体的压强不再改变 c.2v(NH3)正=v(N2)逆 d.容器中混合气体的密度不再改变 e .容器中N2、H2、NH3物质的量之比为1:3:2 f.混合气体平均相对分子质量保持不变 ④若升高温度,则合成氨反应的化学平衡常数 ▲ (填“变大”、“变小”或“不变”); ⑤L(L1、L2)、X可分别代表压强或温度。如图1表示L一定时,合成氨反应中H2(g)的平衡转 化率随X的变化关系; ⅰ)X代表的物理量是 ▲ ; ⅱ)判断L1、L2的大小关系,L1 ▲ L2.(填“>”“<”或“=”) ⑶电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图2: ①电极b上发生的是 ▲ 反应(填“氧化”或“还原”) ②写出电极a的电极反应式: ▲ 。 命题、审校:陆维畅 江苏省马坝高级中学2018—2019学年度第二学期期中考试 高二化学参考答案 单项选择题 1—5:DCDBB;6—10:BCCBA 不定项选择题 11—15:C CD C AB BD 16(每空2分,共14分) ⑴CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O; 适当加快搅拌速率或适当延长酸浸时间或将硅孔雀石粉碎; ⑵Fe(OH)3; ⑶Cl2+2Fe2+═2Fe3++2Cl﹣; ⑷BD;防止Cu2+转化为Cu(OH)2沉淀; ⑸生成的HCl抑制CuCl2的水解. 17(每空2分,共10分) 18(最后计算4分,其余每空2分,共14分) (1)①偏高 ②无影响 ③B ④无、红 ⑤偏低 (2) 依据数据分析,V(NaOH)=21.03-1.02+21.99-2.002=20.00 mL; n(H+)=n(NaOH)=0.1000 mol·L-1×20.00×10-3L=2.000×10-3mol;n(N)=n(H+ ),该样品中氮的质量分数=2.000×10-3mol×14g·mol-1×101.5000g×100%=18.67%。 19(每空2分共14分) ⑴①1×10—12; ②<;M++H2O⇌H++MOH;③c(A—)>c(H+)>c(M+);④0.005;[] ⑵①<;②1×10—4.2; 20(18分,每空2分)(1)﹣92.2KJ/mol; (2)① ;②逆向;③bf;④变小;⑤i、温度;ii、L1<L2; (3)①还原;②2NH3﹣6e﹣+6OH﹣=N2+6H2O.查看更多