- 2021-04-14 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版钠及其重要化合物作业
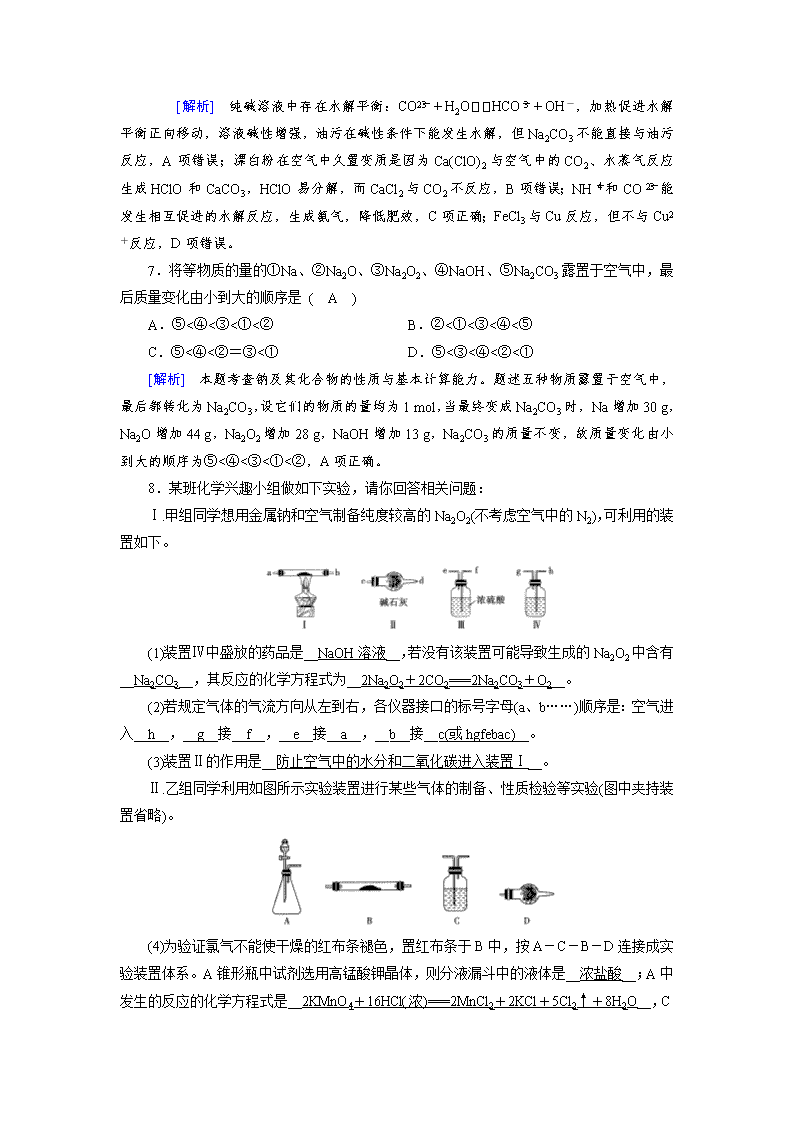
第三章 金属及其重要化合物 第6讲 钠及其重要化合物 A组 基础必做题 1.向分别盛有100 mL水、100 mL 0.1 mol·L-1盐酸、100 mL 0.01 mol·L-1硫酸铜溶液的X、Y、Z三个烧杯中各投入0.05 mol Na。下列有关说法正确的是 ( D ) A.三个烧杯中发生的离子反应均为2Na+2H2O===2Na++2OH-+H2↑ B.三个烧杯中钠均在液面上剧烈反应,且X烧杯中反应最剧烈 C.三个烧杯中反应后,形成的溶液中溶质的物质的量浓度相同 D.三个烧杯中反应后,生成的气体的质量一定相同 [解析] A项,钠与盐酸反应时先发生反应2Na+2H+===2Na++H2↑,待HCl反应完后Na再与H2O反应,与CuSO4溶液反应时还会发生反应Cu2++2OH-===Cu(OH)2↓;B项,三个烧杯中,水的氢离子浓度最小,反应最慢;C项,X烧杯中生成的溶质为NaOH,Y烧杯中生成的溶质为NaCl和NaOH,Z烧杯中生成的溶质为NaCl和NaOH,Y烧杯中生成的溶质为NaCl和NaOH,Z烧杯中生成的溶质为Na2SO4和NaOH,三个烧杯中的溶液中溶质的物质的量浓度不相同;D项,因向三个烧杯中加入钠的物质的量相同且钠全部反应完,故生成H2的量相同。 2.下列物质与类别不对应的是 ( B ) A B C D 小苏打 过氧化钠 淀粉 84消毒液 盐 碱性氧化物 糖类 混合物 [解析] 小苏打的化学式为NaHCO3,属于盐,A项正确;过氧化钠与水反应生成物除了碱以外还有O2,不是碱性氧化物,B项错误;淀粉属于多糖,C项正确;84消毒液是以次氯酸钠为主要成分的水溶液,属于混合物,D项正确。 3.下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是 ( A ) ①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④Na2O2投入CuCl2溶液中 A.①④ B.只有③ C.②③ D.①③④ [解析] ①中有H2、Fe(OH)3生成,④中有O2和Cu(OH)2生成;②中无气体和沉淀生成,③中只有沉淀生成。 4.过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧。下列有关说法不正确的是 ( A ) A.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂 B.熔融过氧化钠时不可使用石英坩埚 C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性 D.过氧化钠与二氧化硫反应时可生成硫酸钠 [解析] Na2O2与H2O、CO2反应时,都是Na2O2自身发生歧化反应,A项错误;石英的主要成分是SiO2,而Na2O2能与SiO2反应生成Na2SiO3,故熔融过氧化钠时不可使用石英坩埚,B项正确;Na2O2具有强氧化性,而C、Al、SO2均具有还原性,故Na2O2可与C、Al、SO2发生氧化还原反应,可将C氧化成CO2,将Al氧化成Al2O3,将SO2氧化成SO,C、D项均正确。 5.一定量的Na2O2与CO2反应,得到固体物质41.8 g,恰好与1 L 1 mol·L-1的稀盐酸完全反应。下列说法正确的是 ( B ) A.41.8 g固体物质为Na2CO3 B.41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物 C.一定量的Na2O2为78 g D.41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物 [解析] 如果41.8 g固体全为Na2CO3,其物质的量为0.39 mol,则其不可能恰好与1 L 1 mol·L-1的稀盐酸完全反应,A项错误;设41.8 g固体物质中,含Na2CO3的物质的量为x mol,Na2O2的物质的量为y mol,则有106 g·mol-1×x mol+78 g·mol-1×y mol=41.8 g,2(x+y)mol=1 mol·L-1×1 L=1 mol,解得x=0.1,y=0.4,B项正确;根据Na元素守恒,可知n(Na2O2)=n(NaCl)=n(HCl)=0.5 mol,即原Na2O2的质量为39 g,C项错误;Na2O2与CO2反应不可能生成NaHCO3,D项错误。 6.化学与社会、生活密切相关。对下列现象或事实的解释正确的是 ( C ) 选项 现象或事实 解释 A 用热的纯碱溶液洗去油污 Na2CO3可直接和油污反应 B 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 C 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 K2CO3与NH4Cl反应生成氨气会降低肥效 D FeCl3溶液可用于铜质印刷线路板制作 FeCl3能从含有Cu2+的溶液中置换出铜 [解析] 纯碱溶液中存在水解平衡:CO+H2OHCO+OH-,加热促进水解平衡正向移动,溶液碱性增强,油污在碱性条件下能发生水解,但Na2CO3不能直接与油污反应,A项错误;漂白粉在空气中久置变质是因为Ca(ClO)2与空气中的CO2、水蒸气反应生成HClO和CaCO3,HClO易分解,而CaCl2与CO2不反应,B项错误;NH和CO能发生相互促进的水解反应,生成氨气,降低肥效,C项正确;FeCl3与Cu反应,但不与Cu2+反应,D项错误。 7.将等物质的量的①Na、②Na2O、③Na2O2、④NaOH、⑤Na2CO3露置于空气中,最后质量变化由小到大的顺序是 ( A ) A.⑤<④<③<①<② B.②<①<③<④<⑤ C.⑤<④<②=③<① D.⑤<③<④<②<① [解析] 本题考查钠及其化合物的性质与基本计算能力。题述五种物质露置于空气中,最后都转化为Na2CO3,设它们的物质的量均为1 mol,当最终变成Na2CO3时,Na增加30 g,Na2O增加44 g,Na2O2增加28 g,NaOH增加13 g,Na2CO3的质量不变,故质量变化由小到大的顺序为⑤<④<③<①<②,A项正确。 8.某班化学兴趣小组做如下实验,请你回答相关问题: Ⅰ.甲组同学想用金属钠和空气制备纯度较高的Na2O2(不考虑空气中的N2),可利用的装置如下。 (1)装置Ⅳ中盛放的药品是__NaOH溶液__,若没有该装置可能导致生成的Na2O2中含有__Na2CO3__,其反应的化学方程式为__2Na2O2+2CO2===2Na2CO3+O2__。 (2)若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序是:空气进入__h__,__g__接__f__,__e__接__a__,__b__接__c(或hgfebac)__。 (3)装置Ⅱ的作用是__防止空气中的水分和二氧化碳进入装置Ⅰ__。 Ⅱ.乙组同学利用如图所示实验装置进行某些气体的制备、性质检验等实验(图中夹持装置省略)。 (4)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A-C-B-D连接成实验装置体系。A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是__浓盐酸__;A中发生的反应的化学方程式是__2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O__, C中试剂是__浓硫酸__,D的作用是__吸收氯气以免污染环境(或其他合理答案)__。 [解析] (1)用金属钠和空气制备纯度较高的Na2O2,先要除去空气中的CO2和水蒸气,装置Ⅲ盛放浓硫酸,其作用是除去水蒸气,则装置Ⅳ的作用是除去CO2,应盛放NaOH溶液。若没有装置Ⅳ,则CO2能与生成的Na2O2反应,导致生成的Na2O2中含有Na2CO3。(2)由于NaOH溶液除去CO2会带出水蒸气,故应先除去CO2,再除去水蒸气,故接口的连接顺序为hgfeabc(ab顺序可交换)。(3)Na2O2能与空气中的水蒸气和CO2反应,故装置Ⅱ的作用是防止空气中的水分和二氧化碳进入装置Ⅰ。(4)A为氯气的制备装置,常温下可用KMnO4与浓盐酸反应来制备氯气,故分液漏斗中的液体是浓盐酸。C的作用是干燥氯气,故应选择浓硫酸。氯气有毒,应进行尾气吸收,故D的作用是吸收氯气以免污染环境。 B组 能力提升题 9.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是 ( B ) 选项 X Y Z A Na NaOH NaCl B Si SiO2 Na2SiO3 C Cl2 HClO NaClO D NO NO2 HNO3 [解析] 钠与水反应得到氢氧化钠,氢氧化钠与盐酸反应得到氯化钠,电解熔融氯化钠得到钠,电解饱和氯化钠溶液可以得到氢氧化钠,A符合转化关系;硅酸钠无法一步得到二氧化硅,无法实现图示中的转化,B不符合转化关系;氯气与水反应生成HClO,HClO与NaOH反应生成NaClO,NaClO与二氧化碳反应生成HClO,NaClO和盐酸反应可以生成Cl2, C可实现转化;NO与氧气反应生成二氧化氮,二氧化氮与水反应得到硝酸,浓硝酸与铜反应得到二氧化氮,稀硝酸与铜反应得到NO,D符合转化关系。 10.Na2CO3和NaHCO3是常见的两种钠盐,它们广泛应用于生产和生活中。下列有关碳酸钠和碳酸氢钠的说法中,不正确的是 ( C ) A.小苏打能中和胃酸,对胃壁不产生强烈的刺激或腐蚀作用,可用于治疗胃酸过多症,但不适合胃溃疡病人 B.NaHCO3能中和面粉发酵后产生的酸,并且产生二氧化碳气体,可用于做馒头 C.可以用澄清石灰水来鉴别Na2CO3溶液和NaHCO3溶液 D.往Na2CO3饱和溶液中通入CO2气体,可获得NaHCO3沉淀 [解析] 小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为NaHCO3+HCl===NaCl+H2O+CO2↑,胃溃疡病人不能服用小苏打类药物来治疗,因为反应产生的二氧化碳气体会造成胃部胀气,易造成胃穿孔,A项正确;NaHCO3 与酸反应生成二氧化碳气体,使得馒头或面包暄软多孔,B项正确;Na2CO3和NaHCO3溶液都与澄清石灰水反应生成CaCO3白色沉淀,所以不能用澄清石灰水来鉴别,C项错误;Na2CO3比NaHCO3易溶于水.所以在饱和Na2CO3溶液中通入CO2气体可得到NaHCO3沉淀,D项正确。 11.向NaOH溶液中缓慢通入CO2气体,溶液中CO的物质的量与通入CO2物质的量的关系如图所示。下列关于图中a、b两点溶液的说法错误的是 ( B ) A.a、b两点溶液分别与同浓度盐酸完全反应时,消耗盐酸的体积相同 B.a点溶液中水的电离程度与b点溶液中水的电离程度相同 C.a、b两点溶液都满足: c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-) D.将a、b两点溶液混合后满足: c(OH-)=c(H+)+c(HCO)+2c(H2CO3) [解析] 向NaOH溶液中通入CO2气体,发生反应:2OH-+CO2===CO+H2O,CO2过量时的总反应为OH-+CO2===HCO。结合题给图像可知,当通入2n mol CO2时,CO的物质的量达到最大,为2n mol,推断出原NaOH溶液中含有4n mol NaOH。a点,通入n mol CO2,生成n mol CO,剩余2n mol OH-;b点,溶液中含有n mol CO和2n mol HCO。a、b两点溶液分别与同浓度盐酸完全反应得到溶液中的溶质都是NaCl,根据钠离子守恒可知A项说法正确。NaOH抑制水的电离而NaHCO3促进水的电离,所以a点溶液中水的电离程度小于b点的,B项说法错误。C项是正确的电荷守恒表达式,C项说法正确。将a、b两点溶液混合后恰好得到Na2CO3溶液,D项是Na2CO3溶液中的质子守恒表达式,D项说法正确。 12.含8.0 g NaOH的溶液中通入一定量CO2后,将得到的溶液低温小心蒸干,称得无水物9.3 g,则该无水物中一定含有的物质是 ( D ) A.Na2CO3 B.NaHCO3 C.Na2CO3和NaHCO3 D.NaOH和Na2CO3 [解析] n(NaOH)==0.2 mol。①若白色固体完全为碳酸钠,根据钠原子守恒,生成碳酸钠的物质的量为0.1 mol,质量为10.6 g>9.3 g,不可能;②若白色固体为氢氧化钠和碳酸钠的混合物,假设完全为氢氧化钠,则质量为8.0 g,若完全为碳酸钠,则质量为 10.6 g,8.0 g<9.3 g<10.6 g,可能为二者的混合物;③若白色固体为碳酸氢钠和碳酸钠的混合物,完全为碳酸钠时,固体质量为10.6 g,完全为碳酸氢钠时,固体质量为16.8 g,所以白色固体的最小质量为10.6 g>9.3 g,所以不可能是碳酸钠和碳酸氢钠的混合物;④若完全为碳酸氢钠时,白色固体的质量为16.8 g>9.3 g,不可能;根据以上讨论可知,反应产物为NaOH和Na2CO3的混合物。 13.下列实验操作正确的是 ( C ) 选项 实验 操作 A 观察钠与水反应的现象 用镊子从煤油中取出金属钠,切下黄豆大小的钠,小心放入装满水的烧杯中 B 检验NaHCO3溶液与Na2CO3溶液 用小试管分别取少量溶液,然后滴加澄清石灰水 C 证明Na2O2与CO2的反应是放热反应 Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 D 检验Na2CO3溶液与K2CO3溶液 用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色 [解析] 应将钠表面的煤油用纸吸干且烧杯中不能装满水,A错误;B项都有白色沉淀产生,错误;Na2O2与CO2反应生成氧气,如果棉花燃烧说明达到了着火点,能证明是放热反应,C正确;观察钾的焰色应该透过蓝色钴玻璃,D错误。 14.下列各组物质相互混合进行反应后,最终有白色沉淀生成的是 ( D ) ①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液反应 ③少量Ca(OH)2投入过量的NaHCO3溶液中 ④向AlCl3溶液中滴入NaHCO3溶液 ⑤向饱和Na2CO3溶液中通入足量CO2 A.①③④⑤ B.只有①④ C.只有②③ D.只有③④⑤ [解析] 金属钠投入到FeCl3溶液中,生成的沉淀是红褐色的,故①不符合题意;过量NaOH溶液和明矾溶液混合,最终没有沉淀生成,故②不符合题意。 15.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下 下列说法正确的是 ( C ) A.尾气吸收所涉及的反应中,氧化剂与还原剂的物质的量之比为1∶2 B.制取“电解”所用的食盐水时,通常用Ca(OH)2除去粗盐中含有的Mg2+ C.电解时,阴极的主要产物为NaClO2 D.工业上,将Cl2通入石灰水中即制得漂白粉 [解析] 选项A,尾气吸收所涉及的反应是2ClO2+2NaOH+H2O2===2NaClO2+2H2O+O2,氧化剂与还原剂的物质的量之比为2∶1,其中H2O2为还原剂。选项B,粗盐精制时,用NaOH除去Mg2+。根据电解原理,可知选项C正确。选项D,工业上将Cl2通入冷的石灰乳中制漂白粉。 16.已知:A为含金属离子的淡黄色固体化合物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。 A 请回答下列问题: (1)这种金属离子的离子结构示意图为____。 (2)X的电子式为__∶∶C∶∶__。 (3)B中所含化学键的类型是__极性共价键、离子键__。常温常压下,7.8 g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式:__2Na2O2(s)+2H2O(l)===4NaOH(aq)+O2(g) ΔH=-20a kJ·mol-1__。 (4)①C也可转化为B,写出该转化的化学方程式: __Ca(OH)2+Na2CO3===CaCO3↓+2NaOH__ __或Ba(OH)2+Na2CO3===BaCO3↓+2NaOH__。 ②B与D反应的离子方程式为__OH-+HCO===CO+H2O__。 (5)将一定量的气体X通入2 L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与HCl物质的量的关系如图(忽略气体的溶解和HCl的挥发)。 请回答:a点溶液中所含溶质的化学式为__Na2CO3、NaCl__,a~b之间的反应的离子方程式是__CO+H+===HCO__。 [解析] A为含金属离子的淡黄色固体化合物,A为Na2O2,根据2Na2O2+2H2O=== 4NaOH+O2↑,E、X为空气中常见气体知E为O2,B为NaOH,C为Na2CO3,D为NaHCO3,X为CO2。 (3)B为离子化合物NaOH,所含化学键的类型是极性共价键、离子键;利用7.8 g A与足量的水充分反应放出热量a kJ,计算2 mol Na2O2与足量的水充分反应放出热量20a kJ,该反应的热化学方程式为2Na2O2(s)+2H2O(l)===4NaOH(aq)+O2(g) ΔH=-20a kJ·mol-1。 (4)①C转化为B,即Na2CO3转化为NaOH,可以加Ca(OH)2或Ba(OH)2实现,化学方程式为Ca(OH)2+Na2CO3===CaCO3↓+2NaOH或Ba(OH)2+Na2CO3===BaCO3↓+2NaOH;②B与D反应的离子方程式为OH-+HCO===CO+H2O。 (5)根据Na2CO3+HCl===NaHCO3+NaCl、NaHCO3+HCl===NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上产生气体之前消耗盐酸与产生二氧化碳消耗盐酸体积之比为3∶2。所以溶液中还存在NaOH,说明原溶液中溶质为NaOH、Na2CO3,结合化学方程式可知,溶液中n(NaOH)∶n(Na2CO3)=1∶2,故a点时氢氧化钠与盐酸恰好完全反应,所以a点时溶液中的溶质是Na2CO3和NaCl,a~b占发生的反应是Na2CO3+HCl===NaHCO3+NaCl,离子方程式是CO+H+===HCO。查看更多