【化学】河北省衡水中学2020届高三下学期二月份网络教学质量监测(解析版)
河北省衡水中学2020届高三下学期二月份网络教学质量监测
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 K-39 Ti-48 Fe-56 I-127 Ag-108
一、选择题:本大题包括7小题,每小题6分。在每小题给出的四个选项中,只有一项符合题目要求。
1.下列有关氯元素及其化合物的表示正确的是( )
A. 质子数为17、中子数为20的氯原子:
B. 氯离子(Cl-)的结构示意图:
C. 氯分子的电子式:
D. 氯乙烯分子的结构简式:H3C-CH2Cl
【答案】C
【详解】A、左上角应是质量数,质量数=中子数+质子数=37,应是,故A说法错误;
B、氯离子质子数大于电子数,其结构示意图:,故B错误;
C、氯原子最外层7个电子,每个氯原子都达到8电子稳定结构,故C正确;
D、氯乙烯结构简式:CH2=CHCl,而题目中是氯乙烷,故D说法错误。
2.下列指定反应的离子方程式正确的是( )
A. 将铜插入稀硝酸中:Cu+4H++2NO3–=Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
【答案】C
【详解】A.稀硝酸对应的还原产物为NO,A错误;
B.电荷不守恒,应为:2Fe3++Fe=3Fe2+,B错误;
C.Al2(SO4)3和氨水反应生成(NH4)2SO4和Al(OH)3,离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,C正确;
D.Na2SiO3为可溶性盐,应拆写成Na+和SiO32-,D错误。
答案选C。
3.下列能量转化过程与氧化还原反应无关的是( )
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
【答案】A
【详解】A、硅太阳能电池工作时,光能转化成电能,不是氧化还原反应,A正确;
B、锂离子电池放电时,化学能转化成电能,锂失去电子,发生氧化反应,B错误;
C、电解质溶液导电时,电能转化成化学能,发生的是电解,属于氧化还原反应,C错误;
D、葡萄糖为人类生命活动提供能量时,化学能转化成热能,反应中葡萄糖被氧化,属于氧化还原反应,D错误;
答案选A。
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X
W
C. 化合物Z2Y和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
【答案】D
【详解】短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X为C元素,X、Y的核电荷数之比为3:4,则Y为O元素,W-的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素,则
A.X与Y形成的化合物有CO、CO2等,Z的最高价氧化物的水化物为NaOH,CO和NaOH不反应,故A错误;
B.一般说来,电子层数越多,原子半径越大,电子层数相同,质子数越多,半径越小,则原子半径大小X>Y,Z>W,故B错误;
C.化合物Z2Y和ZWY3分别为Na2O、NaClO3,NaClO3存在离子键和共价键,故C错误;
D.Y的单质臭氧,W的单质氯气,对应的化合物ClO2,可作为水的消毒剂,故D正确。
故选D。
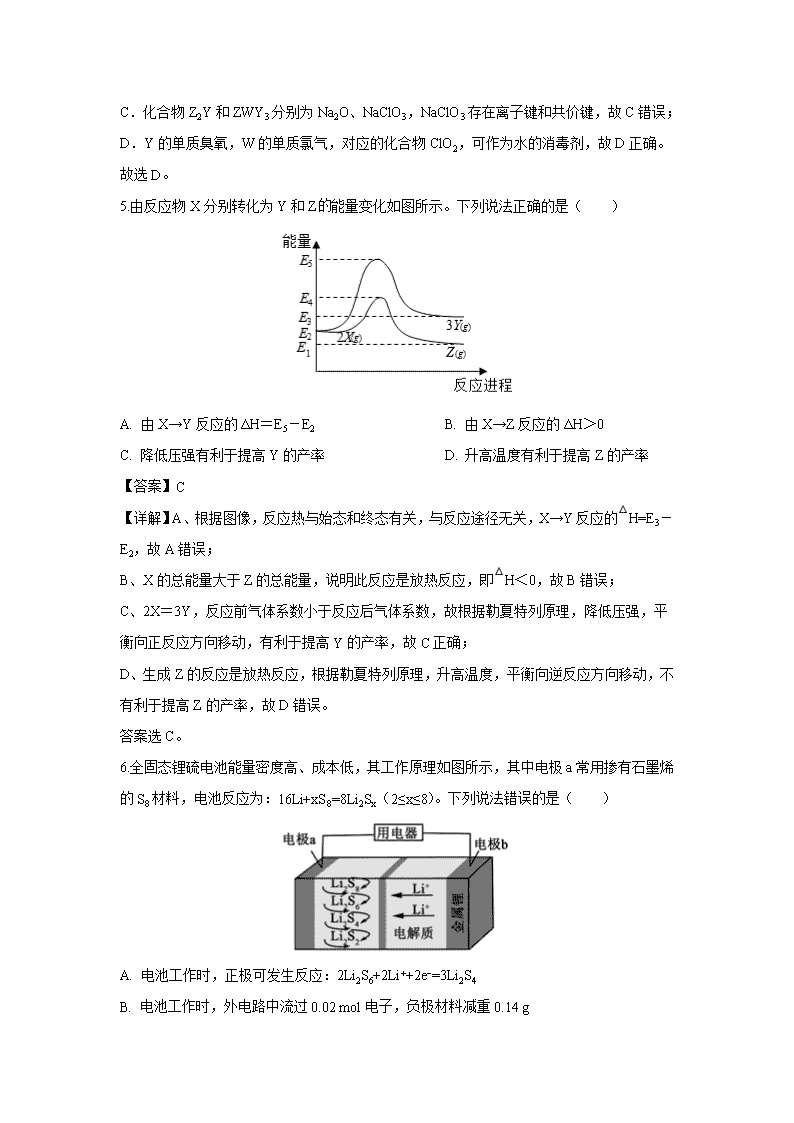
5.由反应物X分别转化为Y和Z能量变化如图所示。下列说法正确的是( )
A. 由X→Y反应的ΔH=E5-E2 B. 由X→Z反应的ΔH>0
C. 降低压强有利于提高Y的产率 D. 升高温度有利于提高Z的产率
【答案】C
【详解】A、根据图像,反应热与始态和终态有关,与反应途径无关,X→Y反应的△H=E3-E2,故A错误;
B、X的总能量大于Z的总能量,说明此反应是放热反应,即△H<0,故B错误;
C、2X=3Y,反应前气体系数小于反应后气体系数,故根据勒夏特列原理,降低压强,平衡向正反应方向移动,有利于提高Y的产率,故C正确;
D、生成Z的反应是放热反应,根据勒夏特列原理,升高温度,平衡向逆反应方向移动,不有利于提高Z的产率,故D错误。
答案选C。
6.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )
A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4
B. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
【答案】D
【详解】A.原电池工作时,Li+向正极移动,则a为正极,正极上发生还原反应,随放电的多少可能发生多种反应,其中可能为2Li2S6+2Li++2e-=3Li2S4,故A正确;B.原电池工作时,转移0.02mol电子时,氧化Li的物质的量为0.02mol,质量为0.14g,故B正确;C.石墨能导电,利用石墨烯作电极,可提高电极a的导电性,故C正确;D.电池充电时间越长,转移电子数越多,生成的Li和S8越多,即电池中Li2S2的量越少,故D错误;答案为D。
7.已知异丙苯的结构简式如图,下列说法错误的是( )
A. 异丙苯的分子式为
B. 异丙苯的沸点比苯高
C. 异丙苯中碳原子可能都处于同一平面
D. 异丙苯和苯为同系物
【答案】C
【详解】由有机物结构简式可知有机物的分子式为,故A正确;
B.异丙苯和苯均为分子晶体,异丙苯的相对分子质量比苯大,故分子间作用力强于苯,沸点比苯高,故B正确;
C. 分子中带有特殊标记的这五个原子构成四面体形,故四个带特殊标记的碳原子不在同一平面上,故C错误;
D.异丙苯和苯的结构相似,分子组成上相差3个原子团,互为同系物,故D正确。
答案选C。
【点睛】本题考查有机物的结构和性质,注意四面体碳最多3原子共平面,为易错点。
二、非选择题:包括必考题和选考题两部分。第8题-第10题为必考题每个试题考生都必须作答,第11题-第12题为选考题,考生根据要求作答。
(一)必考题
8.ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器D的名称是______________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜____(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是_________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____________________________,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_______,原因是_________________________________。
【答案】(1). 锥形瓶 (2). b (3). 慢 (4). 吸收Cl2 (5). 4H++5ClO2-=Cl-+4ClO2↑+2H2O (6). 验证是否有ClO2生成 (7). 稳定剂Ⅱ (8). 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需浓度
【详解】(1)根据仪器特征,仪器D的名称是锥形瓶;根据操作分析,F装置应是Cl2和KI反应,所以应该长管进气,短管出气,答案选b。
(2)为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢。
(3)F装置中能发生Cl2+2KI=2KCl+I2,碘遇淀粉变蓝,所以若F中溶液的颜色若不变,说明没有氯气,则装置C的作用是吸收Cl2。
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据化合价升降相等和电荷守恒以及原子守恒配平,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成。
(5)根据图3可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好。
9.SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
② 尿素水溶液热分解为NH3和CO2,该反应的化学方程式:_________________________。
②反应器中NH3还原NO2的化学方程式:_______________________________。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:______________________________________。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是____。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是______。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___□15NNO+□H2O___。
【答案】(1). CO(NH2)2+H2OCO2+2NH3 (2). 8NH3+6NO27N2+12H2O (3). 2SO2+O2+4NH3+2H2O=2(NH4)2SO4 (4). (5). BaO (6). 8∶1 (7). 415NO+4NH3+3O2415NNO+6H2O
【分析】结合反应物、生成物,根据原子守恒,若是氧化还原反应的方程式,再结合得失电子守恒配平化学反应方程式;测定溶液中尿素含量时,将所含氮完全转化为NH3,用过量的稀硫酸吸收氨气,反应后剩余的硫酸,用氢氧化钠溶液中和,整个过程中的,硫酸与氨气、氢氧化钠反应的化学方程式为2NH3+H2SO4=2(NH4)2SO4,2NaOH+H2SO4=2Na2SO4+2H2O。
【详解】(1)①尿素水溶液热分解为氨气和二氧化碳,反应方程式为CO(NH2)2+H2OCO2+2NH3 ;
②NH3在催化剂作用下还原NO2生成N2和H2O,反应的化学方程式为8NH3+6NO27N2+12H2O;
③二氧化硫在氧气作用下与氨气和水反应生成硫酸铵,此反应中二氧化硫是还原剂,氧气是氧化剂;反应的化学方程式为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;
④NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,过程中所涉及的化学方程式为:2NH3+H2SO4=2(NH4)2SO4,2NaOH+H2SO4=2Na2SO4+2H2O,反应中n(H2SO4)=c1×v1×10-3mol,n(NaOH)=c2×v2×10-3mol,由方程式可知:n(NaOH)+n(NH3)=2n(H2SO4),则n(NH3)=(2c1×v1×10-3-c2×v2×10-3)mol,n[CO(NH2)2]=n(NH3)=×(2c1×v1×10-3-c2×v2×10-3)mol,m[CO(NH2)2]=60g·mol-1××(2c1×v1×10-3-c2×v2×10-3)mol=(0.06c1×v1-0.03c2×v2)g,所以尿素的质量分数是: =;
(2)①由图可知BaO和NOx反应生成Ba(NO3)2,Ba(NO3)2再被还原为N2,则存储NOx的物质是BaO;
②第一步反应中H2被氧化生成水,氢元素化合价由0价升高到+1价,Ba(NO3)2中的N元素的化合价由+5价降到-3价,生成氨气,则1molBa(NO3)2生成氨气得到16mol电子,根据氧化还原反应中得失电子守恒,则参加反应的氢气的物质的量为mol=8mol,故第一步反应消耗的H2与Ba(NO3)2的物质的量之比是8:1;
③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知,15NO与NH3的物质的量之比应为1:1,结合氧化还原反应中得失电子守恒、原子守恒,可知该反应的化学方程式为:415NO+4NH3+3O2415NNO+6H2O。
【点睛】本题主要考查的是:根据反应物、生成物结合原子守恒、得失电子守恒配平化学反应方程式,在测定溶液中尿素(M=60g·mol-1)含量时,要结合相关数据的处理,通过反应方程式的化学计量数来计算相关的量。
10.催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
543
Cat.1
12.3
42.3
543
Cat.2
10.9
72.7
553
Cat.1
15.3
39.1
553
Cat.2
12.0
71.6
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=_______;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有_____。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________________________。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图_____。
【答案】 (1). (2). CD (3). 表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响 (4).
【分析】(1)反应I为CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数表达式K=生成物浓度幂乘积与反应物浓度幂的乘积之比;
(2)A.使用催化剂Cat.1,对甲醇的平衡转化率不产生影响;
B.使用催化剂Cat.2,对甲醇的平衡转化率不产生影响;
C.反应I为放热反应,降低反应温度,平衡正向移动;
D.投料比不变,增加反应物的浓度,相当于加压;
E.增大CO2和H2的初始投料比,平衡正向移动,但CO2的转化率减小。
(3)在相同温度下,达平衡前,不同的催化剂对同一反应的催化能力不同,因而选择性不同。
(4)同一反应,使用不同的催化剂,活化能不同,但不影响反应物和生成物的总能量。从表中数据可以看出,Cat.2的选择性更高,因而对反应的活化能影响更大。
【详解】(1)反应I为CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数表达式K=。答案为:;
(2)A.使用催化剂Cat.1,对甲醇的平衡转化率不产生影响,A不合题意;
B.使用催化剂Cat.2,对甲醇的平衡转化率不产生影响,B不合题意;
C.反应I为放热反应,降低反应温度,平衡正向移动,从而增大CO2的转化率,C符合题意;
D.投料比不变,增加反应物的浓度,相当于加压,平衡正向移动,CO2的转化率增大,D符合题意;
E.增大CO2和H2的初始投料比,平衡正向移动,但CO2的转化率减小,E不合题意;
故选CD。答案为:CD;
(3)在相同温度下,达平衡前,不同的催化剂对同一反应的催化能力不同,因而选择性不同,其原因是:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。答案为:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响;
(4)同一反应,不同的催化剂,活化能降低程度不同,但不影响反应物和生成物的总能量。从表中数据可以看出,Cat.2的选择性更高,因而对反应的活化能影响更大。则示意图为:
。答案为:。
【点睛】催化剂只能改变反应物活化能,因而改变平衡前单位时间内的转化率,但对平衡转化率、反应物及生成物的能量,不产生影响。
(二)选考题
11.[2017新课标Ⅲ]研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________________,原因是______________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在______________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。
【答案】(1). 1s22s22p63s23p63d74s2或[Ar]3d74s2 (2). O (3). Mn (4). sp (5). sp3 (6). H2O>CH3OH>CO2>H2 (7). H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2分子量较大、范德华力较大 (8). 离子键和π键(或键) (9). 0.148 (10). 0.076
【详解】(1)Co是27号元素,位于元素周期表第4周期第VIII族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。元素Mn与O中,由于O元素是非金属性而Mn是过渡元素,所以第一电离能较大是O。O基态原子价电子为2s22p4,所以其核外未成对电子数是2,而Mn基态原子价电子排布为3d54s2,所以其核外未成对电子数是5,因此核外未成对电子数较多的是Mn。
(2)CO2和CH3OH的中心原子C原子的价层电子对数分别为2和4,所以CO2和CH3OH分子中C原子的杂化形式分别为sp和sp3。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为H2O>CH3OH>CO2>H2,原因是常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;H2O与CH3OH均为非极性分子,H2O中氢键比甲醇多,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。
(4)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个氧原子形成 3个σ键,硝酸根中有一个氮氧双键,所以还存在π键。
(5)因为O2-是面心立方最密堆积方式,面对角线是O2-半径的4倍,即4r=a,解得r= nm=0.148nm;MnO也属于NaCl型结构,根据晶胞的结构,晶胞棱长是2r(O2-)+2r(Mn2+)= a' =0.448nm,解得r(Mn2+)=0.076nm。
12.化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:
回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________________________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物的合成路线________(其他试剂任选)。
【答案】(1). 苯甲醛 (2). 加成反应 (3). 取代反应 (4). (5). (6). 、、和(任写两种) (7).
【分析】由H的结构简式逆推可知A、B、C、D、E、F苯环上均只有一个取代基。结合信息①及B的分子式可知:A为苯甲醛,B为,由的反应条件可知的转化为醛基转化为羧基,C为,C与Br2发生加成反应,生成,D在KOH的乙醇溶液中加热发生消去反应,酸化后生成,E与乙醇发生酯化反应或取代反应生成,F与G发生类似信息所给反应加成反应生成H,逆推可知G的结构简式为,据此解答。
【详解】由上述分析可知,A为苯甲醛,故答案为:苯甲醛;
由分析可知:C生成D发生加成反应,E生成F发生取代反应,故答案为:加成反应;取代反应;
由分析可知,E的结构简式为,故答案为:;
G的结构简式为,由F生成H的化学方程式为
,故答案为:;
为,苯环外含有5个碳原子、3个不饱和度和2个O原子,其同分异构体能与饱和碳酸氢钠溶液反应生成CO2,即必含有羧基,核磁共振氢谱显示有4种氢原子,则具有较高的对称性,氢原子个数比为,可知含有两个对称的甲基,还有2个碳原子和2个不饱和度,则含有碳碳三键,故满足条件的同分异构体的结构简式为、、和,故答案为:、、和(任写两种);
逆合成分析:可由与溴加成而来,可由和发生类似已知②反应而来,可由发生消去反应而来,可由和氯气在光照条件下发生取代反应而来,即:,故答案为:。