- 2021-04-14 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试卷
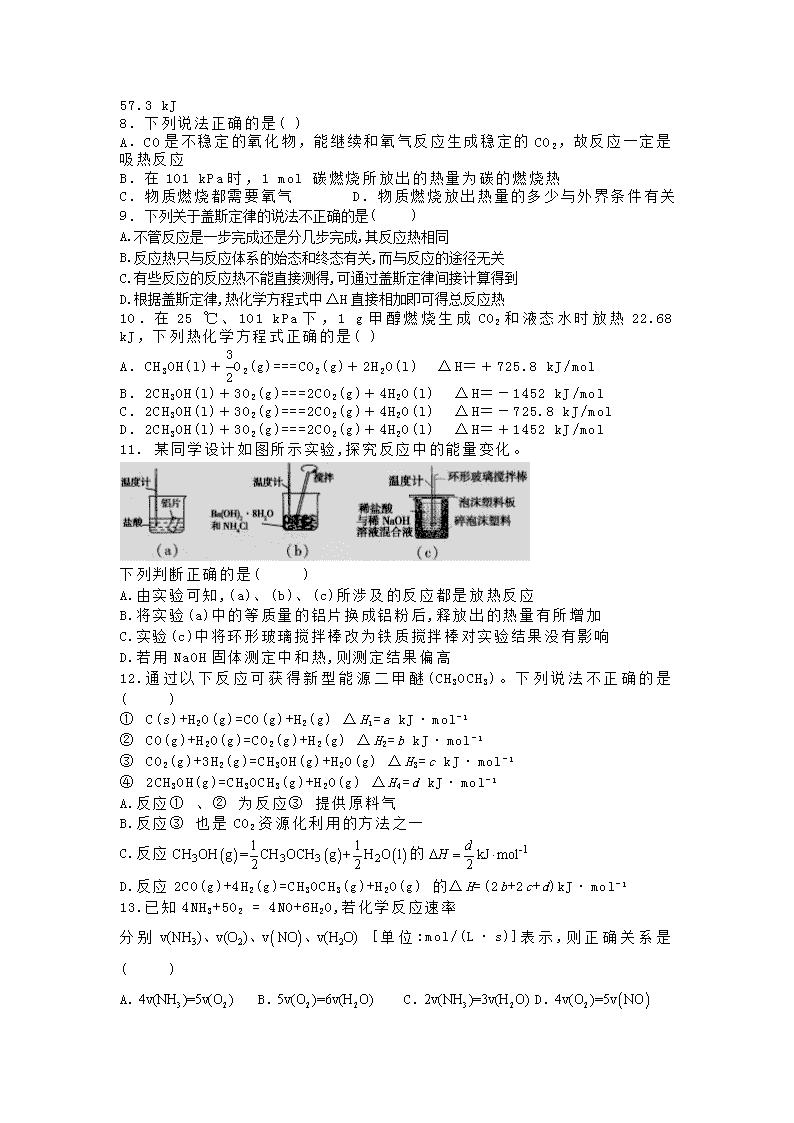
化 学 ( 满 分 : 100 分 时 间 : 90 分 钟 ) 可 能 用 到 的 相 对 原 子 质 量 : H : 1 C : 12 O : 16 Na : 23 Cl: 35.5 一 . 单 项 选 择 题 ( 24 个 小 题 , 每 题 2 分 , 共 48 分 ) 1.未 来 新 能 源 的 特 点 是 资 源 丰 富 ,在 使 用 时 对 环 境 无 污 染 或 污 染 很 小 ,且 可 以 再 生 。 下 列 属 于 未 来 新 能 源 标 准 的 是 ( ) ① 天 然 气 ② 煤 ③ 核 能 ④ 石 油 ⑤ 太 阳 能 ⑥ 生 物 质 能 ⑦ 风 能 ⑧ 氢 能 A. ① ② ③ ④ B. ⑤ ⑥ ⑦ ⑧ C. ③ ⑤ ⑥ ⑦ ⑧ D. ③ ④ ⑤ ⑥ ⑦ ⑧ 2.下 列 说 法 正 确 的 是 ( ) A.在 101kPa 时 ,1mol 纯 物 质 完 全 燃 烧 时 所 放 出 的 热 量 ,叫 做 该 物 质 的 燃 烧 热 B.酸 和 碱 发 生 中 和 反 应 生 成 1mol 水 ,这 时 的 反 应 热 叫 中 和 热 C.燃 烧 热 或 中 和 热 是 反 应 热 的 种 类 之 一 D.在 稀 溶 液 中 ,1mol 和 1mol NaOH 完 全 中 和 时 放 出 的 热 量 为 57.3 kJ 3 . 强 酸 与 强 碱 的 稀 溶 液 发 生 中 和 反 应 的 热 效 应 : H + (aq) + OH - (aq) === H2O(l) Δ H= - 57.3 kJ· mol - 1。 分 别 向 1 L 0.5 mol· L- 1 的 NaOH 溶 液 中 加 入 : ① 稀 醋 酸 、② 浓 硫 酸 、③ 稀 硝 酸 ,恰 好 完 全 反 应 的 Δ H 的 绝 对 值 分 别 为 Δ H1、Δ H2、 Δ H3, 它 们 的 关 系 正 确 的 是 ( ) A. Δ H 1>Δ H 2>Δ H 3 B. Δ H 2<Δ H 1<Δ H 3 C. Δ H 1= Δ H2= Δ H3 D. Δ H 2>Δ H3>Δ H 1 4. 下 列 与 化 学 反 应 能 量 变 化 相 关 的 叙 述 正 确 的 是 ( ) A. 生 成 物 总 能 量 一 定 低 于 反 应 物 总 能 量 B. 放 热 反 应 的 反 应 速 率 总 是 大 于 吸 热 反 应 的 反 应 速 率 C. 应 用 盖 斯 定 律 , 可 计 算 某 些 难 以 直 接 测 量 的 反 应 焓 变 D. 同 温 同 压 下 , H 2(g)+ Cl 2(g) ===2HCl(g)在 光 照 和 点 燃 条 件 下 的 Δ H 不 同 5. 下 列 反 应 的 能 量 变 化 与 其 他 三 项 不 相 同 的 是 ( ) A. 铝 粉 与 氧 化 铁 的 反 应 B. 氯 化 铵 与 消 石 灰 的 反 应 C. 锌 片 与 稀 硫 酸 反 应 D. 钠 与 冷 水 反 应 6. 下 列 说 法 正 确 的 是 ( ) A.热 化 学 方 程 式 中 ,化 学 式 前 面 的 化 学 计 量 数 既 可 表 示 微 粒 数 ,又 可 表 示 物 质 的 量 B.热 化 学 方 程 式 中 ,如 果 没 有 注 明 温 度 和 压 强 ,则 表 示 在 标 准 状 况 下 测 得 的 数 据 C.书 写 热 化 学 方 程 式 时 ,不 仅 要 写 明 反 应 热 的 符 号 和 数 值 、单 位 ,还 要 注 明 各 物 质 的 聚 集 状 态 D. 凡 是 化 合 反 应 都 是 放 热 反 应 , 分 解 反 应 都 是 吸 热 反 应 7. 下 列 说 法 正 确 的 是 ( ) A. 测 定 HCl 和 NaOH 反 应 的 中 和 热 时 , 每 次 实 验 均 应 测 量 3 个 温 度 , 即 盐 酸 起 始 温 度 、 NaOH 起 始 温 度 和 反 应 后 终 止 温 度 B. 在 101 kPa 时 , 1 mol H 2 完 全 燃 烧 生 成 液 态 水 , 放 出 285.8 kJ 热 量 , H2 的 燃 烧 热 为 - 285.8 kJ· mol- 1 C. 在 101 kPa 时 , 1 mol C 与 适 量 O 2 反 应 生 成 1 mol CO 时 , 放 出 110.5 kJ 热 量 , 则 C 的 燃 烧 热 为 110.5 kJ· mol- 1 D. 在 稀 溶 液 中 : H + (aq)+ OH - (aq) === H 2O(l)Δ H= - 57.3 kJ· mol- 1, 若 将 含 0.5 mol H2SO4 的 浓 溶 液 与 含 1 mol NaOH 的 溶 液 混 合 , 放 出 的 热 量 等 于 3CH COOH 57.3 kJ 8. 下 列 说 法 正 确 的 是 ( ) A. CO 是 不 稳 定 的 氧 化 物 , 能 继 续 和 氧 气 反 应 生 成 稳 定 的 CO 2, 故 反 应 一 定 是 吸 热 反 应 B. 在 101 kPa 时 , 1 mol 碳 燃 烧 所 放 出 的 热 量 为 碳 的 燃 烧 热 C. 物 质 燃 烧 都 需 要 氧 气 D. 物 质 燃 烧 放 出 热 量 的 多 少 与 外 界 条 件 有 关 9. 下列关于盖斯定律的说法不正确的是( ) A.不管反应是一步完成还是分几步完成,其反应热相同 B.反应热只与反应体系的始态和终态有关,而与反应的途径无关 C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到 D.根据盖斯定律,热化学方程式中 ΔH 直接相加即可得总反应热 10 . 在 25 ℃ 、 101 kPa 下 , 1 g 甲 醇 燃 烧 生 成 CO2 和 液 态 水 时 放 热 22.68 kJ, 下 列 热 化 学 方 程 式 正 确 的 是 ( ) A. CH 3OH(l)+ 3 2O2(g)===CO2(g)+ 2H 2O(l) Δ H= + 725.8 kJ/mol B. 2CH 3OH(l)+ 3O 2(g)===2CO2(g)+ 4H 2O(l) Δ H= - 1452 kJ/mol C. 2CH 3OH(l)+ 3O 2(g)===2CO2(g)+ 4H 2O(l) Δ H= - 725.8 kJ/mol D. 2CH 3OH(l)+ 3O 2(g)===2CO2(g)+ 4H 2O(l) Δ H= + 1452 kJ/mol 11. 某 同 学 设 计 如 图 所 示 实 验 ,探 究 反 应 中 的 能 量 变 化 。 下 列 判 断 正 确 的 是 ( ) A.由 实 验 可 知 ,(a)、 (b)、 (c)所 涉 及 的 反 应 都 是 放 热 反 应 B.将 实 验 (a)中 的 等 质 量 的 铝 片 换 成 铝 粉 后 ,释 放 出 的 热 量 有 所 增 加 C.实 验 (c)中 将 环 形 玻 璃 搅 拌 棒 改 为 铁 质 搅 拌 棒 对 实 验 结 果 没 有 影 响 D.若 用 NaOH 固 体 测 定 中 和 热 ,则 测 定 结 果 偏 高 12. 通 过 以 下 反 应 可 获 得 新 型 能 源 二 甲 醚 (CH3OCH3) 。 下 列 说 法 不 正 确 的 是 ( ) ① C(s)+H2O(g)=CO(g)+H2(g) Δ H1=a kJ· mol- 1 ② CO(g)+H2O(g)=CO2(g)+H2(g) Δ H2=b kJ· mol- 1 ③ CO2(g)+3H2(g)=CH3OH(g)+H2O(g) Δ H3=c kJ· mol- 1 ④ 2CH3OH(g)=CH3OCH3(g)+H2O(g) Δ H4=d kJ· mol- 1 A.反 应 ① 、 ② 为 反 应 ③ 提 供 原 料 气 B.反 应 ③ 也 是 CO 2 资 源 化 利 用 的 方 法 之 一 C.反 应 的 D.反 应 2CO(g)+4H 2(g)=CH3OCH3(g)+H2O(g) 的 Δ H=(2b+2c+d)kJ· mol- 1 13.已 知 4NH 3+5O2 = 4NO+6H2O,若 化 学 反 应 速 率 分 别 [ 单 位 :mol/(L · s)] 表 示 , 则 正 确 关 系 是 ( ) A. B. C. D. ( ) ( ) ( )3 3 3 2 1 1CH OH g = CH OCH g + H O l2 2 -1kJ m2 oldH∆ = ⋅ ( )3 2 2( ) ( )v NH v O v NO O)v(H、 、 、 3 24v NH =) 5v(O( ) 2 25v O =6) v(H( O) 3 22v NH =) 3v(H( O) ( )2( )4v O =5v NO 14. 甲 醇 质 子 交 换 膜 燃 料 电 池 中 将 甲 醇 蒸 气 转 化 为 氢 气 的 两 种 反 应 原 理 是 : ① CH3OH(g)+ H 2O(g)===CO2(g)+ 3H 2(g)Δ H= + 49.0 kJ· mol- 1 ② CH3OH(g)+ 1 2O2(g)===CO2(g)+ 2H 2(g)Δ H= - 192.9 kJ· mol- 1 下 列 说 法 正 确 的 是 ( ) A. CH 3OH 的 燃 烧 热 为 192.9 kJ· mol - 1 B. 反 应 ① 中 的 能 量 变 化 如 上 图 所 示 C. CH 3OH 转 变 成 H2 的 过 程 一 定 要 吸 收 能 量 D . 根 据 ② 推 知 反 应 : CH3OH(l) + 1 2O2(g)===CO2(g) + 2H2(g) 的 Δ H> - 192.9 kJ· mol- 1 15. 通 常 人 们 把 拆 开 1 mol 某 化 学 键 所 吸 收 的 能 量 看 成 该 化 学 键 的 键 能 。 键 能 的 大 小 可 用 于 估 算 化 学 反 应 的 反 应 热 (Δ H), 化 学 反 应 的 Δ H 等 于 反 应 中 断 裂 旧 化 学 键 的 键 能 之 和 与 反 应 中 形 成 新 化 学 键 的 键 能 之 和 的 差 。 化 学 键 A—A B—B A—B 生 成 1 mol 化 学 键 时 放 出 的 能 量 436 kJ· mol- 1 243 kJ· mol- 1 431 kJ· mol- 1 则 下 列 热 化 学 方 程 式 不 正 确 的 是 ( ) A. 1/2A 2(g)+ 1/2B 2(g)===AB(g) Δ H= - 91.5 kJ· mol - 1 B. A 2(g)+ B 2(g)===2AB(g) Δ H= - 183 kJ· mol - 1 C. 1/2A 2(g)+ 1/2B 2===AB(g) Δ H= + 91.5 kJ· mol - 1 D. 2AB(g)===A 2(g)+ B 2(g) Δ H= + 183 kJ· mol - 1 16. 已 知 : ① C(s)+ O 2(g)===CO2(g)Δ H= - 393.5 kJ/mol ② 2H2(g)+ O 2(g)===2H2O(l)Δ H= - 571.6 kJ/mol 现 有 0.2 mol 炭 粉 和 氢 气 组 成 的 悬 浮 气 ,在 氧 气 中 完 全 燃 烧 ,共 放 出 67.93 kJ 的 热 量 , 则 混 合 物 中 C 与 H2 的 物 质 的 量 之 比 为 ( ) A. 1∶ 1 B. 1∶ 2 C. 2∶ 3 D. 3∶ 2 17. 碘 与 氢 气 在 一 定 条 件 下 反 应 的 热 化 学 方 程 式 如 下 : (Ⅰ )I 2(g)+H2(g) 2HI(g) Δ H=-9.48kJ· mol- 1 (Ⅱ )I 2(s)+H2(g) 2HI(g) Δ H=+26.48kJ· mol- 1 下 列 判 断 正 确 的 是 ( ) A.在 一 定 条 件 下 将 2g H 2(g)通 入 254g I 2(g)中 ,该 过 程 放 出 的 热 量 为 9.48kJ B.1mol 固 态 碘 与 1mol 气 态 碘 所 含 的 能 量 相 差 17.00kJ C.反 应 (Ⅰ )的 产 物 比 反 应 (Ⅱ )的 产 物 稳 定 D.物 质 的 量 相 同 时 ,反 应 (Ⅰ )的 反 应 物 总 能 量 比 反 应 (Ⅱ )的 反 应 物 总 能 量 高 18.已 知 :① 2H 2(g)+O2(g)=2H2O(l) Δ H=-571.6kJ· mol- 1 ② 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) Δ H=-1452kJ· mol- 1 ③ H+(aq)+OH-(aq)=H2O(l) Δ H=-57.3kJ· mol- 1 下 列 说 法 正 确 的 是 ( ) A.H2(g)的 燃 烧 热 为 571.6kJ· mol - 1 B. H2SO4(aq)+ Ba(OH)2(aq)= BaSO4(s)+H2O(l) Δ Η =-57.3kJ· mol- 11 2 1 2 1 2 C.相 同 质 量 的 H 2(g)和 CH 3OH(l)完 全 燃 烧 ,H 2(g)放 出 的 热 量 多 D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) Δ Η =+131.4kJ· mol- 1 19. 反 应 A+B→ C(Δ Η <0)分 两 步 进 行 :① A+B→ X(Δ Η >0)② X→ C(Δ Η <0)下 列 示 意 图 中 ,能 正 确 表 示 总 反 应 过 程 中 能 量 变 化 的 是 ( ) A. B. C. D. 20.— 种 化 学 冰 袋 中 含 有 适 量 的 Na2SO4 · 10H2O、 NH 4NO3 、 (NH4)2SO4 、 NaHSO4, 将 Na2SO4 · 10H2O 和 其 他 三 种 盐 分 别 盛 于 两 只 塑 料 袋 中 ,使 用 时 将 它 们 混 合 并 用 手 揉 搓 就 可 制 冷 ,制 冷 效 果 能 维 持 2~ 3h。 以 下 关 于 制 冷 原 因 的 猜 测 肯 定 错 误 的 是 ( ) A.Na2SO4· 10H2O 脱 水 是 吸 热 过 程 B.制 冷 时 间 较 长 是 由 于 Na 2SO4· 10H2O 脱 水 是 较 慢 的 过 程 C.铵 盐 在 该 条 件 下 发 生 的 复 分 解 反 应 是 吸 热 过 程 D.NH4NO3 溶 于 水 会 吸 收 热 量 21.反 应 2A(s)+B(g) 2C(g)+D(g)经 2min 后 B 的 浓 度 减 少 0.6mol· L - 1,下 列 有 关 说 法 正 确 的 是 ( ) A.用 A 表 示 的 反 应 速 率 是 0.6mol· L - 1· min- 1 B.若 分 别 用 B、 C、 D 表 示 反 应 的 速 率 ,则 其 比 是 1:2:1 C.2min 末 时 的 反 应 速 率 用 反 应 物 B 来 表 示 0.3mol· L- 1· min- 1 D.在 2min 内 用 B 和 C 表 示 的 反 应 速 率 的 值 是 相 同 的 22.CaCO3 与 稀 盐 酸 反 应 (放 热 反 应 )生 成 CO 2 的 量 与 反 应 时 间 的 关 系 如 图 所 示 。 下 列 结 论 不 正 确 的 是 ( ) A.反 应 开 始 2 分 钟 内 平 均 反 应 速 率 最 大 B.反 应 4 分 钟 后 平 均 反 应 速 率 最 小 C.反 应 开 始 4 分 钟 内 温 度 对 反 应 速 率 的 影 响 比 浓 度 大 D.反 应 4 分 钟 后 反 应 速 率 下 降 的 原 因 是 盐 酸 浓 度 逐 渐 减 小 23. 为 探 究 、 与 盐 酸 (浓 度 为 )反 应 过 程 中 的 热 效 应 , 实 验 测 得 的 数 据 如 表 所 示 : 序 号 35mL 试 剂 固 体 混 合 前 温 度 /℃ 混 合 后 温 度 /℃ ① 水 2.5g 20.0 18.5 3NaHCO 2 3Na CO -11mol L⋅ 3NaHCO ② 水 3.2g 20.0 24.3 ③ 盐 酸 2.5g 20.0 16.2 ④ 盐 酸 3.2g 20.0 25.1 由 此 得 出 的 结 论 正 确 的 是 ( ) A. 固 体 与 盐 酸 的 反 应 是 吸 热 反 应 B. 固 体 与 盐 酸 的 反 应 是 放 热 反 应 C.20.0℃ 时 ,含 3.2g 的 饱 和 溶 液 和 35mL 盐 酸 混 合 后 的 温 度 将 低 于 25.1 ℃ D.20.0 ℃ 时 , 含 2.5g 的 饱 和 溶 液 和 35mL 盐 酸 混 合 后 的 温 度 将 低 于 16.2℃ 24. 将 固 体 NH4Br 置 于 密 闭 容 器 中 , 在 某 温 度 下 发 生 反 应 :NH4Br(s) NH3(g)+HBr(g),2HBr(g) Br2(g)+H2(g),2 min 后,测得 H2 的浓度为 0.5 mol·L-1,HBr 的浓 度为 4 mol·L-1,若上述反应速率用 v(NH3)表示,则 v(NH3)为( ) A.0.5 mol·L-1·min-1 B.2.5 mol·L-1·min-1 C.2 mol·L-1·min-1 D.1.25 mol·L-1·min-1 二 、 填 空 题 (共 52 分 ) 25.( 14 分 ) Ⅰ .2SO 2(g)+O2(g) 2SO3(g),反 应 过 程 的 能 量 变 化 如 图 所 示 : 已 知 2mol SO2(g)和 O 2(g)反 应 生 成 为 1mol SO 3(g)的 Δ Η =-99kJ· mol- 1,请 回 答 下 列 问 题 。 (1)该 反 应 通 常 用 V 2O5 作 催 化 剂 ,加 V 2O5 会 使 图 中 B 点 (填 “ 升 高 ” 或 “ 降 低 ” )。 (2)图 中 Δ Η = 。 (3)如 果 反 应 速 率 v(SO2)为 0.05mol· L - 1· min- 1,则 v(O2)= 。 Ⅱ .已 知 下 列 热 化 学 方 程 式 : ① H2O(l)===H2(g)+ 1 2O2(g)Δ H= + 285.8 kJ/mol 2 3Na CO 3NaHCO 2 3Na CO 2 3Na CO 3NaHCO 2 3Na CO 3NaHCO ② H2(g)+ 1 2O2(g)===H2O(g)Δ H= - 241.8 kJ/mol ③ NaOH(aq)+ HCl(aq)===NaCl(aq)+ H 2O(l) Δ H= - 57.3 kJ/mol ④ C(s)+ 1 2O2(g)===CO(g) Δ H= - 110.5 kJ/mol ⑤ C(s)+ O 2(g)===CO2(g) Δ H= - 393.5 kJ/mol 回 答 下 列 问 题 : (1)上 述 反 应 中 属 于 吸 热 反 应 的 是 。 (2)燃 烧 10 g H 2 生 成 液 态 水 , 放 出 的 热 量 为 。 (3)写 出 CO 燃 烧 的 热 化 学 方 程 式 。 写 出 制 水 煤 气 的 热 化 学 方 程 式 。 26.( 12 分 ) 实 验 室 用 50mL 0.50 盐 酸 、 50mL0.55 NaOH 溶 液 和 如 图 所 示 装 置 ,进 行 测 定 中 和 热 的 实 验 ,得 到 表 中 的 数 据 : 完 成 下 列 问 题 : ( 1) 实 验 时 不 能 用 铜 丝 搅 拌 棒 代 替 环 形 玻 璃 搅 拌 棒 的 理 由 是 。 实 验 中 使 用 环 形 玻 璃 搅 拌 棒 的 操 作 方 法 是 , ( 2) 在 操 作 正 确 的 前 提 下 ,提 高 中 和 热 测 定 准 确 性 的 关 键 是 。 ( 3) 根 据 表 中 所 测 数 据 进 行 计 算 ,则 该 实 验 测 得 的 中 和 热 = [盐 酸 和 NaOH 溶 液 的 密 度 按 1 计 算 , 反 应 后 混 合 溶 液 的 比 热 容 (c) 按 4.18 计 算 ]。 如 果 用 0.5mol/L 的 盐 酸 与 NaOH 固 体 进 行 实 验 ,则 实 验 中 测 得 的 中 和 热 将 (填 “ 偏 大 ” “ 偏 小 ” 或 “ 不 变 ” )。 ( 4) 若 某 同 学 利 用 上 述 装 置 做 实 验 ,有 些 操 作 不 规 范 ,造 成 测 得 中 和 热 数 值 偏 低 ,请 你 分 析 可 能 的 原 因 是 ( ) A.测 量 盐 酸 的 温 度 后 ,温 度 计 没 有 用 水 冲 洗 干 净 B.把 量 筒 中 的 氢 氧 化 钠 溶 -1mol L⋅ -1mol L⋅ H∆ -3g cm⋅ 1J (g )−⋅ ⋅℃ 液 倒 入 小 烧 杯 时 动 作 迟 缓 C.做 本 实 验 的 当 天 室 温 较 高 D.在 量 取 盐 酸 时 仰 视 读 数 E.大 烧 杯 的 盖 板 中 间 小 孔 太 大 27.( 14 分 ) 雾 霾 .已 经 成 为 部 分 城 市 发 展 的 障 碍 。 雾 霾 形 成 的 最 主 要 原 因 是 人 为 排 放 , 其 中 汽 车 尾 气 污 染 对 雾 霾 的 “ 贡 献 ” 逐 年 增 加 。 回 答 下 列 问 题 : (1)汽 车 尾 气 中 含 有 NO, N 2 与 O2 生 成 NO 的 过 程 如 下 : ① 1mol O2 与 1mol N2 的 总 能 量 比 2mol NO 的 总 能 量 ( 填 “ 高 ” 或 “ 低 ” ) 。 ② N2(g)+O2(g)═ 2NO(g)的 △ H= 。 ③ NO 与 CO 反 应 的 热 化 学 方 程 式 可 以 表 示 为 2NO(g)+2CO(g) 2CO2(g)+N2(g)△ H= a kJ· mol - 1, 但 该 反 应 速 率 很 慢 , 若 使 用 机 动 车 尾 气 催 化 转 化 器 , 可 以 使 尾 气 中 的 NO 与 CO 转 化 成 无 害 物 质 排 出 。 上 述 反 应 在 使 用 “ 催 化 转 化 器 ” 后 , a 值 ( 选 填 “ 增 大 ” “ 减 小 ” 或 “ 不 变 ” ) 。 (2)氢 能 源 是 绿 色 燃 料 ,可 以 减 少 汽 车 尾 气 的 排 放 ,利 用 甲 醇 与 水 蒸 气 反 应 可 以 制 备 氢 气 : CH3OH(g)+H2O(g)═ CO 2(g)+3H2(g)△ H 1. 下 图 是 该 反 应 的 能 量 变 化 图 : ① 过 图 中 信 息 可 判 断 反 应 CH3OH(g)+H2O(g)═ CO 2(g)+3H2(g)的 △ H 1 ( 选 填 “ > ” “ = ” 或 “ < ” ) 0。 ② 图 中 途 径 ( Ⅱ ) 的 条 件 是 , 途 径 ( Ⅰ ) 的 反 应 热 ( 选 填 “ >” “ =” 或 “ <” ) 途 径 ( Ⅱ ) 的 反 应 热 。 ③ 已 知 下 列 两 个 热 化 学 方 程 式 : 2CH3OH(g)+3O2(g)═ 2CO 2(g)+4H2O(g) △ H2 ( ) ( ) ( )2 2 2 3 1H g O g H O g H2 + = △ △ H1、 △ H2、 △ H3 三 者 的 关 系 式 为 : 。 28. ( 12 分 ) 某化学兴趣小组设计实验探究反应速率的测定和比较。 [实验步骤] Ⅰ.取一套装置(装置如下图所示),加入 40 1 的硫酸,测量收集 10 所需 的时间。 Ⅱ.取另一套装置,加入 40 4 的硫酸,测量收集 10 所需的时间。 (1)[实验现象] 锌跟硫酸反应产生气泡,收集 10 气体, Ⅱ所用时间比Ⅰ所用时间__________。 (2)[实验结论] 4 硫酸与锌反应比 1 硫酸与锌反应速率__________ 。 (3)[注意事项] a.锌粒的颗粒(即表面积)大小__________ ; b.40 硫酸要迅速加入; c.装置__________ ,且计时要迅速、 准确; d.气体收集可以用排水量气装置代替。 (4)实验讨论]除本实验测定反应速率的方法外,可行的方案还有(填两条): a.__________ ; b.__________ ; 化学参考答案 一.选择题(每空 2 分,共 48 分) mL 1mol L −⋅ mL 2H mL 1mol L −⋅ mL 2H mL 1mol L−⋅ 1mol L−⋅ mL 1-5 BCDCB 6-10 CADDB 11-15 DCDDC 16-20 ADCDC 21-24BABB 二.填空题(共 52 分) 25.(每空 2 分,共 14 分) Ⅰ .(1)降低 (2)-198 kJ· mol -1 (3)0.025 mol· L-1· min-1 Ⅱ . (1)①(2) 1429 kJ (3)CO(g)+1 2 O2(g)===CO2(g)ΔH=-283 kJ/mol (4)C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ/mol 26. (每空 2 分,共 12 分) (1)Cu 传热快,热量损失大 上下抽动 (2)提高装置的保温效果 (3)-56.8 偏大 (4)ABE 27. (每空 2 分,共 14 分) (1) ①低 ②+91.5 kJ· mol-1 ③ 不 变 (2) ①> ②使用催化剂 = ③ △ H3=△ H 1+△ H 2 28. (每空 2 分,共 12 分) (1) 短 (2)大 (3)基本相同 气密性良好 (4)(填两条即可)a.测定一段时间内产生 的体积 b.测定一段时间内 的农度变化 c.测定一段时间内锌粒质量的变化 kJ/ mol 2H H +查看更多