- 2021-04-14 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习电化学基础作业
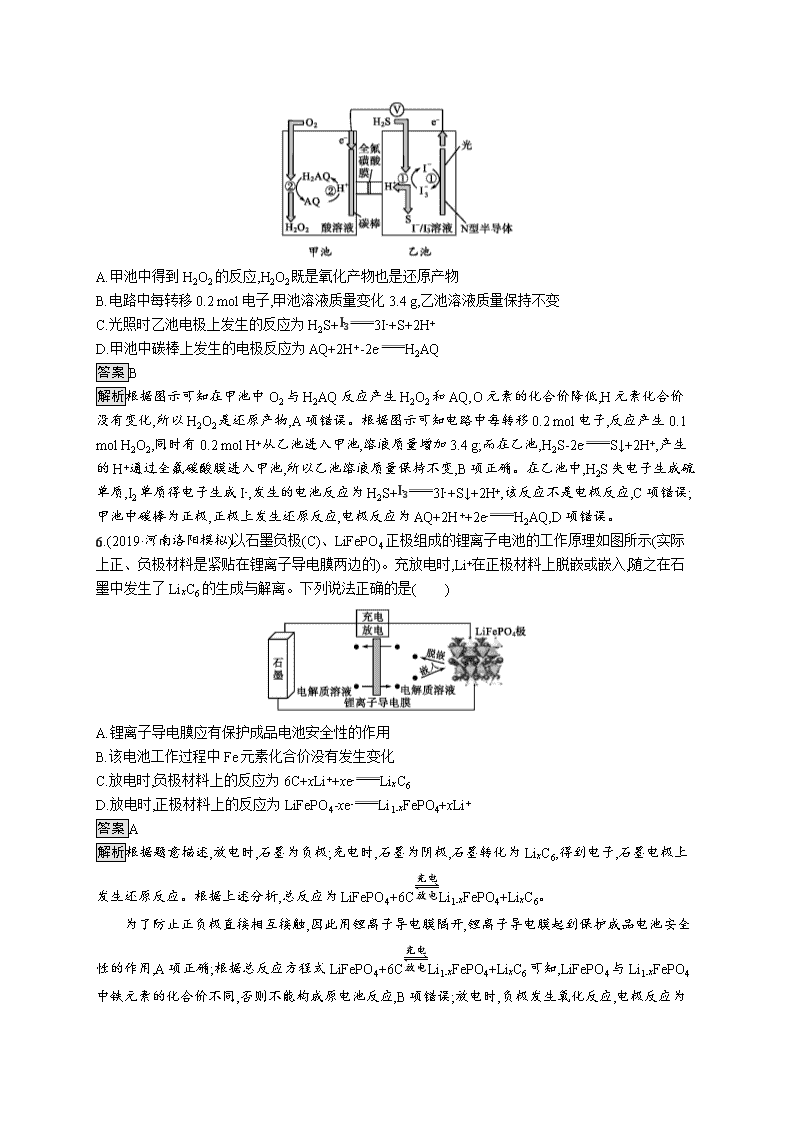
题型专练(六) 电化学基础 1.(2019·辽宁葫芦岛一模)据报道,我国已研制出“可充室温钠—二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠四甘醇二甲醚溶液,电池总反应为4Na+3CO22Na2CO3+C,生成的固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是( ) A.放电时钠金属片发生氧化反应 B.放电时吸收CO2,充电时释放CO2 C.放电时Na+向碳纳米管移动 D.放电时的负极反应为2Na+CO32--2e-Na2CO3 答案D 解析放电时钠金属片作负极,失去电子发生氧化反应,A项正确;放电时正极上吸收CO2气体,CO2中的C原子得到电子,被还原生成C单质,充电时C单质失去电子,与Na2CO3反应变为CO2气体,同时产生金属Na,B项正确;放电时Na+向正极碳纳米管方向移动,C项正确;放电时负极上的Na失去电子,负极反应为Na-e-Na+,D项错误。 2.(2019·河北唐山一模)研究人员研发了一种“水电池”,这种电池能利用淡水与海水之间含盐量的差别进行发电。在海水中,电池总反应可表示为5MnO2+2Ag+2NaClNa2Mn5O10+2AgCl。下列有关“水电池”在海水中放电时的说法正确的是( ) A.正极反应式:Ag+Cl-+e-AgCl B.每生成1 mol Na2Mn5O10转移4 mol电子 C.Na+向“水电池”的负极移动 D.AgCl是氧化产物 答案D 解析该电池的正极反应为5MnO2+2e-Mn5O102-,负极反应为Ag+Cl--e-AgCl,A项错误;由电池总反应方程式可知,每生成1 mol Na2Mn5O10转移2 mol电子,B项错误;电池放电过程中钠离子向正极移动,C项错误;负极上Ag失电子被氧化,故AgCl是氧化产物,D项正确。 3.(2019·湖北部分重点中学第二次联考)高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。 ①Al2O3(s)+AlCl3(g)+3C(s)3AlCl(g)+3CO(g) ΔH1=a kJ· mol-1 ②3AlCl(g)2Al(l)+AlCl3(g) ΔH2=b kJ· mol-1 ③Al2O3(s)+3C(s)2Al(l)+3CO(g) ΔH3 下列说法正确的是( ) A.该电池放电时的负极反应为Al-3e-+7AlCl4-4Al2Cl7- B.ΔH2<0 C.该电池充电时石墨电极与电源负极相连 D.Al2O3(s)+3C(s)2Al(l)+3CO(g) ΔH3=(a-b) kJ· mol-1 答案A 解析放电时铝为负极,失电子被氧化生成Al3+,Al3+和AlCl4-反应生成Al2Cl7-,所以负极反应方程式为Al-3e-+7AlCl4-4Al2Cl7-,A正确;反应②3AlCl(g)2Al(l)+AlCl3(g)是分解反应,大多数分解反应是吸热反应,所以ΔH2>0,B项错误;放电时铝为负极被氧化,石墨电极为正极发生还原反应,充电时石墨电极作阳极发生氧化反应,所以该电池充电时石墨电极与电源正极相连,C项错误;根据盖斯定律:①+②=③,因此Al2O3(s)+3C(s)2Al(l)+3CO(g) ΔH3=(a+b)kJ· mol-1,D项错误。 4.(2019·湖北部分重点中学起点考试)硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是( ) A.当电路中通过1 mol电子时,可得到1 mol H3BO3 B.将电源的正、负极反接,工作原理不变 C.阴极上的电极反应为2H2O-4e-O2+4H+ D.B(OH)4-穿过阴膜进入阴极室,Na+穿过阳膜进入产品室 答案A 解析阳极电极反应为2H2O-4e-O2↑+4H+,阴极电极反应为4H2O+4e-2H2↑+4OH-,阳极室中的氢离子通过阳膜进入产品室,原料室中的B(OH)4-穿过阴膜进入产品室,发生反应B(OH)4-+H+H2O+H3BO3获得产品。 电路中通过1 mol电子时,阳极上有1 mol H+生成,生成1 mol硼酸需要1 mol H+,所以电路中通过1 mol电子时,可得到1 mol H3BO3,A项正确;如果将电源的正、负极反接,工作原理发生变化,B项错误;电解时阴极发生得到电子的还原反应,电极反应式为4H2O+4e-2H2↑+4OH-,C项错误;阳极电极反应为2H2O-4e-O2↑+4H+,阴极电极反应为4H2O+4e-2H2↑+4OH-,阳极室中的氢离子通过阳膜进入产品室,B(OH)4-穿过阴膜进入产品室,发生反应B(OH)4-+H+H2O+H3BO3,Na+穿过阳膜进入阴极室,D项错误。 5.(2019·湖北名校联盟三模)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应如图所示。下列说法正确的是( ) A.甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物 B.电路中每转移0.2 mol电子,甲池溶液质量变化3.4 g,乙池溶液质量保持不变 C.光照时乙池电极上发生的反应为H2S+I3-3I-+S+2H+ D.甲池中碳棒上发生的电极反应为AQ+2H+-2e-H2AQ 答案B 解析根据图示可知在甲池中O2与H2AQ反应产生H2O2和AQ,O元素的化合价降低,H元素化合价没有变化,所以H2O2是还原产物,A项错误。根据图示可知电路中每转移0.2 mol电子,反应产生0.1 mol H2O2,同时有0.2 mol H+从乙池进入甲池,溶液质量增加3.4 g;而在乙池,H2S-2e-S↓+2H+,产生的H+通过全氟碳酸膜进入甲池,所以乙池溶液质量保持不变,B项正确。在乙池中,H2S失电子生成硫单质,I2单质得电子生成I-,发生的电池反应为H2S+I3-3I-+S↓+2H+,该反应不是电极反应,C项错误;甲池中碳棒为正极,正极上发生还原反应,电极反应为AQ+2H++2e-H2AQ,D项错误。 6.(2019·河南洛阳模拟)以石墨负极(C)、LiFePO4正极组成的锂离子电池的工作原理如图所示(实际上正、负极材料是紧贴在锂离子导电膜两边的)。充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LixC6的生成与解离。下列说法正确的是( ) A.锂离子导电膜应有保护成品电池安全性的作用 B.该电池工作过程中Fe元素化合价没有发生变化 C.放电时,负极材料上的反应为6C+xLi++xe-LixC6 D.放电时,正极材料上的反应为LiFePO4-xe-Li1-xFePO4+xLi+ 答案A 解析根据题意描述,放电时,石墨为负极;充电时,石墨为阴极,石墨转化为LixC6,得到电子,石墨电极上发生还原反应。根据上述分析,总反应为LiFePO4+6CLi1-xFePO4+LixC6。 为了防止正负极直接相互接触,因此用锂离子导电膜隔开,锂离子导电膜起到保护成品电池安全性的作用,A项正确;根据总反应方程式LiFePO4+6CLi1-xFePO4+LixC6可知,LiFePO4与Li1-xFePO4中铁元素的化合价不同,否则不能构成原电池反应,B项错误;放电时,负极发生氧化反应,电极反应为 LixC6-xe-6C+xLi+,C项错误;放电时,Li1-xFePO4在正极上得电子发生还原反应,电极反应为Li1-xFePO4+xLi++xe-LiFePO4,D项错误。 7.(2019·河南开封一模)某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是( ) A.放电时,负极的电极反应为Li-e-Li+ B.放电时,电子通过电解质从Li流向Fe2O3 C.充电时,Fe做阳极,电池逐渐摆脱磁铁吸引 D.充电时,阳极的电极反应为2Fe+3Li2O-6e-Fe2O3+6Li+ 答案B 解析由图可知:该电池在充、放电时的反应为6Li+Fe2O33Li2O+2Fe;放电时负极发生氧化反应,正极发生还原反应;充电时阳极、阴极电极反应式与放电时的正极、负极电极反应式正好相反。 该电池在放电时Li为负极,失去电子,发生氧化反应,电极反应式是Li-e-Li+,A项正确;放电时,电子通过外电路从负极Li流向正极Fe2O3,不能经过电解质,B项错误;充电时,Fe做阳极,失去电子,发生氧化反应,被氧化变为Fe2O3,Fe2O3不能被磁铁吸引,故电池逐渐摆脱磁铁吸引,C项正确;充电时,阳极失去电子,发生氧化反应,该电极反应式为2Fe-6e-+3Li2OFe2O3+6Li+,D项正确。 8.(2019·河北石家庄教学质量检测)新型镁—锂双离子二次电池如图所示,下列关于该电池的说法不正确的是( ) A.放电时,Li+由左向右移动 B.放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-LiFePO4 C.充电时,外加电源的正极与Y相连 D.充电时,导线上每通过1 mol e-,左室溶液质量减轻12 g 答案D 解析放电时,左边镁为负极,失电子发生氧化反应,电极反应式为Mg-2e-Mg2+;右边为正极得电子发生还原反应,电极反应式为Li1-xFePO4+xLi++xe-LiFePO4,阳离子移向正极;充电时,外加电源的正极与正极相连,负极与负极相连。 放电时为原电池,原电池中阳离子移向正极,所以Li+由左向右移动,A项正确;放电时,右边电极为正极,得电子发生还原反应,电极反应式为Li1-xFePO4+xLi++xe-LiFePO4,B项正确;充电时,外加电源的正极与正极相连,所以外加电源的正极与Y相连,C项正确;充电时,左室电极反应式为Mg2++2e-Mg,右侧将有1 mol Li+移向左室,所以导线上每通过1 mol e-,左室溶液质量减轻12 g-7 g=5 g,D项错误。 9.(2019·湖南益阳模拟)对废水中氮、磷元素的去除已经逐渐引起科研人员的广泛关注。采用两级电解体系对废水中硝态氮和磷进行降解实验取得了良好的去除效果。装置如图所示,由平板电极(除氮时a极为催化电极,b极为钛电极;除磷时a极为铁,b极为钛板)构成二维两级电解反应器。下列说法错误的是( ) A.a电极上的电势比b电极上的电势高 B.除氮时,b极的电极反应式为2NO3-+10e-+6H2ON2↑+12OH- C.除磷的反应可能为Fe3++PO43-FePO4↓、3Fe2++2PO43-Fe3(PO4)2↓ D.钛极产生的气体能发生气浮作用,使溶液中颗粒物漂浮至表面而被去除 答案B 解析该装置为电解池,当除氮时,从图中可知b电极上发生的反应为2NO3-+10e-+12H+N2↑+6H2O,故b电极为阴极,a电极为阳极,a电极上的电势比b电极上的电势高,A项正确;除氮时,因电解质溶液为酸性,故b极的电极反应为2NO3-+10e-+12H+H2↑+6H2O,B项错误;除磷时a极为铁,电极反应为Fe-2e-Fe2+,除磷反应为Fe3++PO43-FePO4↓、3Fe2++2PO43-Fe3(PO4)2↓,C项正确;钛极产生的气体形成细微的小气泡,有利于颗粒物漂浮至表面而被去除,D项正确。 10.(2019·河北保定模拟)用以葡萄糖为燃料的生物燃料电池甲与盛有足量硫酸铜溶液的装置乙相连,起始电路接入状况如图,以电流强度0.1 A通电10 min后,将电池的正、负极互换接入,移动滑动变阻器:以电流强度0.2 A,继续通电10 min,结束实验。下列有关说法正确的是( ) A.葡萄糖在装置甲的正极参加反应,氧气在负极参加反应 B.在该电池反应中,每消耗1 mol氧气理论上能生成标准状况下二氧化碳11.2 L C.电池工作20 min时,乙装置电极析出固体和电极上产生气体的质量比为2∶1 D.电池工作15 min时,乙装置中铜棒的质量与起始通电前相等 答案D 解析燃料电池的负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-6CO2↑+24H+;正极是氧气得电子在酸性条件下产生水,电极反应式为6O2+24H++24e-12H2O;碳棒连接燃料电池的负极作阴极,铜棒连接燃料电池的正极作阳极,硫酸铜溶液为电解质溶液,相当于在碳棒上镀铜。 葡萄糖在装置甲的负极参加反应,氧气在正极参加反应,A项错误;在该电池反应中,每消耗1 mol氧气,理论上能生成1 mol二氧化碳,标准状况下二氧化碳的体积为22.4 L,B项错误;乙池工作前10 min,铜棒反应为Cu-2e-Cu2+,碳棒反应为Cu2++2e-Cu;将电池正、负极反接后的5 min,依据电子守恒,铜棒析出的铜与碳棒上溶解的铜相等,乙装置恰好复原;乙池工作的后5 min,铜棒反应为Cu2++2e-Cu,碳棒反应为2H2O+4e-O2↑+4H+,依据电子守恒,m(Cu)m(O2)=2×6432=41,C项错误;电池工作15 min时,乙装置中正、负极互换前后所通过的电量相等,前10 min铜失电子减少的质量与后5 min铜离子得电子产生铜的质量相等,D项正确。 11.(2019·湖北武昌调研)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,利用图示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法正确的是( ) A.a室排出的是NaOH、Ca(OH)2等强碱性物质 B.b室发生的主要反应:2H++CO32-H2O+CO2↑ C.c室发生的反应为2H2O-4e-O2↑+4H+ D.装置中产生的O2和提取的CO2的体积比约为1∶4 答案D 解析a室电极与电源正极相连,是电解池阳极,电极反应为2H2O-4e-O2↑+4H+,H+通过阳离子交换膜进入b室,A项错误;a室生成的H+通过阳离子交换膜进入b室,与主要含碳粒子发生反应HCO3-+H+H2O+CO2↑,B项错误;c室电极与电源负极相连,是电解池阴极,电极反应为2H2O+2e-H2↑+2OH-,b室海水中阳离子通过离子交换膜进入c室,故c室排出的是NaOH、Ca(OH)2等强碱性物质,C项错误;据阳极反应和b室反应可知,装置中产生的O2和提取的CO2的体积比约为1∶4,D项正确。 12.(2019·河北中原名校联盟)一种电催化合成氨的装置如图所示。该装置工作时,下列说法正确的是( ) A.图中涉及的能量转化方式共有3种 B.两极产生的气体的物质的量之比是1∶1 C.电路中每通过1 mol电子,有1 mol H+迁移至a极 D.b极上发生的主要反应为N2+6H++6e-2NH3 答案D 解析该装置包含多种能量转化,主要能量转化有:太阳能→电能,风能→机械能→电能,电能→化学能,另外还可能有其他能量转化为热能等,A项错误。生成氧气的a极是电解池的阳极,电极反应式为2H2O-4e-O2↑+4H+;生成氨气的b极是阴极,电极反应式为N2+6H++6e-2NH3;由得失电子数目守恒可知,两极生成氧气和氨气的理论物质的量之比是3∶4,B项错误。电解时,阳离子向阴极移动,H+应向b极迁移,C项错误。电解时,生成氨气的b极是阴极,阴极上氮气放电生成氨气,电极反应式为N2+6H++6e-2NH3,D项正确。 13.(2019·陕西二模)C-Na2MnO4电池是科学家正在研发的新型钠离子电池中的一种,其充放电原理如图所示,放电时的总反应为xNa+Na2MnO4Na(2+x)MnO4。下列说法错误的是( ) A.放电时,左电极为负极,材料为金属钠 B.该电池可用Na2MnO4中性水溶液作为电解液 C.充电时,右电极与电源正极相连,发生氧化反应 D.充电时,阳极反应式为Na(2+x)MnO4-xe-xNa++Na2MnO4 答案B 解析放电时,钠离子流向右电极,说明左电极为负极,材料为金属钠,右电极为正极,A项正确;金属钠是活泼金属,极易与水发生反应,所以该电池不可用Na2MnO4中性水溶液作为电解液,B项错误;原电池中右电极为正极,充电时,右电极与电源正极相连,发生氧化反应,C项正确;充电时,阳极发生氧化反应,阳极反应式为Na(2+x)MnO4-xe-xNa++Na2MnO4,D项正确。 14.(2019·广东深圳第二次调研)电解法处理CO2和SO2混合污染气的原理如下图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( ) A.Ni电极表面发生了还原反应 B.阳极的电极反应为2O2--4e-O2 C.电解质中发生的离子反应有:2SO2+4O2-2SO42- D.该过程实现了电解质中碳酸盐和硫酸盐的自补充循环 答案C 解析由图示原理可知,Ni电极表面发生了还原反应,A项正确;阳极发生失电子的氧化反应,电极反应为2O2--4e-O2↑,B项正确;电解质中发生的离子反应有:2SO2+O2+2O2-2SO42-和CO2+O2-CO32-,C项错误;该过程中在SO42-和CO32-被还原的同时又不断生成SO42-和CO32-,实现了电解质中碳酸盐和硫酸盐的自补充循环,D项正确。 15.(2019·四川达州二诊)碱性锌锰电池(电极材料为Zn和MnO2,电解质为KOH)有着很广泛的应用,其电池总反应为:Zn+2MnO2+2H2O2MnOOH+Zn(OH)2。下列有关碱性锌锰电池的说法正确的是( ) A.Zn为正极,MnO2为负极 B.工作时电子由MnO2极经外电路流向Zn极 C.负极的电极反应为Zn+2OH--2e-Zn(OH)2 D.工作时消耗1 mol MnO2,理论上生成氧化产物1 mol 答案C 解析由碱性锌锰电池的总反应:Zn+2MnO2+2H2O2MnOOH+Zn(OH)2可知,MnO2得电子被还原生成MnOOH,为正极,Zn失去电子,为负极,A项错误;电池工作时,外电路中电子由负极Zn经外电路流向正极MnO2,B项错误;Zn失去电子生成Zn(OH)2,电极反应为Zn+2OH--2e-Zn(OH)2,C项正确;电池正极的反应为2MnO2+2H2O+2e-2MnOOH+2OH-,根据电子守恒,工作时消耗1 mol MnO2,理论上生成氧化产物12 mol,D项错误。 16.(2019·湘赣十四校联考第一次考试)乙醛酸()是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如下图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法正确的是( ) A.若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为2 mol B.M电极上的电极反应式为:OHC—CHO+2e-+H2OHOOC—CHO+2H+ C.M极与电源的负极相连 D.电解一段时间后,N极附近溶液的pH变小 答案A 解析电解过程中阳离子向阴极移动,由装置示意图可知,H+由左室移向右室,则M电极是电解池的阳极,氯离子在阳极上失电子发生氧化反应生成氯气,电极反应式为2Cl--2e-Cl2↑,然后氯气在水溶液中将乙二醛氧化为乙醛酸,OHC—CHO+Cl2+H2OHOOC—CHO+2Cl-+2H+;N极为电解池的阴极,乙二酸在阴极得电子发生还原反应生成乙醛酸,电极反应式为HOOC—COOH+2H++2e-HOOC—CHO+H2O。 2 mol H+通过质子交换膜,则电路中转移2 mol电子,由阴极的电极反应式HOOC—COOH+2H++2e-HOOC—CHO+H2O和阳极区的反应:2Cl--2e-Cl2↑,OHC—CHO+Cl2+H2OHOOC—CHO+2Cl-+2H+可知,两极各生成1 mol乙醛酸,共生成2 mol乙醛酸,A项正确;M电极是电解池的阳极,氯离子在阳极上失电子发生氧化反应生成氯气,电极反应式为2Cl--2e-Cl2↑,B项错误;M电极是电解池的阳极,与电源的正极相连,C项错误;N极为电解池的阴极,若有2 mol H+通过质子交换膜进入阴极室,则电路中转移2 mol电子,阴极的电极反应式为HOOC—COOH+2e-+2H+HOOC—CHO+H2O,则阴极反应消耗的H+与迁移过来的H+物质的量相等,但由于乙二酸生成了乙醛酸,分子中羧基减少,故N极附近溶液的pH不会减小,只能变大,D项错误。查看更多