化学卷·2018届云南省曲靖市沾益县第一中学高二上学期第一次月考化学试卷 (解析版)
高二化学月考
相对原子质量:O:16 C:12 H:1 N:14
一、选择题:(每小题只有一个正确答案,共42分)
7.已知25℃、101kPa条件下:4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = - 2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = - 3119.91kJ/mol。由此得出的结论正确的是( )
A.等质量的O2比O3能量低,由O2变O3 为吸热反应
B.等质量的O2比O3能量低,由O2变O3 为放热反应
C.O3比O2稳定,由O2变O3 为吸热反应
D.O2比O3稳定,由O2变O3 为放热反应
考点:化学反应与能量变化
答案:A
试题解析:从反应的热效应看,铝与臭氧反应放出的热量多,说明O3的内能高,由O2变O3 为吸热反应,O2比O3稳定。故正确说法为A。
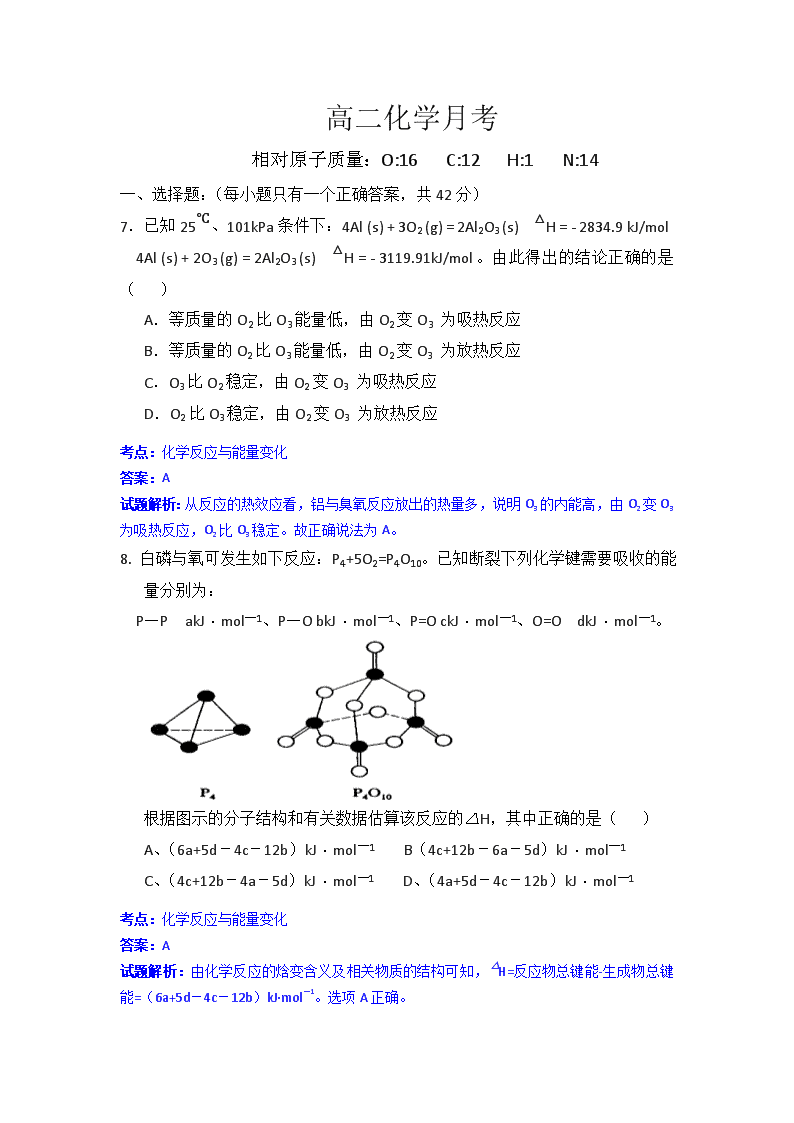
8. 白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:
P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A、(6a+5d-4c-12b)kJ·mol—1 B(4c+12b-6a-5d)kJ·mol—1
C、(4c+12b-4a-5d)kJ·mol—1 D、(4a+5d-4c-12b)kJ·mol—1
考点:化学反应与能量变化
答案:A
试题解析:由化学反应的焓变含义及相关物质的结构可知,△H=反应物总键能-生成物总键能=(6a+5d-4c-12b)kJ·mol—1。选项A正确。
9.已知化学反应2C(s)+O2(g)2CO(g);2CO(g) + O2(g) 2CO2(g)都是放热反应。【来.源:全,品…中&高*考*网】
据此推断,下列说法不正确的是(相同条件下) ( )【来.源:全,品…中&高*考*网】
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.12gC所具有的能量一定高于28gCO所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
考点:化学反应与能量变化
答案:B
试题解析:CO的燃烧是C不完全燃烧的继续,从两个放热反应看,ACD均正确;12gC与8g的氧气所具有的总能量一定高于28gCO所具有的能量,故B说法错误。
10.已知:2CO(g)+O2 (g)=2CO2(g)
ΔH= - 566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ ΔH= - 226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>- 452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
考点:化学反应与能量变化
答案:
试题解析:A的单位错误,B中图表示的是能量关系,没有过程,CO(g)与Na2O2(s)反应转移数6.02×1023电子时,放出226kJ的热量。CO2(s)反应时,放出热量少,ΔH>- 452 kJ/mol。正确选项C。
11.下列热化学方程式正确的是(的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H= +57.3kJ/mol
(中和热)
C.S(s)+O2(g)===SO2(g);△H= —269.8kJ/mol(反应热)
D. 2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
考点:化学反应热的计算
答案:C
试题解析:A应生成液态水,B应是放热的,D没有写明物质的状态;只有C是正确的。
12.已知在298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g) △H1 = -110.5kJ/mol C(s)+O2(g)=CO2(g), △H 2= -393.5kJ/mol 则C(s)+CO2(g)=2CO(g) 的△H 为
A.+283.5kJ/mo B. + 172.5kJ/mol C. -172.5kJ/mol D. -504 kJ/mol
考点:化学反应热的计算
答案:
试题解析:
13.相同温度下,有下列三个热化学方程式:【来.源:全,品…中&高*考*网】(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2
Q1 >Q3
C. Q3> Q2> Q1 D. Q1=Q2=Q3
考点:化学反应热的计算
答案:B
试题解析:气态氢气燃烧生成液态水时,放出的热量最多,液态氢气燃烧生成气态水放出热量最少,故正确答案为B。
二、填空题
26.(15分)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)====CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量______(填“>”、“<”或“=”)890.3 kJ。
【来.源:全,品…中&高*考*网】
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2==== 2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①上图(所有物质均为气态)能表示该反应过程中能量变化的是__________(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为 。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)====CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)====CH4(g)的反应热ΔH= 。【来.源:全,品…中&高*考*网】
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B. 将固态碳合成为C60,以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
考点:化学反应热的计算
答案:
试题解析:(1)由盖斯定律及能量守恒,他们放出的能量应是相等的。
(2)①该反应16g甲烷完全反应放出热量15.46×16=247.36KJ,D图像是正确的。
②若放出155.8KJ的热量,则CH4的转化率为155.8/247.36×100%=63%
(3)由盖斯定律,ΔH==ΔH2+ΔH3--ΔH1=74.8 kJ·mol-1
(4)催化剂不能改变反应的能量关系,A错误;B的措施能量不会改变。也不对;C方法可行。
27、(12分)①CaCO3 (s) == CaO + CO2(g);ΔH= 177.7kJ/mol
②C(s) + H2O(g)== CO(g) + H2(g);ΔH= -131.3kJ/mol
③1/2 H2SO4(l) + NaOH(l) == 1/2 Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) == CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) == CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) == NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) == 2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有( )
(2)根据上述信息,写出C转化为CO的热化学方程式______________________________。
(3)上述正确的反应中,表示燃烧热的热化学方程式有( );
(4)表示中和热的热化学方程式有( )。
考点:燃烧热、能源
答案:
试题解析:(1)方程式①没有标明CaO的状态,②反应是吸热的,③ 反应的物质是溶液,不是液体;其他方程式均正确。
(2)由盖斯定律,方程式④-⑤得:C(s) + 1/2 O2(g) == CO (g);ΔH=-110.5kJ/mol
(3)由燃烧热的定义④⑤表示燃烧热的热化学方程式;
(4)方程式⑥表示中和热的热化学方程式
28.(15分)请认真观察下图,然后回答问题:
①图中所示反应是_______(填“吸热”或“放热”)反应,该反应______(填“需要”或“不需要”)加热,该反应的
ΔH= kJ/mol(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+O2(g)====H2O(g)
ΔH=-241.8 kJ/mol。该反应的活化能为167.2
kJ/mol,则其逆反应的活化能为_________________kJ/mol。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:________________。
36.(16分)依据事实,写出下列反应的热化学方程式。
(1) 在25℃、101kPa下,1g甲醇CH3OH(液态)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________________
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。
____________________________________________________________________
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,
每有5NA个电子转移时,放出650kJ的热量。___________________________________
(4)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、
946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
考点:化学反应与能量变化
答案:(1)CH3OH(l)+O2(g)==CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1(2)N2(g)+2O2(g)=2NO2(g) ΔH=67.8kJ·mol-1(3)C2H2(g)+O2(g)==2CO2(g)+H2O(l) ΔH=–1300kJ·mol-1(4)N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-解析过程:(1)由题给,1mol的甲醇燃烧放出热量为22.68kJ ×32=725.76kJ ,故甲醇的燃烧热的热化学方程式为:CH3OH(l)+O2(g)==CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1(2)生成2mol的NO2放出热量16.95×4=67.8kJ ,故N2(g)+2O2(g)=2NO2(g) ΔH=67.8kJ·mol-1(3)1mol的乙炔燃烧转移10mol电子,故有:C2H2(g)+O2(g)==2CO2(g)+H2O(l) ΔH=–1300kJ·mol-1(4)由焓变的定义,反应N2(g)+3H2(g)=2NH3(g)的ΔH=946kJ +3×436kJ-2×3×391kJ=-92kJ·mol-
答案
题号
7
8
9
10
11
12
13
答案
A
A
B
C
C
B
B
26.(1)= (2)①D ②63%
(3)-74.8 kJ·mol-1 (4)C
27.(1)①②③
(2)C(s) + 1/2 O2(g) == CO (g);ΔH=-110.5kJ/mol
(3)④⑤;⑥
28.①放热 需要 E2-E1
②409 ③使用了催化剂
36.(1) CH3OH(l)+O2(g)==CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
(2)N2(g)+2O2(g)=2NO2(g) ΔH=67.8kJ·mol-1【来.源:全,品…中&高*考*网】
(3)C2H2(g)+O2(g)==2CO2(g)+H2O(l) ΔH=–1300kJ·mol-1
(4)N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1