- 2021-04-14 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省南昌市安义中学2019-2020学年高二上学期期中考试化学试题
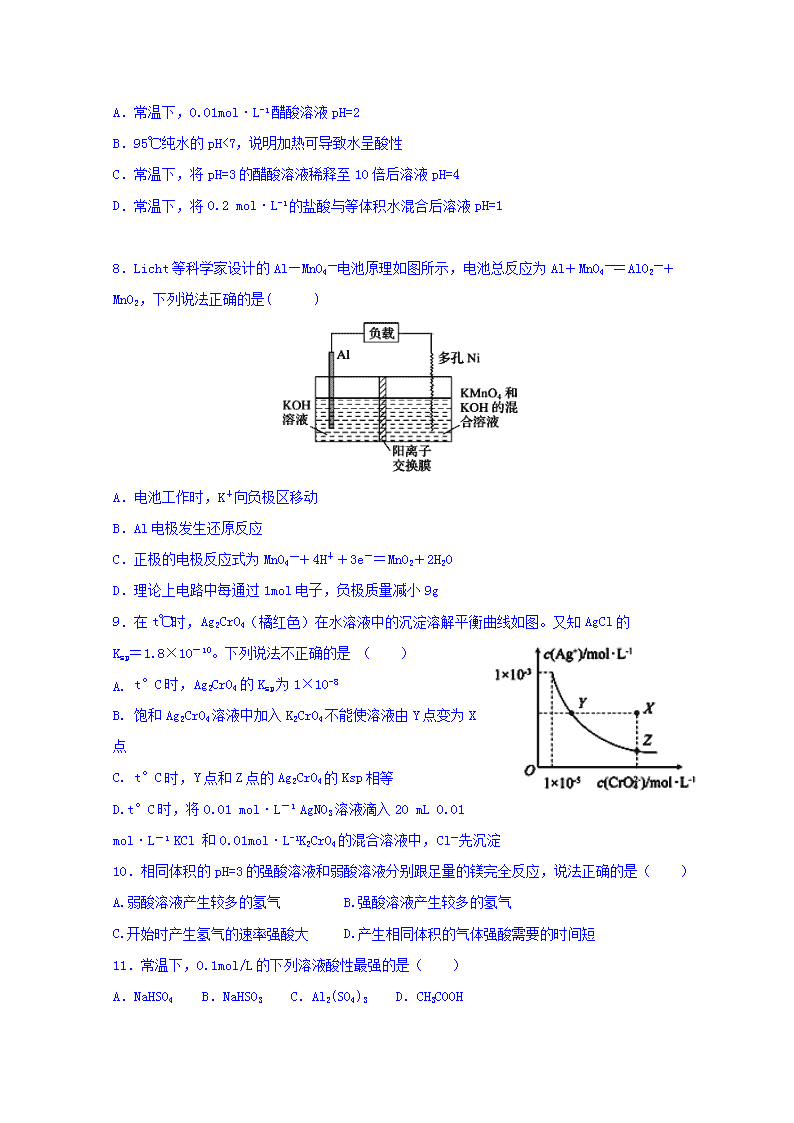
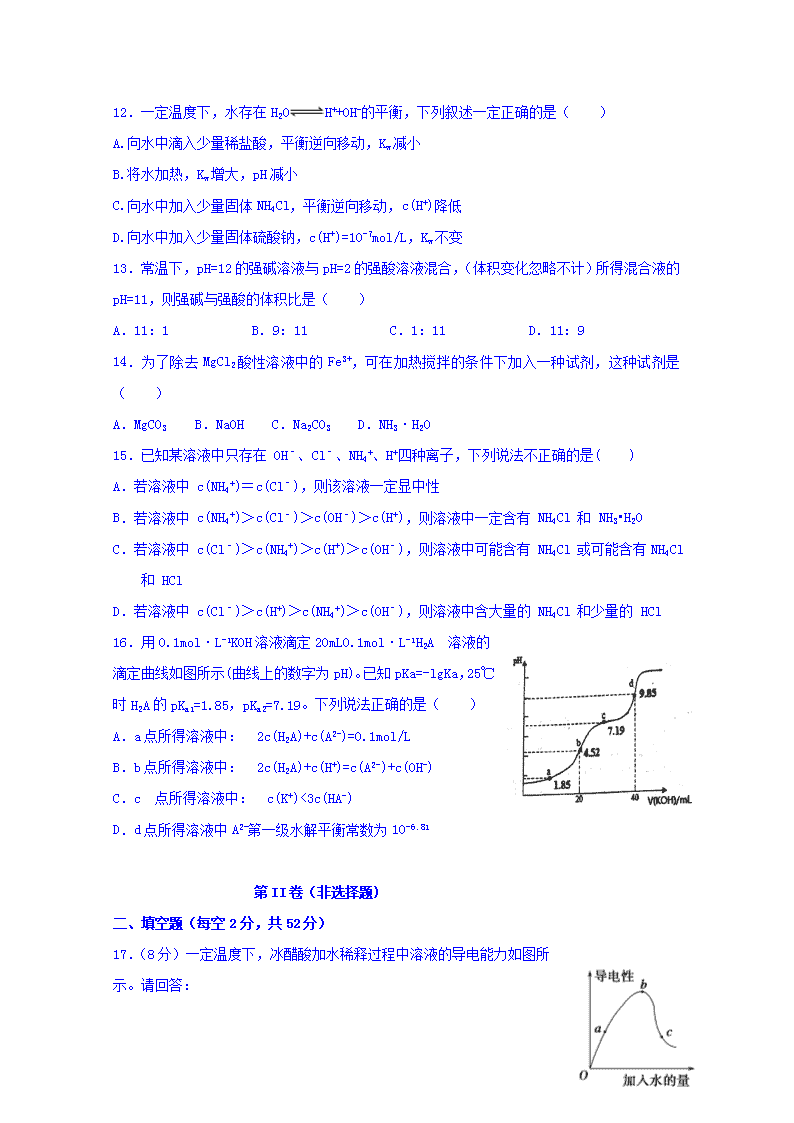
安义中学2019-2020学年度第一学期期中考试 高二化学试卷 分值: 100分 时间 :100分钟 第I卷(选择题) 一、选择题(每小题只有一个正确选项,每小题3分,共48分) 1.下列物质中属于强电解质的是( ) A.SO2 B.Na2SO4 C.Cl2 D.CH3COOH 2.下列盐溶液蒸干后并灼烧,能得到原溶质的是( ) A.Al2(SO4)3溶液 B.MgCl2溶液 C.FeSO4溶液 D.NaClO溶液 3.某原电池,将两金属X、Y用导线连接,同时插入相应的电解质溶液中,发现Y电极质量增加,则下列情况中有可能的是( ) A.X是负极,电解质溶液为CuSO4溶液 B.X是负极,电解质溶液为H2SO4溶液 C.X是正极,电解质溶液为CuSO4溶液 D.X是正极,电解质溶液为H2SO4溶液 4.温度相同,浓度均为0.1 mol·L-1的:①(NH4)2CO3,②(NH4)2Fe(SO4)2,③氨水,④NH4NO3,⑤ NH4HSO4溶液,它们中的c(NH4+)由大到小的排列顺序是( ) A.②⑤④①③ B.③⑤②④① C.②①⑤④③ D.⑤②①④③ 5.下列应用与盐类的水解无关的是 ( ) A.明矾净水 B.配制CuCl2溶液时加入适量盐酸 C.NaCl可用作防腐剂和调味剂 D.泡沫灭火器的灭火原理 6.铅蓄电池是典型的可充电电池,它的正负极板是惰性材料,分别吸附着PbO2和Pb,工作时该电池电池总反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列说法不正确的是( ) A.放电时:正极的电极反应式是 PbO2+2e-+4H++SO42-=PbSO4+2H2O B.该电池工作时电解液的pH变小 C.当外电路通过1mol电子时,理论上负极板的质量增加48g D.该电池工作时铅电极发生氧化反应 7.下列叙述中正确的是( ) A.常温下,0.01mol·L-1醋酸溶液pH=2 B.95℃纯水的pH<7,说明加热可导致水呈酸性 C.常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4 D.常温下,将0.2 mol·L-1的盐酸与等体积水混合后溶液pH=1 8.Licht等科学家设计的Al—MnO4—电池原理如图所示,电池总反应为Al+MnO4—=AlO2—+MnO2,下列说法正确的是( ) A.电池工作时,K+向负极区移动 B.Al电极发生还原反应 C.正极的电极反应式为MnO4—+4H++3e-=MnO2+2H2O D.理论上电路中每通过1mol电子,负极质量减小9g 9.在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的 Ksp=1.8×10-10。下列说法不正确的是 ( ) A. t°C时,Ag2CrO4的Ksp为1×10-8 B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 C. t°C时,Y点和Z点的Ag2CrO4的Ksp相等 D.t°C时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl 和0.01mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 10.相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,说法正确的是( ) A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气 C.开始时产生氢气的速率强酸大 D.产生相同体积的气体强酸需要的时间短 11.常温下,0.1mol/L的下列溶液酸性最强的是( ) A.NaHSO4 B.NaHSO3 C.Al2(SO4)3 D.CH3COOH 12.一定温度下,水存在H2OH++OH-的平衡,下列叙述一定正确的是( ) A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 B.将水加热,Kw增大,pH减小 C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变 13.常温下,pH=12的强碱溶液与pH=2的强酸溶液混合,(体积变化忽略不计)所得混合液的pH=11,则强碱与强酸的体积比是( ) A.11:1 B.9:11 C.1:11 D.11:9 14.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,这种试剂是( ) A.MgCO3 B.NaOH C.Na2CO3 D.NH3·H2O 15.已知某溶液中只存在 OH﹣、Cl﹣、NH4+、H+四种离子,下列说法不正确的是( ) A.若溶液中 c(NH4+)=c(Cl﹣),则该溶液一定显中性 B.若溶液中 c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+),则溶液中一定含有 NH4Cl 和 NH3•H2O C.若溶液中 c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣),则溶液中可能含有 NH4Cl 或可能含有NH4Cl和 HCl D.若溶液中 c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣),则溶液中含大量的 NH4Cl 和少量的 HCl 16.用0.1mol·L-1KOH溶液滴定20mL0.1mol·L-1H2A 溶液的滴定曲线如图所示(曲线上的数字为pH)。已知pKa=-lgKa,25℃时H2A的pKa1=1.85,pKa2=7.19。下列说法正确的是( ) A.a点所得溶液中: 2c(H2A)+c(A2-)=0.1mol/L B.b点所得溶液中: 2c(H2A)+c(H+)=c(A2-)+c(OH-) C.c 点所得溶液中: c(K+)<3c(HA-) D.d点所得溶液中A2-第一级水解平衡常数为10-6.81 第II卷(非选择题) 二、填空题(每空2分,共52分) 17.(8分)一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答: (1)醋酸的电离平衡常数表达式为:______________________。 (2)a、b、c三点c(H+)由大到小的顺序是________________________________________。 (3)a、b、c三点中醋酸的电离程度最大的点是________点。 (4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是________(填标号)。 A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉 18.(12分)可以将氧化还原反应2H2+O22H2O设计成原电池。 (1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,电极反应为:正极 ,负极 。 (2)如果把KOH改为稀硫酸作电解质,则电极反应为:正极: 。 (3)(1)和(2)的电解质溶液不同,反应进行后,其溶液的pH各有何变化? 。 (4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应为:正极: ,负极: 。 19.(12分)常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: (1)由图中信息可知HA为 酸(填“强”或“弱”)。 (2)常温下一定浓度的MA稀溶液的pH = a,则a______________7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: _____________________,此时,溶液中由水电离出的c(OH-)=_________ (3)请写出K点所对应的溶液中离子浓度的大小关系______________________。 (4)K点对应的溶液中,溶液的 pH = 10,则 c(MOH) +c(OH-) =_________________mol· L-1。 20.(8分)某同学用已知物质的量浓度的NaOH测定未知物质的量浓度的盐酸,将20.00 mL待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。 实验编号 NaOH溶液的浓度/(mol·L-1) 滴定完成时,NaOH溶液滴入的体积/mL 待测盐酸的体积/mL 1 0.10 22.62 20.00 2 0.10 22.72 20.00 3 0.10 22.80 20.00 ① 滴定达到终点的标志是____________________________。 ② 根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。 ③ 排除碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。 ④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。 A.滴定终点读数时俯视 B.酸式滴定管使用前,水洗后未用待测盐酸润洗 C.锥形瓶水洗后未干燥 D.称量的NaOH固体中混有Na2CO3固体 E. 碱式滴定管尖嘴部分有气泡,滴定后消失 21.(12分)现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与 pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与 pH=12的NaOH溶液等体积混合所得溶液。 (1)其中水的电离程度最大的是________(选填序号); (2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②______③(选填“>”、“<”或“=”,下同);若将②、③溶液等体积混合后,所得溶液 pH_____________7。 (3)若将①、④溶液按体积比为2:1混合后,所得溶液pH______7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:__________;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈_________(填序号)。 A.酸性 B.碱性 C.中性 2019-2020学年度上学期高二期中考试化学答案 一、 选择题(每题3分,共48分) 1-5 B A A C C 6-10 B D D A A 11-16 A B D A D D 二.填空题(每空2分,共52分) 17. (8分) (1)K= (2) b>a>c (3) c (4) ACEF 18.(12分) (1)O2+2H2O+4e-=4OH- 2H2+4OH--4e-=4H2O (2)O2+4H++4e-=2H2O (3)前者变小,后者变大 (4)2O2+4H2O+8e-=8OH- CH4+10OH--8e-=CO32-+7H2O 19.(12分) (1)强; (2)< M++H2OMOH+H+ 1×10-a mol·L-1; (3)c(M+)>c(A-)>c(OH-)>c(H+); (4)0.005 20.(8分) (1) 当最后一滴标准液滴入锥形瓶,溶液颜色由无色变为红色,半分钟内不褪色 (2) 0.11 mol/L (3)丙 (4)DE 21.(12分) (1)⑥ (2) > > (3) < c(CH3COO-)>c(Na+)> c(CH3COOH)>c(H+)>c(OH-) ABC查看更多