- 2021-04-14 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学江苏卷李强整理
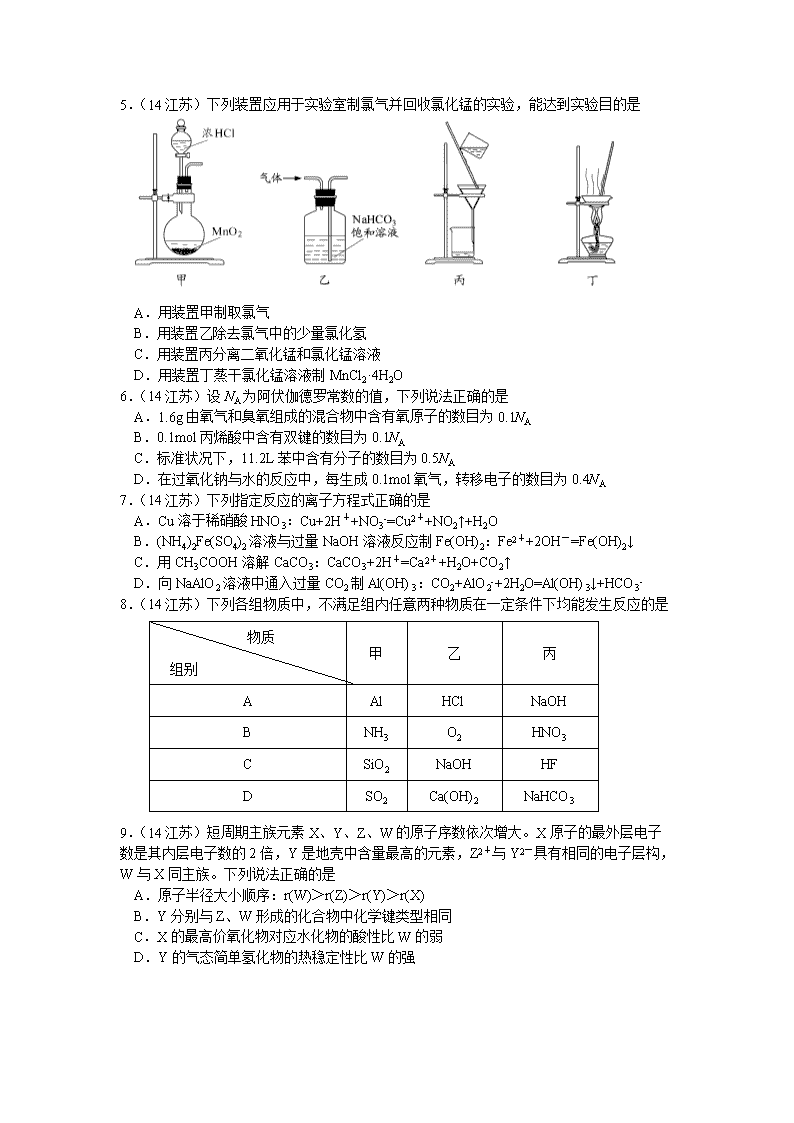
2014普通高等学校招生全国统一考试(江苏卷)(李强整理) 化学试题 可能用到的相对原子质量:H1 C12 N14 O16 Na23 Cl35. 5 K39 Cr52 Fe56 Cu64 Mg24 Il27 P31 S32 选择题 单项选择题:本题包括10 小题, 每小题2 分, 共计20 分。每小题只有一个选项符合题意。 1.(14江苏)水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是 A.水是弱电解质 B.可燃冰是可以燃烧的水 C.氢氧两种元素只能组成水 D.0℃时冰的密度比液态水的密度大 2.(14江苏)下列关于化学用语的表示正确的是 A.过氧化钠的电子式: B.质子数为35、中子数为45的溴原子:Br C.硫离子的结构示意图: D.间二甲苯的结构简式: 3.(14江苏)25℃时,下列各组离子在指定溶液中一定能大量共存的是 A.pH=1的溶液中:Na+、K+、MnO4-、CO32- B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- C.0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- D.0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- 4.(14江苏)下列物质性质与应用对应关系正确的是 A.晶体硅熔点高硬度大,可用于制作半导体材料 B.氢氧化铝具有弱碱性,可用于制胃酸中和剂 C.漂白粉在空气中不稳定,可用于漂白纸张 D.氧化铁能与酸反应,可用于制作红色涂料 5.(14江苏)下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是 A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢 C.用装置丙分离二氧化锰和氯化锰溶液 D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O 6.(14江苏)设NA为阿伏伽德罗常数的值,下列说法正确的是 A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA B.0.1mol丙烯酸中含有双键的数目为0.1NA C.标准状况下,11.2L苯中含有分子的数目为0.5NA D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA 7.(14江苏)下列指定反应的离子方程式正确的是 A.Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- 物质 组别 甲 乙 丙 A Al HCl NaOH B NH3 O2 HNO3 C SiO2 NaOH HF D SO2 Ca(OH)2 NaHCO3 8.(14江苏)下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是 9.(14江苏)短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子 数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层构, W与X同主族。下列说法正确的是 A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) B.Y分别与Z、W形成的化合物中化学键类型相同 C.X的最高价氧化物对应水化物的酸性比W的弱 D.Y的气态简单氢化物的热稳定性比W的强 10.(14江苏)已知:C(s)+O2(g)=CO2(g) ΔH1 CO2(g)+C(s)=2CO(g) ΔH2 2CO(g)+O2(g)=2CO2(g) ΔH3 4Fe(s)+3O3(g)=2Fe2O3(s) ΔH4 3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5 下列关于上述反应焓变的判断正确的是 A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11.(14江苏)下列有关说法正确的是 A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0 C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大 D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 12.(14江苏)去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是 A.每个去甲肾上腺素分子中含有3个酚羟基 B.每个去甲肾上腺素分子中含有1个手性碳原子 C.1mol去甲肾上腺素最多能与2molBr2发生取代反应 D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 13.(14江苏)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是 A.氯水的颜色呈浅绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO 14.(14江苏)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是 A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合: c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸): 2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) 15.(14江苏)一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g) 容器 编号 温度(℃) 起始物质的量(mol) 平衡物质的量(mol) CH3OH(g) CH3OCH3(g) H2O(g) I 387 0.20 0.080 0.080 Ⅱ 387 0.40 Ⅲ 207 0.20 0.090 0.090 下列说法正确的是 A.该反应的正方应为放热反应 B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小 C.容器I中反应达到平衡所需时间比容器Ⅲ中的长 D.若起始时向容器I中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行 非选择题 16.(12分)(14江苏)烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2 等) 制备碱式硫酸铝[Al2(SO4)x(OH)6-2x ]溶液,并用于烟气脱硫研究。 (1)酸浸时反应的化学方程式为___________________________________________;滤渣Ⅰ的主要成分为_______________(填化学式)。 (2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6—2x。滤渣Ⅱ的主要成分为__________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是________________________________________(用离子方程式表示)。 (3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是____________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将_____________(填“增大”、“减小”或“不变”)。 17.(15分)(14江苏)非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成: 请回答下列问题 (1)非诺洛芬中的含氧官能团为____________和____________(填名称)。 (2)反应①中加入的反应试剂X的分子式为C8H8O2,X的结构简式为_________________。 (3)在上述五步反应中,属于取代反应的是___________________。 (4)B的一种发生同分异构体满足下列条件 Ⅰ能发生银镜反应,且水解产物之一能与溶液发生显色反应。 Ⅱ分子中有6种不同化学环境的氢,且分子中含有两个苯环。 写出该同分异构的结构简式:___________________________________。 (5)根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: 18.(12分)(14江苏)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。 (1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和_____________。 (2)MgaAlb(OH)c(CO3)d·x H2O中a、b、c、d的代数关系式为_____________________。 (3)为确定碱式碳酸铝镁的组成,进行如下实验: ①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物)。 根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。 19.(15分)(14江苏)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下: (1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________________________;该操作将I2还原为I-的目的是_____________________。 (2)操作X的名称为____________________。 (3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如右图所示)。实验控制在较低温度下进行的原因是______________________;锥形瓶里盛放的溶液为___________________。 (4)已知:5SO32-+2IO3-+2H+=I2+5SO42-+H2O 某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;_____________________________。 实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液 20.(14分)(14江苏)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。 (1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2――2e-=S (n-1)S+ S2-=Sn2- ①写出电解时阴极的电极反应式: _________________________ 。 ②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。 (2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。 ①在图示的转化中,化合价不变的元素是_________________。 ②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为__________________。 ③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有________________________________________________。 (3)H2S在高温下分解生成硫蒸汽和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 _________________________________________________________________________。 题20图—1 题20图—2 题20图—3 21.(12分)(14江苏)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。 A.[物质结构与性质] 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。 (1)Cu+基态核外电子排布式为_________________________________________; (2)与OH-互为等电子体的一种分子为________________________(填化学式)。 (3)醛基中碳原子的轨道杂化类型是__________________;1mol乙醛分子中含有ó的键的数目为_____________________。 (4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为___________________________________________。 5(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如右图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为______________。 B.[实验化学] 磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。 (1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是 。 (2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、________和_________。 ②若滴定xmL滤液中的Fe2+,消耗amol·L-1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+) =__________mol·L-1 ③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。 A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌 C.加热,使反应在较高温度下进行 D.用氨水调节pH=7 (3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O 。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为___________________。 2014普通高等学校招生全国统一考试(江苏卷) 化学试题参考答案 选择题(共40分) 单项选择题:本题包括10 小题, 每小题2 分, 共计20 分。 1.A 2.B 3.C 4.B 5.C 6.A 7.D 8. B 9.D 10.C 不定项选择题:本题包括5 小题,每小题4 分, 共计20 分。 11. C 12. BD 13.D 14. AC 15. AD 非选择题(共80分) 16.(12分) (1)Al2O3+ 3H2SO4 =Al2(SO4)3+ 3H2O SiO2 (2)CaSO4 3CaCO3 + 2Al3+ + 3SO42-+ 3H2O = 2Al(OH)3+ 3CaSO4+ 3CO2↑ (3)溶液中的部分SO32- 被氧化成SO42- 减小 17. (15 分) (1)醚键 羧基 (2)(3)①③④(4) (5) 18.(12分) (1)生成的产物具有阻燃作用 (2)2a+3b =c+2d (3)n(CO2)= 0.560 L/22.4 L·mol-1 =2.50×10-2 mol m (CO2)= 2.50×10-2 mol ×44 g·mol-1 =1.10 g 在270~600℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O m (CO2)+ m (H2O)= 3.390 g ×(0.7345-0.3702)=1.235 g m (H2O)= 1.235 g-1.10 g=0.135 g n (H2O)= 0.135 g/18 g·mol-1 =7.50×10-3 mol n (OH-)=7.50×10-3 mol×2=1.50 ×10-2 mol n (OH-):n (CO32-)=1.50 ×10-2 mol:2.50×10-2 mol=3:5 19.(12分) (1)SO32- + I2+ H2O=2I- + SO42- + 2H+ 使CCl4中的碘进入水层 (2)分液 (3)使氯气在溶液中有较大的溶解度(或防止 I2 升华或防止I2 进一步被氧化) NaOH溶液 (4)从水层取少量溶液,加入1~2mL 淀粉溶液,加盐酸酸化,滴加FeCl3 溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-。另从水层取少量溶液,加入1~2mL 淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液 变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3- 20.(14 分) (1)①2H2O + 2e-=H2↑+ 2OH- ②Sn 2- + 2H+= (n-1)S↓+ H2S↑ (2) ①Cu、H、Cl(或铜、氢、氯) ②0. 5 mol ③提高混合气体中空气的比例 (3)2H2S2H2 + S2 21.(12分)选做题 A.【物质结构与性质】 (1)[Ar]3d10或1s22s22p63s23p63d10 (2)HF (3)sp2 6 mol 或6×6.02×1023个 (4)2Cu(OH)2+ CH3CHO + NaOHCH3COONa + Cu2O↓+ 3H2O (5)12 B.【实验化学】 (1)加快铁与稀硫酸反应速率 (2)①用蒸馏水洗净 用K2Cr2O7 标准溶液润洗2 ~3 次 ② ③AB (3)Fe(OH)3(或氢氧化铁)查看更多