- 2021-04-14 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习焓变热化学方程式作业
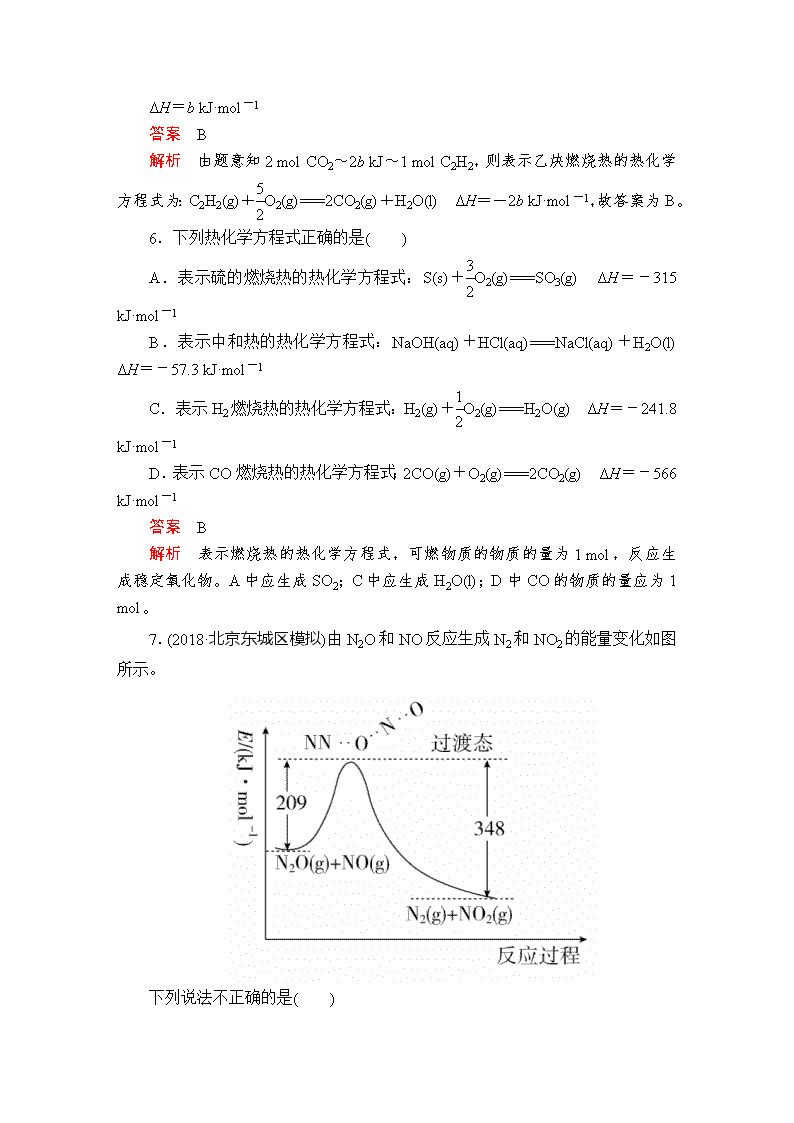
建议用时:40分钟 满分:100分 一、选择题(每题6分,共72分) 1.伴随下列变化而发生的能量变化中,属于反应热的是( ) A.形成1 mol H—Cl键放出的能量 B.石墨转化成金刚石吸收的能量 C.Na变成Na+吸收的能量 D.水蒸气变成液态水放出的能量 答案 B 解析 反应热是化学反应放出或吸收的热量。 2.下列物质间的反应,其能量变化符合下图的是( ) A.由Zn和稀硫酸制氢气 B.灼热的炭粉与二氧化碳反应 C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.碳酸钙的分解 答案 A 解析 该图示为放热反应能量图,A正确。 3.未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生。下列能源符合未来新能源标准的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 答案 B 解析 ①天然气、②煤、④石油属于三大化石燃料,不可再生;③核能对环境会产生污染。 4.下图表示某反应的能量变化,对于该图的理解正确的是( ) A.曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 B.曲线Ⅱ可表示反应2NH3N2+3H2的能量变化 C.该反应不需要加热就能发生 D.该反应的ΔH=E2-E1 答案 D 解析 图中曲线Ⅰ和曲线Ⅱ的始态、终态相同,表示同一个化学反应的能量变化,A错误;反应物的能量大于生成物的能量,该反应是放热反应,NH3的分解反应是吸热反应,B错误;放热反应是指在反应过程中放出热量,并不表示反应不需要加热,C错误;D正确。 5.已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量,则表示乙炔燃烧热的热化学方程式正确的是( ) A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g) ΔH=-2b kJ·mol-1 B.C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1 C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1 D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=b kJ·mol-1 答案 B 解析 由题意知2 mol CO2~2b kJ~1 mol C2H2,则表示乙炔燃烧热的热化学方程式为:C2H2(g)+O2(g)===2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1,故答案为B。 6.下列热化学方程式正确的是( ) A.表示硫的燃烧热的热化学方程式:S(s)+O2(g)===SO3(g) ΔH=-315 kJ·mol-1 B.表示中和热的热化学方程式:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 C.表示H2燃烧热的热化学方程式:H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1 D.表示CO燃烧热的热化学方程式:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 答案 B 解析 表示燃烧热的热化学方程式,可燃物质的物质的量为1 mol,反应生成稳定氧化物。A中应生成SO2;C中应生成H2O(l);D中CO的物质的量应为1 mol。 7.(2018·北京东城区模拟)由N2O和NO反应生成N2和NO2的能量变化如图所示。 下列说法不正确的是( ) A.反应生成1 mol N2时转移4 mol e- B.反应物能量之和大于生成物能量之和 C.N2O(g)+NO(g)===N2(g)+NO2(g)ΔH=-139 kJ·mol-1 D.断键吸收能量之和小于成键释放能量之和 答案 A 解析 N2O和NO反应生成N2和NO2的化学方程式为N2O+NO===N2+NO2,反应生成1 mol N2时转移2 mol e-,A不正确;根据图示,反应物能量之和大于生成物能量之和,B正确;该反应的反应热为(209-348) kJ·mol-1=-139 kJ·mol-1,C正确;由于该反应放热,所以断键吸收能量之和小于成键释放能量之和,D正确。 8.一些烷烃的标准燃烧热如下表: 下列说法正确的是( ) A.热稳定性:正丁烷>异丁烷 B.正戊烷的标准燃烧热大约为ΔH=-3540 kJ·mol-1 C.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1 D.在101 kPa下,甲烷的热值是891.0 kJ·g-1 答案 B 解析 由表格中的数据可知,异丁烷燃烧放出热量比正丁烷小,则异丁烷的能量低,即热稳定性:正丁烷<异丁烷,A错误;正戊烷和2甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,互为同分异构体的化合物,支链多的燃烧放出热量小,则正戊烷燃烧放出热量大于2甲基丁烷,B正确;根据乙烷燃烧热的含义:完全燃烧1 mol乙烷生成二氧化碳和液态水时会放出1560.8 kJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-3121.6 kJ·mol-1 ,C错误;燃料的热值是指一定条件下单位质量的物质完全燃烧所放出的热量,在101 kPa下,甲烷的热值是×891.0 kJ·g-1,D错误。 9.(2017·佛山高三质检)下列热化学方程式书写正确的是(ΔH的绝对值均正确)( ) A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1367.0 kJ·mol-1(燃烧热) B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) C.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热) D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) 答案 C 解析 燃烧热是在一定条件下,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态是液态,A不正确;中和反应是放热反应,B不正确;C正确;D不正确,没有注明物质的状态。 10.下列说法正确的是( ) A.已知C2H6的燃烧热为1090 kJ·mol-1,则C2H6燃烧的热化学方程式为C2H6(g)+3.5O2(g)===2CO2(g)+3H2O(g) ΔH=-1090 kJ·mol-1 B.已知2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热 ΔH=-283 kJ C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后最高温度 D.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 答案 C 解析 A项,燃烧热指1 mol可燃物完全燃烧所放出的热量,完全燃烧指C生成CO2,H元素生成液态水,正确的为C2H6(g)+3.5O2(g)===2CO2(g)+3H2O(l) ΔH=-1090 kJ·mol-1,错误;B项,CO的燃烧热为283 kJ·mol-1,错误;C项,测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后最高温度,正确;D项,醋酸为弱电解质,在电离时吸收热量,所以稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出的热量小于57.3 kJ,错误。 11.铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景。实验室中可利用FeCO3和O2 为原料制备少量铁红,每生成160 g固体铁红放出130 kJ热量,则下列有关该反应的热化学方程式书写正确的是( ) A.2FeCO3(s)+O2(g)===Fe2O3(s)+2CO2(g) ΔH=-130 kJ·mol-1 B.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=+260 kJ·mol-1 C.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1 D.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=+130 kJ·mol-1 答案 C 解析 每生成160 g固体铁红的物质的量为=1 mol,放出130 kJ热量,所以生成2 mol氧化铁放出的热量为260 kJ,所以热化学方程式为4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1,选C。 12.(2018·太原五中月考)燃烧a g C2H5OH(l),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则表示乙醇燃烧的热化学方程式是( ) A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-20Q kJ·mol-1 B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1 C.C2H5OH(l)+O2(g)===CO2(g)+H2O(g) ΔH=-20Q kJ·mol-1 D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-40Q kJ·mol-1 答案 B 解析 由关系式:CaCO3~CO2~C2H5OH可知,a g乙醇的物质的量为n(CaCO3)=0.025 mol,所以1 mol C2H5OH(l)燃烧生成二氧化碳气体和液态水,放出的热量是40Q kJ,热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1。 二、非选择题(共28分) 13.(16分)Ⅰ. 已知某反应A(g)+B(g) C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。 (1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。 (2)若在反应体系中加入催化剂使反应速率增大,则E1、E2和ΔH的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)。 Ⅱ.二氧化碳的回收利用是环保领域研究的热点课题。 (1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为___________。 (2)CO2经过催化氢化合成低碳烯烃。其合成乙烯的反应为2CO2(g)+6H2(g)CH2===CH2(g)+4H2O(g) ΔH。几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示: 则ΔH=______________。 答案 Ⅰ.(1)吸热 E1-E2 一定低 (2)减小 减小 不变 Ⅱ.(1)CO2C+O2 (2)-128 kJ·mol-1 解析 Ⅰ.(2)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变。 Ⅱ.(1)在700 K条件下,CO2和FeO反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,Fe3O4是中间产物,总反应的化学方程式为CO2C+O2。 (2)焓变等于生成物总能量减去反应物总能量,所以ΔH=(52-242×4+394×2-0) kJ·mol-1=-128 kJ·mol-1。 14.(12分)依据事实,写出下列反应的热化学方程式。 (1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为_____。 (2)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g)。在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是___________。 (3)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为___________________________________________。 答案 (1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·mol-1 (2)NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216.0 kJ·mol-1 (3)AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ·mol-1 解析 (1)2 g SiH4自燃放出热量89.2 kJ,1 mol SiH4自燃放出热量1427.2 kJ,故热化学方程式为SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·mol-1。 (2)根据题中“每消耗3.8 g NaBH4(s)放热21.6 kJ”可得出此反应的热化学方程式:NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216.0 kJ·mol-1。 (3)由题目信息可知,常温时AX3为液体,AX5为固体,从而可写出该反应的热化学方程式为AX3(l)+X2(g)===AX5(s) ΔH=-123.8 kJ·mol-1。查看更多