- 2021-04-14 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习 卤族元素及其重要化合物 海水资源的开发和利用学案
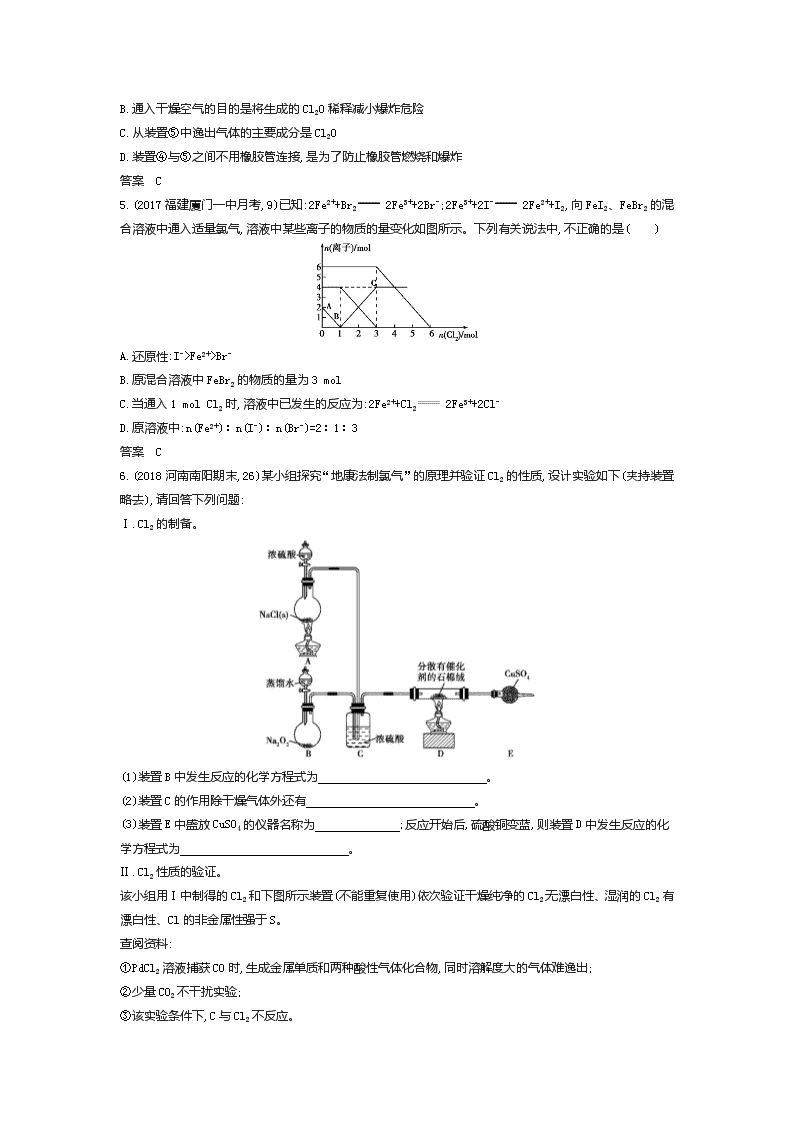
专题十五 卤族元素及其重要化合物 海水资源的开发和利用 挖命题 【考情探究】 考点 内容解读 5年考情 预测热度 考题示例 难度 关联考点 氯及其化合物的性质 1.掌握Cl2及其重要化合物的主要性质及其应用 2.掌握Cl2的实验室制法 2016课标Ⅰ,28,14分 中 电解原理的应用 ★★ 卤素性质的相似性和递变性 海水资源的开发利用 1.掌握ⅦA族内元素性质递变规律与原子结构的关系 2.了解海水的综合利用 2015课标Ⅱ,12,6分 中 粗盐提纯 ★★☆ 分析解读 卤素是典型的非金属元素,是高考的重点考查内容,试题通常以本专题知识为载体综合考查基本概念和基本理论,或与生产、生活、科技、医疗等各方面联系起来考查知识的灵活应用能力;对海水资源的开发利用的考查偶尔出现,多以选择题为主。今后高考对本专题的考查方式应基本不变。 【真题典例】 破考点 【考点集训】 考点一 氯及其化合物的性质 1.(2019届安徽合肥调研,2)下列物质性质与用途具有对应关系的是( ) A.Si的熔点高,可用作半导体材料 B.Cl2具有强氧化性,可用于漂白有色有机物质 C.Na2CO3溶液呈碱性,可用于洗涤油污 D.Al2O3硬度大,可用于制造耐火材料 答案 C 2.(2019届四川成都毕业班摸底,5)酸化的KI-淀粉溶液中,加入(或通入)下列物质不能使溶液变蓝的是( ) A.Fe(OH)3胶体 B.漂白液 C.O2 D.生石灰 答案 D 3.(2017四川成都五校联考,15)向新制氯水中加入少量下列物质,能增强溶液漂白能力的是(忽略溶液体积变化)( ) A.碳酸钙粉末 B.稀硫酸 C.氯化钙溶液 D.二氧化硫水溶液 答案 A 4.(2018山东济宁教学质量检测,12)Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。 已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2 HgCl2+Cl2O。 下列说法中不正确的是( ) A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸 B.通入干燥空气的目的是将生成的Cl2O稀释减小爆炸危险 C.从装置⑤中逸出气体的主要成分是Cl2O D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸 答案 C 5.(2017福建厦门一中月考,9)已知:2Fe2++Br2 2Fe3++2Br-;2Fe3++2I- 2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。下列有关说法中,不正确的是( ) A.还原性:I->Fe2+>Br- B.原混合溶液中FeBr2的物质的量为3 mol C.当通入1 mol Cl2时,溶液中已发生的反应为:2Fe2++Cl2 2Fe3++2Cl- D.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 答案 C 6.(2018河南南阳期末,26)某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去),请回答下列问题: Ⅰ.Cl2的制备。 (1)装置B中发生反应的化学方程式为 。 (2)装置C的作用除干燥气体外还有 。 (3)装置E中盛放CuSO4的仪器名称为 ;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为 。 Ⅱ.Cl2性质的验证。 该小组用Ⅰ中制得的Cl2和下图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S。 查阅资料: ①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物,同时溶解度大的气体难逸出; ②少量CO2不干扰实验; ③该实验条件下,C与Cl2不反应。 (4)按气流从左到右的方向,装置连接的合理顺序为E→G→K→ → → → → →尾气处理。(填装置字母) (5)试剂X的名称为 。 (6)装置J中发生反应的化学方程式为 。 (7)设计实验证明经净化后的Cl2中不含HCl: 。 答案 (1)2Na2O2+2H2O 4NaOH+O2↑ (2)控制气体的流速和比例、使气体混合均匀 (3)(球形)干燥管 4HCl+O2 2H2O+2Cl2 (4)J L H F I (5)硫化钠溶液 (6)PdCl2+CO+H2O Pd↓+CO2+2HCl (7)将净化后的混合气体通入足量CCl4,再与湿润的蓝色石蕊试纸接触,试纸不变红(或将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl 考点二 卤素性质的相似性和递变性 海水资源的开发利用 1.(2019届四川顶级名校入学考试,12)下列依据相关实验得出的结论正确的是( ) A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 B.已知I3-I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 D.向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,可除去MgCl2溶液中的少量FeCl3 答案 D 2.[2018河北“名校联盟”质监(一),12]已知:SO32-+I2+H2O SO42-+2H++2I-。某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( ) A.不能肯定是否含有Cu2+ B.肯定不含NH4+ C.可能含 SO32- D.可能含有I- 答案 D 3.(2017四川成都五校联考,20)类比推理是化学中常用的思维方法。下列推理正确的是( ) A.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 B.SiH4的沸点高于CH4,推测H2S的沸点高于H2O C.CO2是直线形分子,推测CS2也是直线形分子 D.NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热也可制HBr 答案 C 4.(2019届辽宁五校协作体联合模拟,8)南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( ) A.氯碱工业中采用阴离子交换膜可提高产品的纯度 B.工业生产中②常选用NaOH作为沉淀剂 C.由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干 D.④、⑤的目的是富集溴元素,溴元素在反应④、⑥中均被氧化,在反应⑤中被还原 答案 D 5.(2018河南、河北重点高中一联,12)用海水制盐工业中的母液来生产金属镁的一种工艺流程如下: 下列说法错误的是( ) A.上述工艺流程中未涉及置换反应 B.设计步骤①、②、③的主要目的是富集MgCl2 C.脱水时在HCl气氛中进行可防止MgCl2发生水解 D.电解得到的炽热镁粉可在二氧化碳气氛中冷却 答案 D 6.(2019届黑龙江顶级名校一调,17)某学生做如下实验:第一步,在淀粉-KI溶液中滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是( ) A.氧化性:ClO->I2>SO42- B.蓝色消失的原因是Na2SO3溶液具有漂白性 C.淀粉-KI溶液变蓝是因为I-被ClO-氧化为I2,淀粉溶液遇I2变蓝 D.若将Na2SO3溶液加入氯水中,氯水褪色 答案 B 7.(2019届陕西西安交大附中月考,30)某市场销售的食用精制盐包装袋上有如下说明: 产品标准 GB5461 产品等级 一级 配 料 食盐、碘酸钾、抗结剂 碘含量(以I计) 20~50 mg/kg 分装时期 分装企业 (1)碘酸钾与碘化钾在硫酸存在的条件下发生反应的化学方程式为 。 (2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 。 (3)已知:I2+2S2O32-2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为: a.准确称取w g食盐,加适量蒸馏水使其完全溶解; b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全; c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全。 ①判断c中反应恰好完全依据的现象是 。 ②b中反应所产生的I2的物质的量是 mol。 ③根据以上实验和包装袋说明,所测精制盐的碘含量是 mg·kg-1。(以含w的代数式表示) 答案 (1)KIO3+5KI+3H2SO43K2SO4+3I2+3H2O (2)I2+SO32-+H2O2I-+SO42-+2H+ (3)①滴最后一滴溶液,溶液由蓝色恰好变为无色,且半分钟内不变色 ②1.0×10-5 ③1 2703w 炼技法 方法集训 方法 卤素离子的检验方法 1.(2018辽宁六校协作体期中,12)下列关于物质或离子检验的推断正确的是( ) A.向X溶液中滴加KSCN溶液,溶液显红色,证明X溶液中有Fe3+,无Fe2+ B.用硝酸酸化Y溶液,无现象,再加入硝酸钡溶液,产生白色沉淀,则Y溶液中含有SO42- C.用玻璃棒蘸Z溶液在酒精灯上灼烧,火焰呈黄色,再透过蓝色钴玻璃观察火焰无紫色,则Z溶液中有Na+,无K+ D.用盐酸酸化W溶液,无现象,再向其中滴加AgNO3溶液,产生白色沉淀,则W溶液中含有Cl- 答案 B 2.(2018湖南五市十校教研教改共同体联考,11)某无色溶液中可能存在Na+、Mg2+、Fe3+、I-、CO32-、SO42-、Cl-中的几种,某学生进行了下列实验:①取少量原溶液,向其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,再将溶液分为2份;②向其中一份溶液中加入AgNO3溶液,有白色沉淀产生;③向另一份溶液中加入BaCl2溶液,有白色沉淀产生。原溶液中一定大量存在的离子组是( ) A.Na+、Fe3+、SO42- B.CO32-、Cl-、SO42- C.Mg2+、I-、SO42- D.Na+、SO42-、CO32- 答案 D 3.(2017广东中山一中二测,15)根据下列实验操作和现象得出的结论正确的是( ) 选项 实验操作 现象 结论 A 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 石灰水变浑浊 该溶液中一定 含有CO32- B 将干燥的Cl2通过有色鲜花 鲜花褪色 Cl2有漂白性 C 向某无色溶液中滴加氯水和CCl4,振荡、静置 下层溶液呈紫色 原溶液中有I- D 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生气体 Na2O2没有变质 答案 C 过专题 【五年高考】 A组 统一命题·课标卷题组 考点一 氯及其化合物的性质 1.(2016课标Ⅲ,7,6分)化学在生活中有着广泛的应用,下列对应关系错误的是( ) 化学性质 实际应用 A. Al2(SO4)3和小苏打反应 泡沫灭火器灭火 B. 铁比铜金属性强 FeCl3腐蚀Cu刻制印刷电路板 C. 次氯酸盐具有氧化性 漂白粉漂白织物 D. HF与SiO2反应 氢氟酸在玻璃器皿上刻蚀标记 答案 B 2.(2016课标Ⅰ,28,14分)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 回答下列问题: (1)NaClO2中Cl的化合价为 。 (2)写出“反应”步骤中生成ClO2的化学方程式 。 (3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。“电解”中阴极反应的主要产物是 。 (4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为 ,该反应中氧化产物是 。 (5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为 。(计算结果保留两位小数) 答案 (1)+3 (2)2NaClO3+SO2+H2SO4 2ClO2+2NaHSO4 (3)NaOH溶液 Na2CO3溶液 ClO2-(或NaClO2) (4)2∶1 O2 (5)1.57 考点二 卤素性质的相似性和递变性 海水资源的开发利用 3.(2015课标Ⅱ,12,6分)海水开发利用的部分过程如图所示。下列说法错误的是( ) A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产中常选用NaOH作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 答案 C B组 自主命题·省(区、市)卷题组 考点一 氯及其化合物的性质 1.(2017北京理综,8,6分)下列变化中,气体被还原的是( ) A.二氧化碳使Na2O2固体变白 B.氯气使KBr溶液变黄 C.乙烯使Br2的四氯化碳溶液褪色 D.氨气使AlCl3溶液产生白色沉淀 答案 B 2.(2014浙江理综,12,6分)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气-氯水体系中存在以下平衡关系: Cl2(g)Cl2(aq) K1=10-1.2 Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4 HClO H++ClO- Ka=? 其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( ) A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9 B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-) C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 答案 C 3.(2015重庆理综,9,15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。 (1)仪器D的名称是 。安装F中导管时,应选用图2中的 。 (2)打开B的活塞,A中发生反应:2NaClO3+4HCl 2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。 (3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。 (4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。 (5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。 图3 答案 (15分)(1)锥形瓶 b (2)慢 (3)吸收Cl2 (4)4H++5ClO2- Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 (5)稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度 考点二 卤素性质的相似性和递变性 海水资源的开发利用 4.(2015北京理综,27,14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。 (1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%。写出CO2溶于水产生HCO3-的方程式: 。 (2)在海洋碳循环中,通过如图所示的途径固碳。 ①写出钙化作用的离子方程式: 。 ②同位素示踪法证实光合作用释放出的O2只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整: + (CH2O)x+x18O2+xH2O (3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法: ①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。 ②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用x mol·L-1 HCl溶液滴定,消耗y mL HCl溶液。海水中溶解无机碳的浓度= mol·L-1。 (4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。 ①结合方程式简述提取CO2的原理: 。 ②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。 答案 (14分)(1)CO2+H2O H2CO3、H2CO3 H++HCO3- (2)①2HCO3-+Ca2+ CaCO3↓+CO2↑+H2O ②xCO2 2xH218O (3)① ②x·yz (4)①a室:2H2O-4e- 4H++O2↑,H+通过阳离子膜进入b室,发生反应:H++HCO3- CO2↑+H2O ②c室的反应:2H2O+2e- 2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调至接近装置入口海水的pH 5.(2014福建理综,23,15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。 (1)与氯元素同族的短周期元素的原子结构示意图为 。 (2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。 a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性 c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性 (3)工业上,通过如下转化可制得KClO3晶体: NaCl溶液NaClO3溶液KClO3晶体 ①完成Ⅰ中反应的总化学方程式: NaCl+ H2O NaClO3+ 。 ②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 。 (4)一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如下图所示。 ①D是 (填离子符号)。 ②B A+C反应的热化学方程式为 (用离子符号表示)。 答案 (1) (2)b、c (3)①1NaCl+3H2O 1NaClO3+3H2↑ ②复分解反应 室温下,氯酸钾在水中的溶解度明显小于其他晶体 (4)①ClO4- ②3ClO-(aq) ClO3-(aq)+2Cl-(aq) ΔH=-117 kJ·mol-1 C组 教师专用题组 考点一 氯及其化合物的性质 1.(2014江苏单科,19,15分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下: Na2SO3溶液↓ Cl2↓ 含碘废液还原操作X 氧化 富集 … I2 ↓CCl4 (1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。 (2)操作X的名称为 。 (3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如下图所示)。 实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。 (4)已知:5SO32-+2IO3-+2H+ I2+5SO42-+H2O 某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在; 。 实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。 答案 (15分)(1)SO32-+I2+H2O 2I-+SO42-+2H+ 使CCl4中的碘进入水层 (2)分液 (3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化) NaOH溶液 (4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-。另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3- 2.(2013北京理综,28,15分)某学生对SO2与漂粉精的反应进行实验探究: 操作 现象 取4 g漂粉精固体,加入100 mL水 部分固体溶解,溶液略有颜色 过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色 ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 (1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 。 (2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。 (3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验: a.用湿润的碘化钾淀粉试纸检验白雾,无变化; b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。 ①实验a的目的是 。 ②由实验a、b不能判断白雾中含有HCl,理由是 。 (4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。 (5)将A瓶中混合物过滤、洗涤,得到沉淀X。 ①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是 。 ②用离子方程式解释现象ⅲ中黄绿色褪去的原因: 。 答案 (1)2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O (2)碱性、漂白性 (3)①检验白雾中是否含有Cl2,排除Cl2干扰 ②白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀 (4)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色 (5)①CaSO4 ②SO2+Cl2+2H2O SO42-+2Cl-+4H+ 考点二 卤素性质的相似性和递变性 海水资源的开发利用 【三年模拟】 一、选择题(每题6分,共42分) 1.(2019届陕西西安交大附中月考,11)ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( ) A.2∶1 B.1∶1 C.1∶2 D.2∶3 答案 A 2.(2019届湖南衡阳一中月考,4)某兴趣小组用下图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是( ) 选项 ①中药品 ②中药品 ③中药品 ④中药品 制备气体 ⑥中药品及作用 A 浓盐酸 MnO2 饱和食盐水 浓硫酸 Cl2 NaOH溶液,尾气吸收 B 稀硝酸 Cu 烧碱溶液 浓硫酸 NO NaOH溶液,尾气吸收 C 浓盐酸 大理石 饱和Na2CO3溶液 浓硫酸 CO2 澄清石灰水,检验 D 浓盐酸 Zn 水 浓硫酸 H2 撤去 答案 A 3.(2019届甘肃顶级名校月考,21)根据如图的转化关系判断,下列说法正确的是(反应条件已略去)( ) A.反应①②③④⑤均属于氧化还原反应和离子反应 B.反应⑤说明该条件下铝的还原性强于锰 C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1 D.反应①中氧化剂与还原剂的物质的量之比为1∶4 答案 B 4.(2018吉林四盟校期中联考,24)A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示转化关系(部分产物及反应条件已略去)。下列判断正确的是( ) A.X元素可能为Al B.X元素一定为非金属元素 C.反应①和②互为逆反应 D.反应①和②不一定为氧化还原反应 答案 B 5.(2017湖南湘中名校联考,9)已知H2SO3+I2+H2O H2SO4+2HI,将0.1 mol Cl2通入100 mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法中正确的是( ) A.物质的还原性:HI>H2SO3>HCl B.HI与H2SO3的物质的量浓度均为0.6 mol·L-1 C.通入0.1 mol Cl2发生反应的离子方程式为: 5Cl2+4H2SO3+2I-+4H2O 4SO42-+I2+10Cl-+16H+ D.若再通入0.05 mol Cl2,恰好能将HI和H2SO3完全氧化 答案 C 6.(2018北京临川学校月考,16)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( ) A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO 答案 D 7.(2018安徽蚌埠二模,9)下列装置不能达到实验目的的是( ) A.用装置甲制取氯气 B.用装置乙制取单质溴 C.用装置丙蒸干氯化锰溶液制MnCl2·4H2O D.用装置丁分离苯和KBr溶液 答案 C 二、非选择题(共58分) 8.(2018广东茂名二模,26)(16分)ICl(氯化碘)是红棕色液体,熔点为13.9 ℃,沸点为97.4 ℃,易水解,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组的同学拟用下列仪器制备氯化碘。回答下列问题: (1)检查A装置气密性的方法为 。 (2)上述装置,按气流方向连接的顺序为 (装置可重复使用),A装置中发生反应的离子方程式为 。 (3)C装置的作用是 。 (4)E装置中的物质反应时需放在水中,控制温度大约40 ℃,其目的是 。 (5)按上述连接好的装置进行实验,实验步骤如下: ①检查装置气密性后,装入药品 ②打开分液漏斗活塞 ③关闭分液漏斗活塞 ④停止加热E,充分冷却 ⑤水浴加热E 请按正确的顺序填入上述步骤的序号 。 (6)在A装置后可连接如图所示装置,当反应结束关闭分液漏斗活塞后,关闭K,该装置的作用是 。 (7)ICl和水反应的化学方程式为 。 答案 (每空2分)(1)从A装置的导管口连接一个导管伸入水中,关闭分液漏斗活塞,手握圆底烧瓶,若导管口有气泡冒出,手放开烧瓶后,有一段稳定的水柱倒吸入导管,说明A装置气密性良好 (2)ACBEBD MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (3)除去Cl2中混有的HCl (4)减少I2的升华和ICl的挥发 (5)①②⑤④③ (6)储存多余的Cl2 (7)ICl+H2O HIO+HCl 9.(2018河南、河北重点高中一联,18)(10分)亚氯酸(HClO2)是一种中强酸,易分解,亚氯酸及其盐类在工业生产和环境治理等方面用途非常广泛。回答下列问题: (1)HClO2中氯元素的化合价为 ;亚氯酸不稳定,易分解为Cl2、ClO2和H2O,分解后的氧化产物与还原产物的物质的量之比为 。 (2)已知常温下Ka(HClO2)=1.1×10-2,则反应HClO2+OH- ClO2-+H2O在常温下的平衡常数K= 。 (3)亚氯酸盐可用于脱除氮氧化物和硫氧化物,当其他条件不变时,测得脱除率与吸收液pH的关系如图所示。已知:Cl2和ClO2溶于水后更易与SO2和NO反应。 ①亚氯酸盐脱除SO2的离子方程式为 。 ②pH越小,脱除率越大,其原因是 。 答案 (每空2分)(1)+3 6∶1 (2)1.1×1012 (3)①2SO2+ClO2-+2H2O 2SO42-+Cl-+4H+ ②亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出ClO2及Cl2,ClO2和Cl2溶于水可提高脱除率 10.(2018吉林长春普通高中一模,15)(16分)工业生产中,海水提取溴常用空气吹出法。某化学实验小组设计了如下实验装置(夹持装置略去)模拟该法从浓缩的海水中提取溴。 已知:Br2的沸点为58.78 ℃,密度为3.119 g/cm3,微溶于水,有毒。 回答下列问题: (1)实验步骤如下: ①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束; ②关闭活塞 ,打开活塞 ,向A中鼓入足量热空气; ③关闭b,打开a,再通过A向B中通入足量Cl2; ④取B中所得溶液进行蒸馏,收集液溴。 (2)步骤①A中主要反应的离子方程式为 。 (3)X试剂可以是 (填序号),步骤②B中X试剂与Br2发生反应的离子方程式为 。 A.H2O B.饱和食盐水 C.饱和Na2SO3溶液 (4)该实验中尾气处理所用的试剂可为 。 (5)蒸馏时,除酒精灯、石棉网、铁架台外,还应该选择仪器 (填序号)。蒸馏操作中应控制温度为 。 答案 (每空2分)(1)a、c b、d (2)Cl2+2Br- Br2+2Cl- (3)C Br2+SO32-+H2O SO42-+2Br-+2H+ (4)NaOH溶液(合理即可) (5)①③⑤⑥⑦ 59 ℃(58.78 ℃~60 ℃之间均可) 11.(2017广东中山一中二测,25)(16分)CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下: 已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等; ②CoCl2·6H2O的熔点为86 ℃,加热至110~120 ℃时,失去结晶水生成无水氯化钴。 ③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为0.01 mol/L) 沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Mn(OH)2 开始沉淀 2.7 7.6 7.6 4.0 7.7 完全沉淀 3.7 9.6 9.2 5.2 9.8 (1)水钴矿进行预处理时加入Na2SO3,其主要作用是(用离子方程式说明) 。 (2)写出NaClO3在浸出液中发生主要反应的离子方程式: ;若不慎向浸出液中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式: 。 (3)系列操作中包含3个基本实验操作,依次是 、 和过滤。 (4)浸出液加Na2CO3调pH至5.2时,所得滤液中金属离子有 ;萃取液中含有的主要金属阳离子是 。 (5)为寻找合适的萃取剂,发现某种萃取剂对部分离子的萃取率与溶液pH的关系如图所示。请写出有关萃取规律,并说明本流程是否能用该萃取剂进行萃取。 ; 。 答案 (除标注外,其余每空2分)(1)2Co3++SO32-+H2O2Co2++SO42-+2H+ (2)6Fe2++ClO3-+6H+6Fe3++Cl-+3H2O ClO3-+5Cl-+6H+ 3Cl2↑+3H2O (3)蒸发浓缩 冷却结晶 (4)Mn2+、Co2+、Na+ Mn2+ (5)规律:同种离子的萃取率随pH增大而增加(或相同pH时,不同离子萃取率顺序为Fe3+、Zn2+、Cu2+、Mn2+、Co2+、Ni2+或当pH达到5及以上时,各离子的萃取率均已接近100%)(1分) 当溶液pH达到5.2时,Co2+与Mn2+萃取率均接近100%,无法使用该萃取剂分离Co2+和Mn2+(1分)查看更多