- 2021-04-14 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2019届山东省德州市高二上学期期末考试(2018
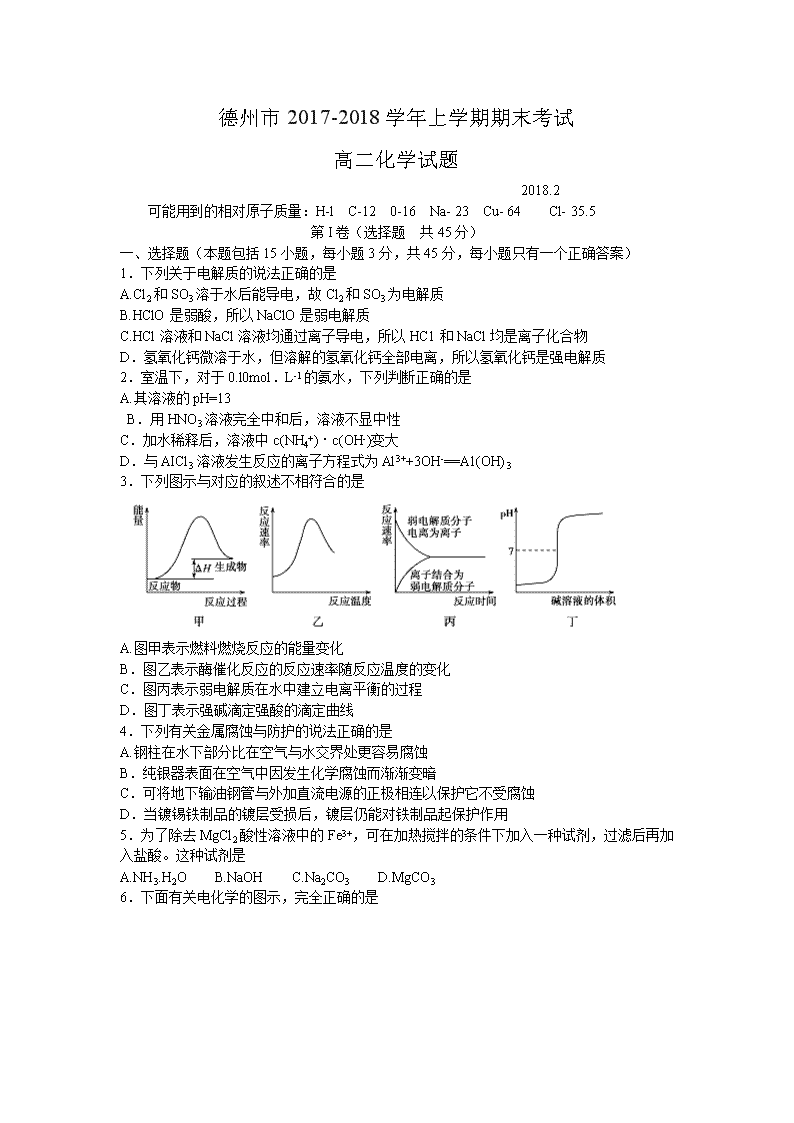
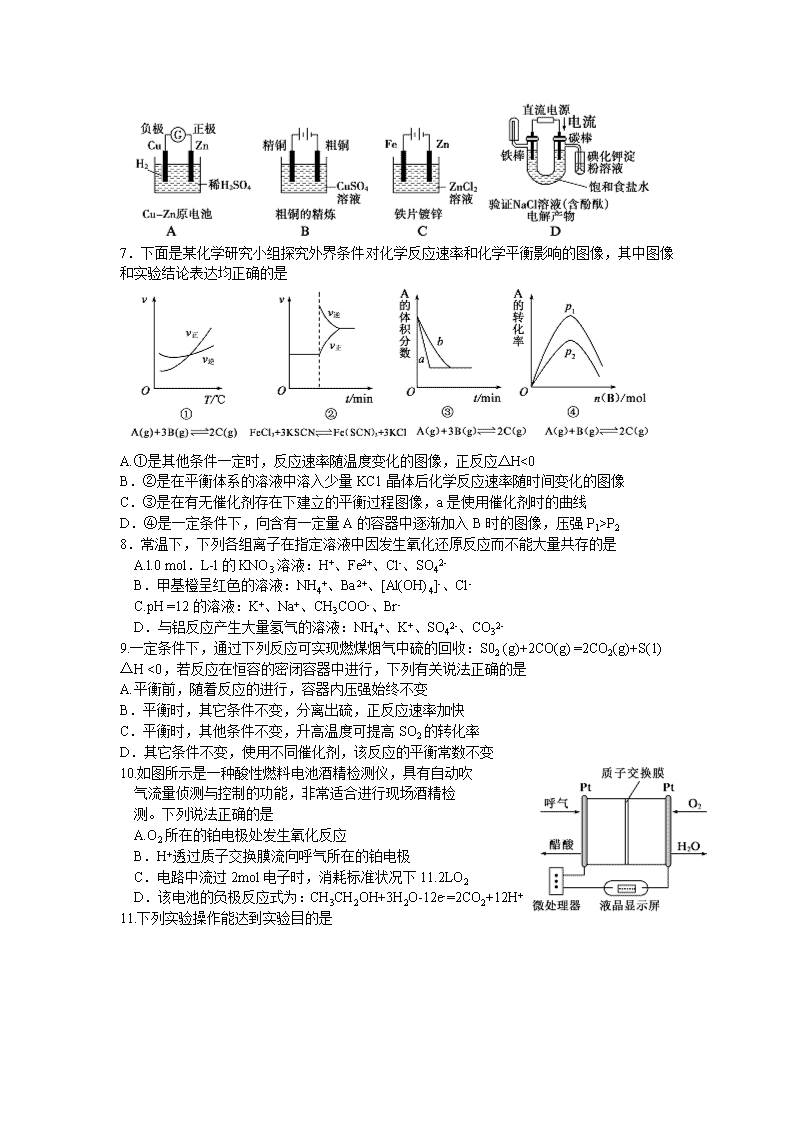
德州市2017-2018学年上学期期末考试 高二化学试题 2018.2 可能用到的相对原子质量:H-l C-12 0-16 Na- 23 Cu- 64 Cl- 35.5 第I卷(选择题 共45分) 一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案) 1.下列关于电解质的说法正确的是 A.Cl2和SO3溶于水后能导电,故Cl2和SO3为电解质 B.HClO是弱酸,所以NaClO是弱电解质 C.HCl溶液和NaCl溶液均通过离子导电,所以HC1和NaCl均是离子化合物 D.氢氧化钙微溶于水,但溶解的氢氧化钙全部电离,所以氢氧化钙是强电解质 2.室温下,对于0.l0mol.L-1的氨水,下列判断正确的是 A.其溶液的pH=13 B.用HNO3溶液完全中和后,溶液不显中性 C.加水稀释后,溶液中c(NH4+)·c(OH-)变大 D.与AICl3溶液发生反应的离子方程式为Al3++3OH-==A1(OH)3 3.下列图示与对应的叙述不相符合的是 A.图甲表示燃料燃烧反应的能量变化 B.图乙表示酶催化反应的反应速率随反应温度的变化 C.图丙表示弱电解质在水中建立电离平衡的过程 D.图丁表示强碱滴定强酸的滴定曲线 4.下列有关金属腐蚀与防护的说法正确的是 A.钢柱在水下部分比在空气与水交界处更容易腐蚀 B.纯银器表面在空气中因发生化学腐蚀而渐渐变暗 C.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 D.当镀锡铁制品的镀层受损后,镀层仍能对铁制品起保护作用 5.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入盐酸。这种试剂是 A.NH3.H2O B.NaOH C.Na2CO3 D.MgCO3 6.下面有关电化学的图示,完全正确的是 7.下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是 A.①是其他条件一定时,反应速率随温度变化的图像,正反应△H<0 B.②是在平衡体系的溶液中溶入少量KC1晶体后化学反应速率随时间变化的图像 C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线 D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强P1>P2 8.常温下,下列各组离子在指定溶液中因发生氧化还原反应而不能大量共存的是 A.l.0 mol.L-l的KNO3溶液:H+、Fe2+、Cl-、SO42- B.甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- C.pH =12的溶液:K+、Na+、CH3COO-、Br- D.与铝反应产生大量氢气的溶液:NH4+、K+、SO42-、CO32- 9.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:S02 (g)+2CO(g) =2CO2(g)+S(1) △H <0,若反应在恒容的密闭容器中进行,下列有关说法正确的是 A.平衡前,随着反应的进行,容器内压强始终不变 B.平衡时,其它条件不变,分离出硫,正反应速率加快 C.平衡时,其他条件不变,升高温度可提高SO2的转化率 D.其它条件不变,使用不同催化剂,该反应的平衡常数不变 10.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹 气流量侦测与控制的功能,非常适合进行现场酒精检 测。下列说法正确的是 A.O2所在的铂电极处发生氧化反应 B.H+透过质子交换膜流向呼气所在的铂电极 C.电路中流过2mol电子时,消耗标准状况下11.2LO2 D.该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+ 11.下列实验操作能达到实验目的是 12.下列说法正确的是 A.pH=5的HpS溶液中,c(H+)=c(HS-) =1×10-5 mol/L B.含有AgCl和Agl固体的悬浊液中,c(Ag+)>c(Cl-) =c(I-) C.在新制氯水中加入氯化钠固体,水的电离平衡不移动 D.pH=2的CH3 COOH和pH=12的NaOH溶液等体积混合c(Na+ )查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档