- 2021-04-13 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山西省运城市空港新区一中2019-2020学年高一9月月考化学试题
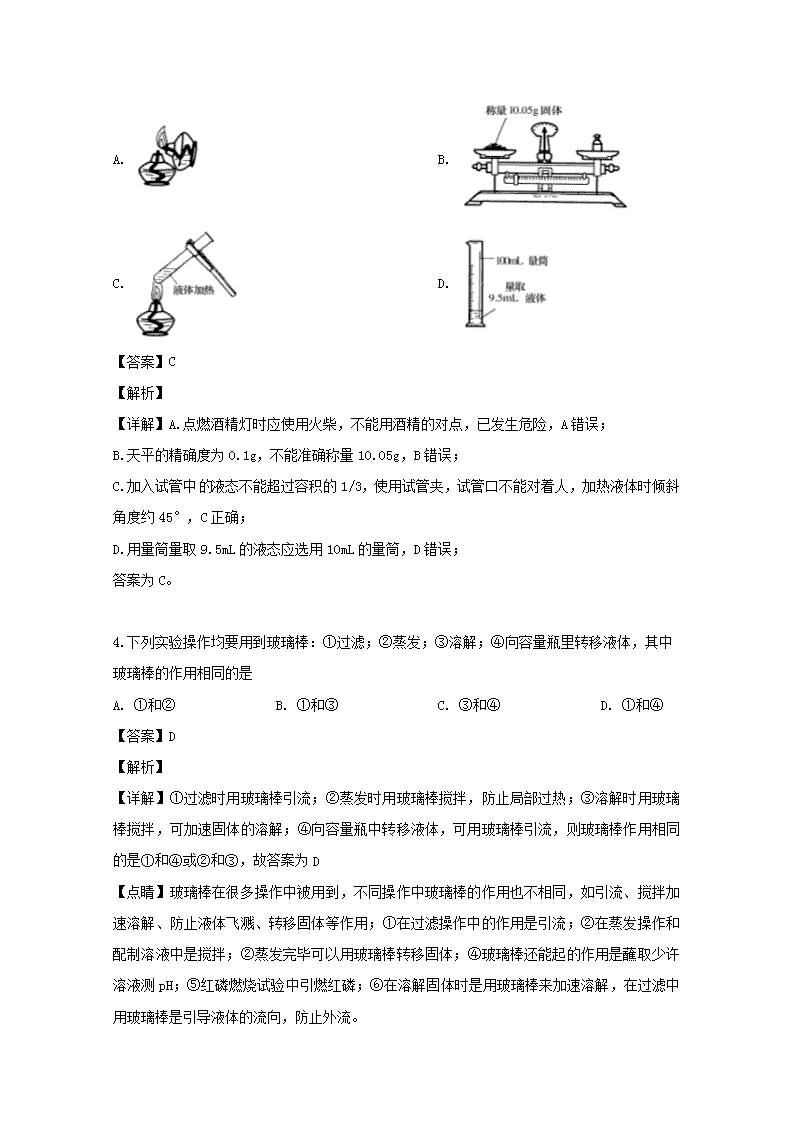
www.ks5u.com 山西省空港一中2019-2020学年度第一学期月考(9月) 高一化学试题 可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 S 32 一、单项选择题(共16小题,每小题3分,共48分。每小题只有一个选项符合题意) 1.使用化学药品必须注意安全,下列药品对应的警示标志正确的是( ) A. 酒精 B. 浓硫酸 C. 汽油 D. 浓硝酸 【答案】B 【解析】 【详解】A、酒精是易燃液体,故A错误; B、浓硫酸有强腐蚀性,是腐蚀品,故B正确; C、汽油是易燃液体,不是爆炸品,故C错误; D、浓硝酸有腐蚀性,没有剧毒,不是剧毒品,故D错误。 2.下列仪器:①烧杯 ②锥形瓶 ③圆底烧瓶 ④试管 ⑤坩埚,其中可用酒精灯直接加热的仪器是 A. ④⑤ B. ①②③④ C. ①③ D. ④ 【答案】A 【解析】 【详解】可以用酒精灯直接加热的仪器有:坩埚、蒸发皿、试管、燃烧匙等,垫上石棉网可以加热的仪器有烧杯、烧瓶、锥形瓶等,所以能够直接加热的为:④⑤。 故选A。 3.下列有关实验操作正确的是( ) A. B. C. D. 【答案】C 【解析】 【详解】A.点燃酒精灯时应使用火柴,不能用酒精的对点,已发生危险,A错误; B.天平的精确度为0.1g,不能准确称量10.05g,B错误; C.加入试管中液态不能超过容积的1/3,使用试管夹,试管口不能对着人,加热液体时倾斜角度约45°,C正确; D.用量筒量取9.5mL的液态应选用10mL的量筒,D错误; 答案为C。 4.下列实验操作均要用到玻璃棒:①过滤;②蒸发;③溶解;④向容量瓶里转移液体,其中玻璃棒的作用相同的是 A. ①和② B. ①和③ C. ③和④ D. ①和④ 【答案】D 【解析】 【详解】①过滤时用玻璃棒引流;②蒸发时用玻璃棒搅拌,防止局部过热;③溶解时用玻璃棒搅拌,可加速固体的溶解;④向容量瓶中转移液体,可用玻璃棒引流,则玻璃棒作用相同的是①和④或②和③,故答案为D 【点睛】玻璃棒在很多操作中被用到,不同操作中玻璃棒的作用也不相同,如引流、搅拌加速溶解、防止液体飞溅、转移固体等作用;①在过滤操作中的作用是引流;②在蒸发操作和配制溶液中是搅拌;②蒸发完毕可以用玻璃棒转移固体;④玻璃棒还能起的作用是蘸取少许溶液测pH;⑤红磷燃烧试验中引燃红磷;⑥在溶解固体时是用玻璃棒来加速溶解,在过滤中用玻璃棒是引导液体的流向,防止外流。 5.为达到下列实验目的,所采用的方法正确的是( ) A. 分离汽油和水的混合物——分液 B. 分离水和酒精的混合物——分液 C. 用酒精从碘水中提取碘——萃取 D. 从溴水中提取溴——分液 【答案】A 【解析】 【详解】A.水和汽油的混合物分层,则利用分液法可分离,A项正确; B.水和酒精互溶,不能采用分液方法分离,B项错误; C. 酒精与水互溶,不能作为萃取剂,C项错误; D.溴水不分层,不能利用分液分离,溴易溶于有机溶剂,不易溶于水,应利用萃取分离,D项错误; 答案选A。 【点睛】萃取剂的选择遵循四原则: 1、与原溶剂不互溶;2、与被萃取的物质不反应;3、被萃取的物质在萃取剂中的溶解度比原溶剂大;4、要不易于挥发,要特别注意酒精不能作为水溶液中溶质的萃取剂。 6.与6.4gSO2所含的氧原子数相等的NO2的质量为( ) A. 3.2g B. 4.6g C. 6.4g D. 2.3g 【答案】B 【解析】 【详解】6.4g二氧化硫的物质的量为=0.1mol,SO2、NO2分子均含有2个氧原子,二者含有氧原子数目相等,则二者物质的量相等,即NO2的物质的量为0.1mol,则NO2的质量为0.1mol×46g/mol=4.6g,故B正确; 答案选B。 7.下列叙述中正确的是( ) A. 1 mol任何气体所占体积约为22.4 L B. 配制1 mol·L-1 NaCl溶液 1 L,其方法是将58.5 g NaCl溶于1 L 水中 C. 1 mol NH3中约含有6.02×1024个电子 D. 1 mol O2的质量是32 g·mol-1 【答案】C 【解析】 【详解】A项,气体摩尔体积是指1 mol任何气体所占的体积,其大小是不确定的,会随着温度、压强的变化而变化,22.4 L/mol是标准状况下的气体摩尔体积,故A项错误; B项,58.5 g NaCl溶于1 L水中,所配溶液体积大于1 L,溶液浓度不等于1 mol·L-1,故B项错误; C项,1个NH3分子含有10个电子,则1 mol NH3含有10mol 电子,即6.02×1024个电子,故C项正确; D项,质量的单位为g,摩尔质量的单位为g·mol-1,故D项错误。 综上所述,本题正确答案为C。 8.下列说法中,正确的是( ) A. N的摩尔质量是14g B. 1molCl2中含有的氯原子数约为 C. 溶液中含有 D. 标准状况下,的体积约是 【答案】B 【解析】 【详解】A.N2的摩尔质量为28g/mol,注意单位,故A错误; B.氯气的物质的量是1mol,氯原子物质的量为2mol,氯原子数约为2×6.02×1023,故B正确; C.0.1 mol/L Na2SO4溶液中Na+浓度为0.2mol/L,溶液体积未知,不能确定Na+的物质的量,故C错误; D.18g水的物质的量为1mol,标况下水不是气体,1mol水的体积不是22.4L,故D错误。 答案选B。 9.在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是 A. 该溶液溶质的物质的量浓度为1 mol·L-1 B. 该溶液中含有58.5 g NaCl C. 配制100 mL该溶液需用5.85 g NaCl D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol 【答案】B 【解析】 【详解】A、钠离子物质的量等于氯化钠的物质的量,所以氯化钠的物质的量浓度为=1mol/L,故A正确; B、钠离子物质的量等于氯化钠的物质的量,所以氯化钠的物质的量为0.5mol,质量为0.5mol×58.5g/mol=29.25g,故B错误; C、氯化钠的物质的量浓度为1mol/L,配制100mL该溶液需用NaCl质量为0.1L×1mol/L×58.5g/mol=5.85g,故C正确; D、溶液中氯离子浓度为1mol/L,量取100mL该溶液倒入烧末中,烧杯中NaCl的物质的量为0.1L×1mol/L=0.1mol,故D正确。 故选:B。 10.实验室配制500 mL0.2 mol·L-1的Na2CO3溶液,下列说法错误的是( ) A. 称量时,若将Na2CO3固体置于托盘天平右盘,将导致所配溶液浓度偏小 B. 将Na2CO3固体置于烧杯中溶解,冷却后转移到容量瓶中 C. 定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线 D. 将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中 【答案】C 【解析】 【详解】A. 称量时,若将Na2CO3固体置于托盘天平右盘,称量的实际质量应该是砝码减去游码的质量,所以将导致所配溶液浓度偏小,故A正确; B. 溶解过程应该在烧杯中进行,转移之前溶液要恢复室温,故B正确; C. 定容摇匀后发现液面低于刻度线,再滴加蒸馏水至刻度线导致溶液浓度偏低,故C错误; D. 容量瓶不能长时间存放药品,所以将配制好的Na2CO3溶液转移至带橡胶塞的试剂瓶中,故D正确, 故选C。 11.下列配制的溶液浓度偏高的是 A. 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 B. 配制盐酸溶液定容时,仰视容量瓶刻度线 C. 称量4 g NaOH配1000 mL 0.1 mol/L溶液时,砝码错放左盘 D. NaOH溶解后未经冷却即注入容量瓶至刻度线 【答案】D 【解析】 【详解】A.配制盐酸用量筒量取盐酸时俯视刻度线,量取的盐酸体积偏少,则以该盐酸为溶质来配制溶液的浓度就偏低,A不选; B.配制盐酸定容时,仰视容量瓶刻度线,则加入的溶剂水偏多,使溶液的体积偏大,故导致溶液的浓度偏低,B不选; C.称量4 g NaOH配制0.1 mol/L NaOH溶液1000 mL时,砝码错放左盘,由于没有使用游码,因此质量不变,配制的溶液的浓度也不变,C不选; D.NaOH溶解后未经冷却即注入容量瓶至刻度线,当溶液恢复至室温时,溶液的体积低于刻度线,则配制的溶液的浓度就偏高,D选。 答案选D。 【点睛】明确实验原理和误差分析的依据是解答的关键,选项C是解答的易错点,注意物品和砝码放反了不一定产生误差,关键是看是否使用了游码。 12.某乙醇的水溶液中,乙醇所含的氢原子与水所含的氢原子数相等,该溶液中乙醇的质量分数为( ) A. 78% B. 46% C. 23% D. 11.5% 【答案】B 【解析】 【分析】 乙醇溶液中溶质的质量分数=×100%,因此需要判断溶质乙醇与溶剂水的质量关系;每个乙醇C2H5OH分子中含6个H原子,每个水H2O分子中含2个H原子;根据“乙醇分子里所含的氢原子总数与水分子里所含的氢原子总数相等” 可推算溶液中乙醇与水的质量关系。 【详解】根据氢原子数相等,找出乙醇分子与水分子间的关系,进而确定出质量关系。 C2H5OH~6H~3H2O 46 54 此乙醇溶液中溶质的质量分数为:×100%=46%, 故答案选B。 13.将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3﹣的物质的量浓度为 A. 5a/b mol/L B. 10a/b mol/L C. b/5a mol/L D. a/b mol/L 【答案】B 【解析】 【分析】 根据硝酸镁的化学式可知硝酸根的浓度为硝酸镁浓度的2倍,即硝酸根浓度为10mol/L,由稀释定律可知,稀释前后硝酸根的物质的量不变,据此计算。 【详解】根据硝酸镁的化学式可知硝酸根的浓度为硝酸镁浓度的2倍,所以硝酸根浓度为10mol/L。令稀释后硝酸根的浓度为c,根据稀释定律可知,稀释前后硝酸根的物质的量不变,则:10mol/L×a mL=c×bmL,解得,c=mol/L;故选B。 14.同温同压下,质量相同的H2S、NH3两种气体,下列说法正确的是 A. 所占体积之比为1:2 B. 所含分子数之比为2:1 C. 两种气体的密度之比为1:2 D. 所含的电子数之比为2:1 【答案】A 【解析】 【详解】A.同温同压下,质量相同的H2S、NH3两种气体的物质的量之比是(1/34):(1/17)=1:2,同温同压下,两气体体积比等于物质的量比,为1:2,故A正确; B.同温同压下,质量相同的H2S、NH3两种气体的物质的量之比是(1/34):(1/17)=1:2,分子数之比等于物质的量比,为1:2,故B错误; C.相同条件下气体密度之比是摩尔质量之比,则两种气体的密度之比为2:1,故C错误; D.H2S、NH3两种气体的电子数分别是18和10,则所含的电子数之比为(1×18):(2×10)=9:10,故D错误; 故答案选A。 【点睛】本题考查阿伏加德罗定律及物质的量的计算,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查。 15.将标准状况下密度为ρ的a L HCl(g)溶于1 000 g水中,得到盐酸的密度为b g·cm-3,则该盐酸的物质的量浓度是 A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1 【答案】C 【解析】 【详解】标准状况下密度为ρ的a L HCl(g)的物质的量是 、质量是;将标准状况下密度为ρ的a L HCl(g)溶于1 000 g水中,得到盐酸的质量为1000+,盐酸的体积是 ,该盐酸的物质的量浓度是÷= mol·L-1。故选C。 16.已知8.4gA物质和3.65gB物质恰好完全反应,生成标准状况下2.24L二氧化碳气体和含质子数为6.02×1023个的水分子,还有0.1mol E物质,则E物质的摩尔质量为 A. 36.5 g/mol B. 84g/mol C. 44g/mol D. 58.5g/mol 【答案】D 【解析】 【详解】标准状况下2.24L二氧化碳气体的物质的量为:2.24L÷22.4L/mol=0.01mol,0.01mol二氧化碳的质量为:0.1mol×44g/mol=4.4g,1个水分子含有10个质子,含质子数为6.02×1023个的水分子的物质的量为:6.02×1023÷6.02×1023 /mol÷10=0.1mol,0.1mol水分子的质量为:0.1mol×18g/mol=1.8g,根据质量守恒定律,E的质量是8.4+3.65-4.4-1.8=5.85g,E的摩尔质量是M=m/n=5.85g/0.1mol=58.5g/mol,故D正确。 故选D。 二、非选择题(共52分) 17.(1)在标准状况下①3.36LNH3②1.204×1023个CH4③18gH2O④0.4molHCl。 a.体积由大到小的顺序_____(填序号,下同)。 b.氢原子个数由大到小的顺序___。 (2)18.6gNa2X含有0.6molNa+,则X2-的摩尔质量为__。 (3)若ag某气体中含有的分子数为b,则cg该气体在标况下体积是(设NA为阿伏加德罗常数的值)____L。 【答案】 (1). ④>②>①>③ (2). ③>②>①>④ (3). 16g/mol (4). 【解析】 【分析】 根据n=N/NA=m/M=V/Vm进行计算,V为标准状况下的气体体积。 【详解】(1)在标准状况下①、②、④为气体,③为液体,①3.36LNH3,物质的量为0.15mol,②1.204×1023个CH4的体积为1.204×1023/NA=0.2mol,为4.48L,④0.4molHCl,体积为8.96L,则体积由大到小的顺序为④>②>①>③;①3.36LNH3,物质的量为0.15mol,含有氢原子数目=n(NH3)3=0.45NA,②1.204×1023个CH4的体积为1.204×1023/NA=0.2mol,含有氢原子数目=n(CH4)=0.8NA,③18gH2O为1mol,含有氢原子数目=n(H2O)2=2NA,④0.4molHCl,含有氢原子数目=n(HCl)1=0.4NA,氢原子个数由大到小的顺序为③>②>①>④; (2)0.6molNa+的质量为13.8g,则X的质量为4.8g,已知N(Na+):N(X2-)=2:1,则n(X2-)=0.3mol,M=m/n=4.8g/0.3mol=16g/mol; (3)cg该气体的分子个数=cgb/ag,则物质的量=cb/(aNA),标况下的体积=cb22.4/(aNA)L。 18.根据下图两套基础实验装置回答问题。 (1)写出下列仪器的名称:①______________、②___________________。 (2)仪器①~④中,使用时必须检查是否漏水的有____________________。(填序号) (3)用装置I制蒸馏水,还缺少的仪器有_________,冷却水从_______口进。 (4)a.现需配制250mL0.2mol•L-1NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是_______________,_______________。 b.配制过程中,下列情况会使配制结果偏高的是________________(填序号)。 ①定容时俯视刻度线观察液面;②容量瓶使用时未干燥;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;④移液时未洗涤烧杯和玻璃棒 c.若实验中加蒸馏水时不慎超过了刻度,应如何处理?______________ 【答案】 (1). 蒸馏烧瓶 (2). 冷凝管 (3). ④ (4). 酒精灯 (5). g (6). 未用玻璃棒引流 (7). 未采用250ml容量瓶 (8). ① (9). 重配 【解析】 【分析】 (1)根据仪器构造判断其名称; (2)有活塞或塞子的仪器使用时需要检查是否漏液; (3)根据蒸馏的实验原理和操作分析判断; (4)根据一定物质的量浓度溶液的配制原理结合装置图分析判断;根据c=n÷V结合不当操作分析。 【详解】(1)根据仪器的结构特点可知①是蒸馏烧瓶,②是冷凝管; (2)有活塞或塞子的仪器使用时需要检查是否漏液,因此在仪器①~④中,使用时必须检查是否漏水的为容量瓶,答案选④; (3)用装置I制蒸馏水采用蒸馏法,必须使用酒精灯加热,则还缺少的仪器为酒精灯,冷凝管中冷却水是下口进水上口出水,即冷却水从g口进,f口出。 (4)a.配制一定物质的量浓度溶液时必须使用玻璃棒引流,防止液体外溅;容量瓶只有一个刻度线,只能用来配制所标容量瓶规格的溶液,因此配制250mL0.2mol•L-1NaCl溶液需要使用250mL容量瓶; b.①定容时俯视刻度线观察液面,溶液体积减少,浓度偏高; ②容量瓶使用时未干燥不影响结果; ③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,溶液体积增加,浓度偏低; ④移液时未洗涤烧杯和玻璃棒,溶质的物质的量减少,浓度偏低; 答案选①; c.若实验中加蒸馏水时不慎超过了刻度,实验失败,需要重配配制。 【点睛】本题考查化学实验方案的评价,把握仪器的使用、混合物分离及溶液的配制等为解答的关键,侧重分析与实验能力的考查,误差分析是解答的易错点。 19.(1)从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是____mol/L,含NaOH的质量____g。 (2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。 (3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则: ①混合气体的密度是_____。 ②混合气体平均摩尔质量是______。 ③CO2和CO的体积之比是_______。 ④CO的体积分数是______。 ⑤CO2和CO的质量之比是_______。 ⑥CO的质量分数是______。 ⑦混合气体中所含氧原子的物质的量是_____。 【答案】 (1). 1 (2). 4 (3). 2mol (4). 4mol/L (5). 1.339g/L (6). 30g/mol (7). 1:7 (8). 87.5% (9). 11:49 (10). 81.7% (11). 0.5625mol 【解析】 【分析】 根据n=m/M、n=V/Vm、c=n/V,结合阿伏加德罗定律、气体摩尔体积和物质的组成分析计算。 【详解】(1)溶液是均一稳定的,从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度仍然是1 mol/L,含NaOH的质量1mol/L×0.1L×40g/mol=4 g。 (2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为44.8L÷22.4L/mol=2mol,因此所配成的盐酸溶液的物质的量浓度为2mol÷0.5L=4mol/L。 (3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则: ①混合气体的密度是15g÷11.2L=1.339g/L。 ②混合气体的物质的量是0.5mol,则混合气体的平均摩尔质量是15g÷0.5mol=30g/mol。 ③设混合气体中CO与CO2的物质的量分别是xmol、ymol,则28x+44y=15、11.2÷22.4=x+y,解得x=7/16、y=1/16,则CO2和CO的体积之比是1:7。 ④CO的体积分数是=87.5%。 ⑤CO2和CO的质量之比是1×44:7×28=11:49。 ⑥CO的质量分数是=81.7%。 ⑦混合气体中所含氧原子的物质的量是7/16mol+1/16mol×2=0.5625mol。 20.实验室配制1mol/L的NaOH溶液240mL, (1)实验操作中用天平称量___gNaOH固体; (2)容量瓶在使用前的操作是___ (3)若实验时遇到下列情况,所配溶液的浓度偏大的是___。 ①称量氢氧化钠固体的时间过长。 ②容量瓶用蒸馏水洗涤后残留有少量的水。 ③溶液未冷却即转入容量瓶。 ④在转移氢氧化钠溶液后未洗涤烧杯。 ⑤定容时俯视刻度线。⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线。 (4)取配制的1mol/L的NaOH溶液10mL,再稀释成100mL,再从中取出10mL,这10mL溶液的物质的量浓度为____。 【答案】 (1). 10.0 (2). 检查容量瓶是否漏液 (3). ③⑤ (4). 0.1mol/L 【解析】 【分析】 (1)配制1mol/L的NaOH溶液240mL,应选用250mL的容量瓶; (2)在使用容量瓶前应检验容量瓶是否漏液; (3)①称量氢氧化钠固体的时间过长,NaOH潮解,导致固体质量增大; ②容量瓶用蒸馏水洗涤后残留有少量的水,对配置溶液的浓度无影响; ③溶液未冷却即转入容量瓶,温度较高,导致所配溶液的体积偏小; ④在转移氢氧化钠溶液后未洗涤烧杯,导致所配溶液中NaOH的含量偏低; ⑤定容时俯视刻度线,导致所配溶液的体积偏小; ⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线,导致所配溶液的体积偏大; (4)根据c1V1=c2V2计算。 【详解】(1)配制1mol/L的NaOH溶液240mL,应选用250mL的容量瓶,则需要NaOH的质量=1mol/L0.25L40g/mol=10.0g; (2)在使用容量瓶前应检验容量瓶是否漏液,将容量瓶倒转后观察是否漏水,再将瓶塞旋转180度观察是否漏水; (3)①称量氢氧化钠固体的时间过长,NaOH潮解,导致固体质量增大,NaOH的浓度偏小,①错误; ②容量瓶用蒸馏水洗涤后残留有少量的水,对配置溶液的浓度无影响,②错误; ③溶液未冷却即转入容量瓶,温度较高,导致所配溶液的体积偏小,浓度偏大,③正确; ④在转移氢氧化钠溶液后未洗涤烧杯,导致所配溶液中NaOH的含量偏低,浓度偏小,④错误; ⑤定容时俯视刻度线,导致所配溶液的体积偏小,浓度偏大,⑤正确; ⑥摇匀后,发现溶液的液面低于刻度线,又加水至刻度线,导致所配溶液的体积偏大,浓度偏小,⑥错误; 答案为③⑤; (4)根据c1V1=c2V2,c1=c2V2/V1=1mol/L10mL/100mL=0.1mol/L。 【点睛】溶液稀释时,溶质的物质的量不变。 21.(1)某温度下,向2m g 16%的CuSO4溶液中加入m g CuSO4•5H2O,溶液恰好达到饱和,该饱和溶液中CuSO4的质量分数为_____。 (2)标准状况下,1体积水可溶解V体积HCl气体,所得溶液的密度为ρg/cm3,则所得溶液溶质的质量分数表示为_____,溶质的物质的量浓度表示为_____。 (3)若以ω1和ω2分别表示浓度为a mol•L﹣1和b mol•L﹣1硫酸溶液的溶质的质量分数,且知 2a=b,则下列推断正确的是(硫酸溶液的密度比纯水的大)_____(填序号) A. 2ω1=ω2 B. ω2<2ω1 C. ω2>2ω1 D. ω1<ω2<2ω1 (4)若以ω1和ω2分别表示浓度为a mol•L﹣1和b mol•L﹣1氨水的溶质的质量分数,且知2ω1=ω2,则下列推断正确的是(氨水的密度比纯水的小)_____(填序号) A. 2a=b B. 2a<b C. 2a>b D. a<b<2a. 【答案】 (1). 32% (2). (3). (4). BD (5). CD 【解析】 【分析】 (1)质量分数= ; (2) 质量分数=,物质的量浓度c= ; (3)硫酸的浓度越大密度越大,根据 判断ω2、ω1的关系; (4)氨水的浓度越大密度越小,根据 判断a、b的关系。 【详解】(1) m(CuSO4)= 2m×16%+m ×=0.96m g,CuSO4溶液的质量是2m+m=3m g ,质量分数==32%; (2)假设1体积为1L,标准状况下, V体积HCl气体的物质的量是mol,质量为×36.5g ,所得溶液质量为×36.5g+1000g;溶液体积为,则所得溶液溶质的质量分数表示为(×36.5g)÷(×36.5g+1000g) ×100%=,溶质的物质的量浓度表示为mol÷=mol/L。 (3)根据,a=,b= ,2a=b,, ,硫酸的浓度越大密度越大, ,所以ω2<2ω1;物质的量浓度越大,质量分数越大,所以ω1<ω2<2ω1,故选BD; (4)根据,ω1=,ω2=,2ω1=ω2, ,氨水的浓度越大密度越小, ,所以2a>b,质量分数越大,物质的量浓度越大,所以a<b<2a,故选CD。 查看更多