- 2021-04-13 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年湖南省涟源一中高二上学期第二次月考化学试题 Word版
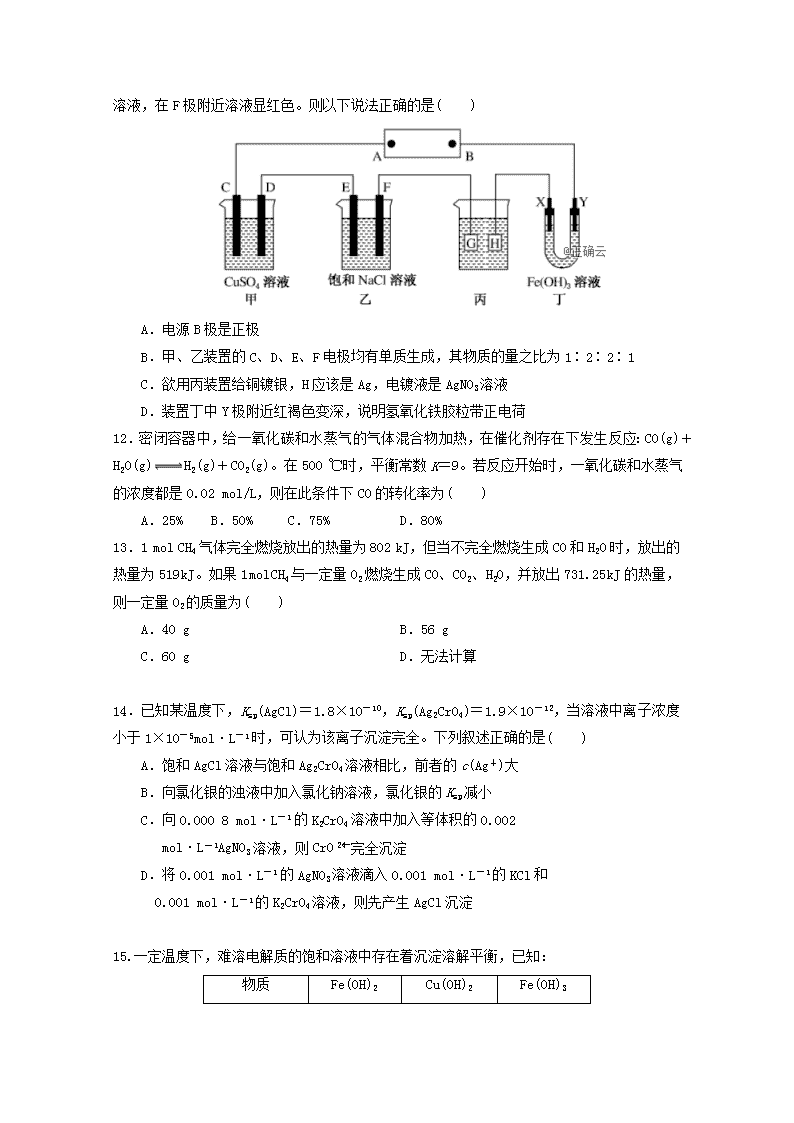
启用前★保密 2018-2019学年湖南省涟源一中高二上学期第二次月考化 学 时间:90分钟 分值:100分 命题人:张小聪 审题人:曾永国 一、选择题(本题共16小题,3分一题,共48分) 1.下列说法或表示法正确的是( ) A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 B.需要加热的反应说明它是吸热反应 C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ D.1 mol S完全燃烧放热297.3 kJ,热化学方程式为S+O2===SO2 ΔH=-297.3 kJ·mol-1 2.已知在25℃、101 kPa条件下: 4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834.9 kJ·mol-1 4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1 由此得出的结论正确的是( ) A.等质量的O2比O3能量低,由O2变O3为放热反应 B.等质量的O2比O3能量高,由O2变O3为吸热反应 C.O3比O2稳定,由O2变O3为放热反应 D.O2比O3稳定,由O2变O3为吸热反应 3.已知反应I2(g)+H2(g) 2HI(g) ΔH <0,下列说法正确的是( ) A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数 B.升高温度将缩短达到平衡的时间 C.达到平衡后,保持温度和容积不变,充入氩气,正逆反应速率同等倍数增大 D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小 4.当把晶体N2O4放入密闭容器中气化,并建立了N2O4(g)2NO2(g)平衡后,保持温度不变,再通入若干N2O4气体,待反应达到新的平衡时,则新平衡与旧平衡相比,值( ) A.变大 B.不变 C.变小 D.无法确定 5.在25℃时,某NH4Cl溶液的pH为4,下列说法中正确的是 ① 溶液中c(H+) > c(OH-) 且 c(H+)·c(OH-)=1×10-14 ; ② 由水电离出的 c(H+)约为1×10-10 mol/L; ③ 溶液中c(Cl-) > c(NH4+) > c(H+) > c(OH-) A.①② B.①③ C.②③ D.①②③ 6.常温时,下列各组离子在指定溶液中能大量共存的是 A.pH = 1的溶液中: Fe2+、NO3-、SO42-、Na+ B.c(Fe3+) = 0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- C.c(H+)/c(OH-) = 1012的溶液中: NH4+、Al3+、NO3-、Cl- D.由水电离的c(H+) = 1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- 7.下列说法正确的是( ) A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 B.配制一定浓度的FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 C.用加热的方法可以除去KCl溶液中的Fe3+ D.洗涤油污常用热的碳酸钠溶液 8.常温下,下列有关叙述正确的是 ( ) A.醋酸溶液加水稀释后,各离子浓度均减小 B.NaHCO3与Al2(SO4)3混合作泡沫灭火剂的原理与水解有关 C.加热滴有酚酞的CH3COONa溶液,溶液颜色变浅 D.0.1 mol·L-1Na2CO3溶液中,c(HC)>c(C) 9.现代科技的发展使人们对有机物的研究更加高效、准确.下列说法不正确的是( ) A.1H核磁共振谱能反映出有机物中不同环境氢原子的种数和个数 B.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量小,速度快 C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团 D.同位素示踪法可以用来确定有机反应中化学键的断裂位置 10.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( ) A.电解饱和食盐水时,阳极的电极反应为:2Cl--2e-===Cl2↑ B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH- C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为: Cu-2e-===Cu2+ D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+ 11 .如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是( ) A.电源B极是正极 B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1 C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 12.密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( ) A.25% B.50% C.75% D.80% 13.1 mol CH4气体完全燃烧放出的热量为802 kJ,但当不完全燃烧生成CO和H2O时,放出的热量为519 kJ。如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25 kJ的热量,则一定量O2的质量为( ) A.40 g B.56 g C.60 g D.无法计算 14.已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于1×10-5mol·L-1时,可认为该离子沉淀完全。下列叙述正确的是( ) A.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 B.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 C.向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO完全沉淀 D.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和 0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀 15.一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知: 物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp(25 ℃) 8.0×10-16 2.2×10-20 4.0×10-38 25 ℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1 L混合溶液,根据上表数据判断,下列说法不正确的是( ) A.在pH=5的溶液中,Fe3+不能大量存在 B.混合溶液中c(SO)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4 C.向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀 D.向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液 16.加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法中正确的是( ) A.电解过程中OH-从a极区通过离子交换膜c进入b极区 B.随着电解进行,KOH溶液浓度会逐渐减小 C.a电极反应式:I--6e-+6OH-===IO+3H2O,a极区的KI最终转变为KIO3 D.当阳极有0.1 mol I-放电时,阴极生成6.72 L H2 二、填空题(本题空52分) 17、(10分)(1)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1 ① 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1 ② Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+19 kJ·mol-1 ③ 请写出CO还原FeO的热化学方程式: ___________________________________________________________。 (2).某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表: 时间(min) 0 10 20 30 40 50 物质的量(mol) B 2.00 1.36 1.00 1.00 1.20 1.20 D 0 0.32 0.50 0.50 0.60 0.60 E 0 0.32 0.50 0.50 0.60 0.60 ①T ℃时,该反应的平衡常数K=________。 ②30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。 a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度 ③若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。 18.按要求回答下列问题(14分) (1)常温下,H2SO3的电离常数Ka1=1.0×10-2、Ka2=1.0×10-7。 NaHSO3的水解平衡常数Kh=________,其溶液pH________(填“>”“<”或“=”)7;若向NaHSO3溶液中加入少量的I2(I2能氧化+4价的硫),则溶液中将________(填“增大”“减小”或“不变”)。 (2) 已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11。25 ℃时,向0.01 mol·L-1的MgCl2溶液中逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的c(H+)为________;当Mg2+完全沉淀时,溶液的pH为________。(忽略溶液体积变化,已知 ,lg 7.7=0.9) (3)量取10.00 mL密度为1.13 g·mL-1的H2O2溶液至烧杯中稀释,冷却后转移至250 mL容量瓶中,加水定容,摇匀。移取配制好的过氧化氢溶液25.00 mL至锥形瓶中,加入稀H2SO4酸化,用蒸馏水稀释,作被测试样。用KMnO4标准溶液滴定被测试样,重复滴定三次,平均耗用1 mol·L-1KMnO4标准溶液11.30 mL,则 ①滴定到达终点的现象_ _ ②原H2O2溶液中H2O2的质量分数为________。 19.(8分)(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。 ①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________________________________。 ②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol;用平衡移动原理解释阴极区pH增大的原因:___________________________________________________________ (2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为___________________ 20. 按要求填空:(20分) (1)用系统命名法命名下列物质或者根据名称写出对应的结构简式 ____ _ CH3CH(CH3)CH2CH(CH3)CH(CH3)CH3 ___ _ 3,4,4-三甲基-1-戊炔_____________ (2)指出下列物质中的官能团 甲 _ 乙 _ 丙 _ (3)① C5H10Cl2的同分异构体有 _种 ② 苯环上含 -C3H6Cl -CH3 -C4H9三个取代基的同分异构体有 _种 (4)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究. 步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水, 再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水. 步骤二:通过仪器分析得知X的相对分子质量为106. 步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3 (如图Ⅰ) 步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ. 试填空: ①X的分子式为___________;X的习惯命名为___________; ②步骤二中的仪器分析方法称为___________ 涟源一中2018年下学期高二第二次月考试卷¨化学 答案 1—5 CDBBB 6—10 CDBAB 11—16 DCCDDC 17.(1)CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1 (2)①0.25 ②a ③小于 等于 18. (1) 1.0×10-12 < 增大 (2)2.4×10-10 pH=11.1 (3) 当滴入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30秒内不褪色 85% 19. (1)①Cl-- 5e-+2H2O===ClO2↑+4H+ ②0.01 在阴极发生2H++2e-===H2↑,H+浓度减小,使H2OH++OH-的平衡向右移动,OH-浓度增大,pH增大 (2)O2+4e-===2O2- 20(1)5-甲基-2-庚烯 2,3,5-三甲基己烷 CHCCH(CH3)C(CH3)3 (2)羰基(或酮基)、酚羟基 羧基 醛基、醇羟基 (3)21 200(3分) (4)C8H10 对二甲苯 质谱法查看更多