2020版新高考化学(鲁京津琼)一轮复习海水资源的综合利用(提取溴,碘)作业
1.海水是重要的资源,可以制备一系列物质。下列说法正确的是( )
A.步骤②中,应先通 CO2,再通 NH3
B.除去粗盐中的 SO2-4 、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是 NaOH 溶液
→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
C.步骤③中可将 MgCl2·6H2O 晶体直接进行灼烧制得无水 MgCl2
D.步骤④⑤⑥反应中,溴元素均被氧化
2.(2018·凯里一中高三月考)NaCl 既是一种调味品,又是一种重要的化工原料,用 NaCl 可制
备一系列物质(如图)。下列说法正确的是( )
A.上述转化关系中所涉及物质都属于电解质
B.实际生产中操作 X 是向 NaCl 饱和溶液中先通入 NH3,再通入 CO2
C.工业上制备 K 利用了金属性:Na
I2>IO-3
C.足量 Cl2 能使湿润的 KI淀粉试纸变白,其原因可能是 5Cl2+I2+6H2O===2HIO3+10HCl
D.途径Ⅱ中若生成 1 mol I2,反应中转移的电子数为 10NA
5.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采取下面的工艺流程生产单质碘。
根据以上转化关系,下列说法正确的是( )
A.根据流程,可知甲为 AgI,乙为 FeI3,丙为 Ag2SO4,丁为 FeCl2
B.第③步操作中,Fe 屑和甲反应的离子方程式为 2Ag++Fe===Fe2++2Ag
C.第④步操作用稀 H2SO4 浸洗的目的是除去 Ag 中未反应的 Fe
D.第⑦步提纯操作为过滤、洗涤、干燥
6.实验室从含 Br-的废液中提取溴单质,下列说法中能达到实验目的的是( )
A.用装置甲氧化废液中的 Br-
B.用装置乙分离 CCl4 层和水层
C.用装置丙分离 CCl4 和液溴
D.用仪器丁长期贮存液溴
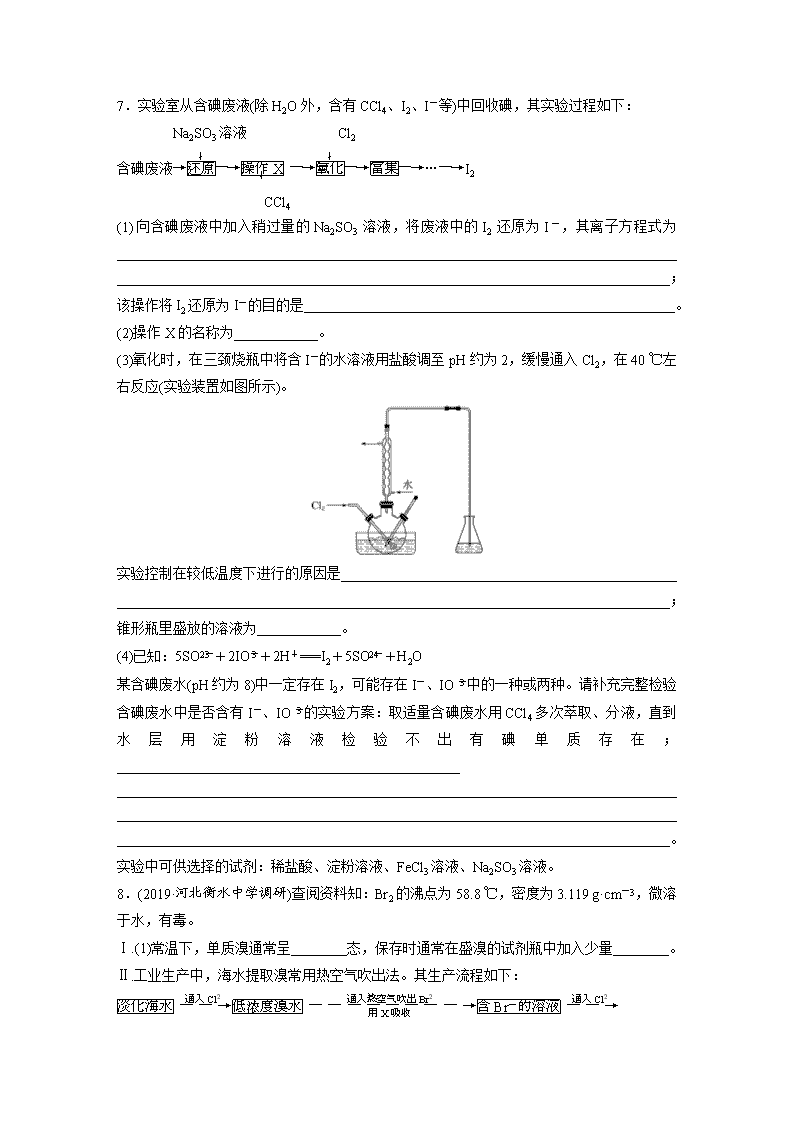
7.实验室从含碘废液(除 H2O 外,含有 CCl4、I2、I-等)中回收碘,其实验过程如下:
Na2SO3 溶液 Cl2
含碘废液→还原
↓
―→操作 X
↓ ―→氧化
↓
―→富集―→…―→I2
CCl4
(1)向含碘废液中加入稍过量的 Na2SO3 溶液,将废液中的 I2 还原为 I-,其离子方程式为
________________________________________________________________________________
_______________________________________________________________________________;
该操作将 I2 还原为 I-的目的是_____________________________________________________。
(2)操作 X 的名称为____________。
(3)氧化时,在三颈烧瓶中将含 I-的水溶液用盐酸调至 pH 约为 2,缓慢通入 Cl2,在 40 ℃左
右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是________________________________________________
_______________________________________________________________________________;
锥形瓶里盛放的溶液为____________。
(4)已知:5SO2-3 +2IO-3 +2H+===I2+5SO2-4 +H2O
某含碘废水(pH 约为 8)中一定存在 I2,可能存在 I-、IO -3 中的一种或两种。请补充完整检验
含碘废水中是否含有 I-、IO -3 的实验方案:取适量含碘废水用 CCl4 多次萃取、分液,直到
水 层 用 淀 粉 溶 液 检 验 不 出 有 碘 单 质 存 在 ;
_________________________________________________
________________________________________________________________________________
________________________________________________________________________________
_______________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3 溶液、Na2SO3 溶液。
8.(2019·河北衡水中学调研)查阅资料知:Br2 的沸点为 58.8 ℃,密度为 3.119 g·cm-3,微溶
于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:
淡化海水 ― ― →通入 Cl2
低浓度溴水 ― ― ― ― ― ― ― ― →通入热空气吹出 Br2
用 X 吸收 含 Br-的溶液 ― ― →通入 Cl2
Br2 的浓溶液―→液溴
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。
实验步骤如下:
①关闭活塞 b、d,打开活塞 a、c,向 A 中缓慢通入 Cl2 至反应结束;
②关闭 a、c,打开 b、d,向 A 中鼓入足量热空气;
③关闭 b,打开 a,再通过 A 向 B 中通入足量的 Cl2;
④将 B 中所得液体进行蒸馏,收集液溴。
(2)当观察到 A 中液面上方出现____________(实验现象)时即可判断步骤①中反应已经结束。
(3)X 试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水
c.氢氧化钠溶液 d.饱和 Na2SO3 溶液
B 中 X 试 剂 发 生 反 应 的 离 子 方 程 式 为
________________________________________________
_______________________________________________________________________________。
(4)蒸馏时应该选择______(填序号),操作中应控制的关键实验条件为____________________。
Ⅲ.该实验小组利用制得的单质溴研究 H2 与 Br2 生成 HBr 的反应,实验装置如下:
(5)E 装置可用来检验反应产物 HBr,则 D 装置的作用是____________________。若要检验 E
中收集的 HBr,图示装置检验 HBr 还不够完善,请结合原有实验装置予以改进:____________。
答案精析
1.B
2.B [向 NaCl 饱和溶液中先通氨气才能吸收更多的 CO2 形成 HCO-3 ,B 项正确;转化关系
中所涉及的物质有单质、混合物,这些都不属于电解质,A 项错误;工业上制备 K 利用的是
平衡移动原理,K 的沸点低于 Na,易形成 K 蒸气而使平衡正向移动,C 项错误;体现的是 Cl2
的氧化性、还原性,D 项错误。]
3.C
4.B [加碘盐中含有 IO-3 ,在酸性条件下可被 I-还原成 I2,KI淀粉试纸会变蓝,A 项正确;
根据途径Ⅰ可知氧化性 Cl 2>I2,根据途径Ⅱ可知氧化性 IO -3 >I2,根据途径Ⅲ可知氧化性
Cl2>IO-3 ,B 项错误;根据图示转化关系可知,其原因可能是 5Cl2+I2+6H2O===2HIO3+10HCl,
C 项正确;根据关系式 2IO-3 ~I2~10e -可知,若生成 1 mol I2,反应中转移的电子数为
10NA,D 项正确。]
5.C [依据流程,向卤水中加入 AgNO3 生成的甲应为 AgI,AgI 和 Fe 反应的离子方程式为
2AgI+Fe===2Ag+Fe2++2I-,在此反应中 AgI 为沉淀,不能拆分,生成的乙应为 FeI2,故
A、B 项错误;第③步反应生成的 Ag 中可能混有未反应的 Fe,加稀 H2SO4 是除去未反应的
Fe,故 C 项正确;从碘水中提取单质 I2 可采取有机溶剂萃取法、升华法提纯,而不能用过滤
法,故 D 项错误。]
6.B [利用 Cl2 氧化废液中的 Br-,应将 Cl2 从长导管通入废液中,A 项错误;Br2 易溶于 CCl4,
利用 CCl4 萃取溶液中的 Br2 后,利用分液漏斗进行分液来分离 CCl4 层和水层,B 项正确;利
用蒸馏法分离 CCl4 和液溴时,温度计的水银球应放在蒸馏烧瓶的支管口处,C 项错误;液溴
具有较强的挥发性和氧化性,易腐蚀橡胶塞,应用带玻璃塞的试剂瓶贮存,D 项错误。]
7.(1)SO2-3 +I2+H2O===2I-+SO2-4 +2H+ 使 CCl4 中的碘进入水层
(2)分液
(3)使氯气在溶液中有较大的溶解度(或防止 I2 升华或防止 I2 进一步被氧化) NaOH 溶液
(4)从水层取少量溶液,加入 1~2 mL 淀粉溶液,加盐酸酸化,滴加 FeCl3 溶液,若溶液变蓝,
说明废水中含有 I-,若溶液不变蓝,说明废水中不含有 I-;另从水层取少量溶液,加入 1~2 mL
淀粉溶液,加盐酸酸化,滴加 Na2SO3 溶液,若溶液变蓝,说明废水中含有 IO-3 ,若溶液不变
蓝,说明废水中不含有 IO-3
8.(1)液 水 (2)黄绿色 (3)d c Br2+SO2-3 +H2O===SO2-4 +2Br-+2H+ (4)①③⑤⑥⑦
控制温度在 59 ℃(或 58.8 ℃)
(5)除去未反应完的溴蒸气 在 D 与 E 之间增加一盛有 CCl4 的洗气装置
解析 (1)Br2 易挥发,密度大于水,微溶于水,所以保存时通常在盛溴的试剂瓶中加入少量
水进行水封。(2)当反应完成时,多余 Cl2 逸出,使 A 液面上方出现黄绿色。(3)Br2 能与 Na2SO3
反应生成 Br-,可以用饱和 Na2SO3 溶液吸收 Br2;溴蒸气、Cl2 均有毒,可以用 NaOH 溶液
吸收。(4)Br2 的沸点为 58.8 ℃,则应控制温度在 59 ℃(或 58.8 ℃)。(5)生成的 HBr 中混有溴
蒸气,由于 Br2 的沸点较低,通过 D 装置可以除去溴化氢中的溴蒸气;由于 D 装置无法完全
除去 HBr 中的 Br2,所以该方案不够完善,应该在 D 和 E 之间增加一盛有 CCl4 的洗气装置,
确保将 HBr 中的 Br2 完全除去。