- 2021-04-13 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学人教版选修3学案:2-1-2 共价键的键参数 等电子原理 Word版含解析
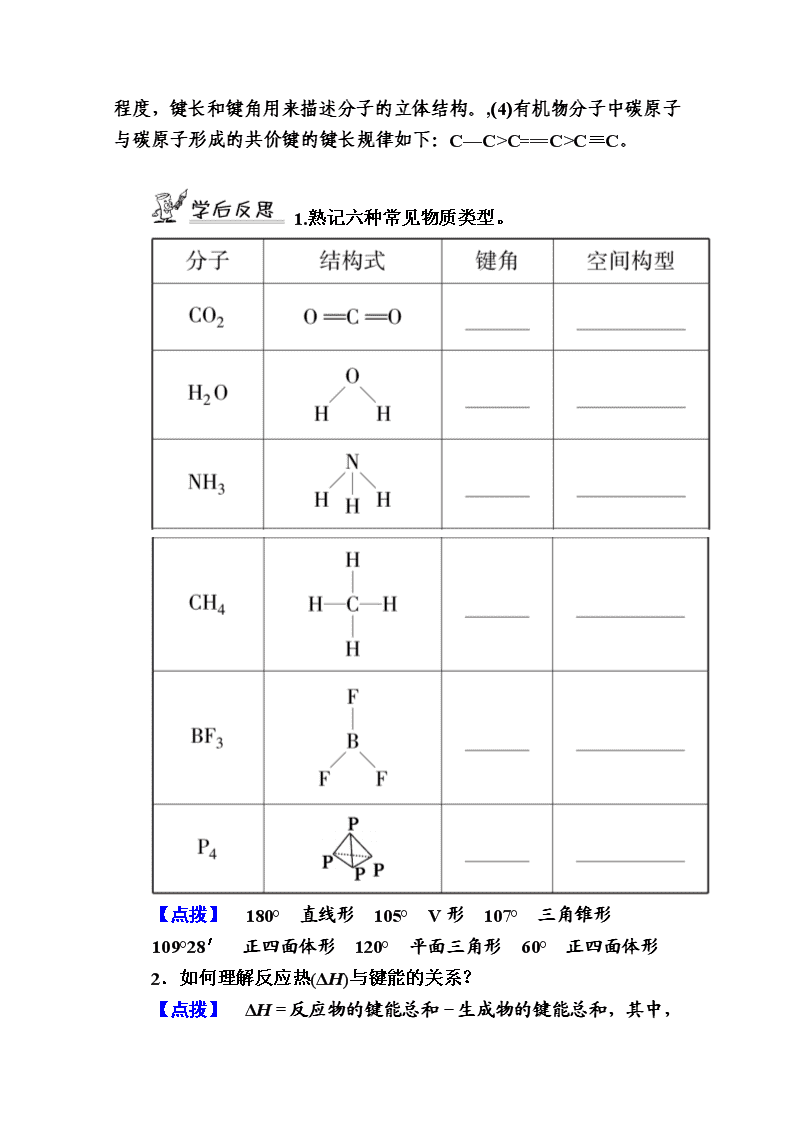
www.ks5u.com 第二课时 共价键的键参数 等电子原理 [学习目标] 1.通过数据认识键能、键长、键角等键参数的概念,树立数据观。 2.能利用键能、键长、键角三个键参数推断某些简单分子的性质。 3.了解等电子原理及其常见应用。 一、键参数 1.键能 (1)概念:键能是气态基态原子形成1 mol化学键释放的最低能 量。键能取正值,单位kJ·mol-1。 (2)意义:键能是衡量共价键稳定性的重要参数。键能越大,形成化学键时放出的能量越多,意味着这个化学键越稳定,越不容易被打断。 2.键长 (1)概念:键长是指形成共价键的两个原子之间的核间距。 (2)意义:键长是衡量共价键稳定性的另一个重要的参数,共价键的键长越短,往往键能越大,表明共价键越稳定。 3.键角 (1)概念:在原子数超过2的分子中,两个共价键之间的夹角称为键角。 (2)常见分子中共价键的键角 CO2分子键角为180°,结构式为O===C===O,H2O分子中H—O—H键角为105°,是一种角(或V)形分子。BF3分子中键角为120°,其为平面正三角形分子。白磷(P4)分子的键角为60°,其为正四面体形分子。 (3)键角是描述分子立体结构的重要参数。多原子分子的键角一定,表明共价键具有方向性。 二、等电子原理 具有相同的原子总数和价电子总数 的分子具有相似的化学键特征,它们的许多性质是相似的。此原理称为等电子原理。满足等电子原理的分子称为等电子体。 知识点一 键参数与分子性质 1.一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。如HF、HCl、HBr、HI中,分子的共用电子对数相同,因F、Cl、Br、I的原子半径依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性HF>HCl>HBr>HI。 2.键长越短,往往键能越大,共价键越稳定。 3.键能与键长是衡量共价键稳定性的参数,键角是描述分子立体结构的参数。一般来说,如果知道分子中的键长和键角,这个分子的空间结构就确定了。如NH3分子的H—N—H键角是107°,N—H键的键长是101×10-12 m,就可以断定NH3分子是三角锥形分子,如上图。 4.F—F键键长短,键能小的解释: F原子的半径很小,因此其键长短,而由于键长短,两F原子形成共价键时,原子核之间的距离很近,排斥力很大,因此键能小,F2的稳定性差,很容易与其他物质反应。 (1)通过键长、键角可以判断分子的立体构型。,(2)键长不等于成键两原子半径的和,而是小于其半径的和。,(3) 键能与键长反映键的强弱程度,键长和键角用来描述分子的立体结构。,(4)有机物分子中碳原子与碳原子形成的共价键的键长规律如下:C—C>C===C>C≡C。 1.熟记六种常见物质类型。 【点拨】 180° 直线形 105° V形 107° 三角锥形 109°28′ 正四面体形 120° 平面三角形 60° 正四面体形 2.如何理解反应热(ΔH)与键能的关系? 【点拨】 ΔH =反应物的键能总和-生成物的键能总和,其中,ΔH<0时,为放热反应;ΔH>0时,为吸热反应。例如,1 mol H2和1 mol Cl2反应生成2 mol HCl的反应热(ΔH)的计算。已知EH—H=436 kJ·mol-1,ECl—Cl=243 kJ·mol-1,EH—Cl=432 kJ·mol-1,则ΔH=EH—H+ECl—Cl-2EH—Cl=436 kJ·mol-1+243 kJ·mol-1-2×432 kJ·mol-1=-185 kJ·mol-1<0,该反应为放热反应。 【例1】 实验测得不同物质中氧—氧之间的键长和键能数据(如下表)。其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。该规律性是( ) A.成键时电子数越多,键能越大 B.键长越长,键能越小 C.成键所用的电子数越少,键能越大 D.成键时电子对越偏移,键能越大 【提示】 首先明确:①键长越长键能越小;②共价键的本质是自旋方向相反的未成对电子形成共用电子对,原子轨道发生重叠。其次注意:利用题中提供的信息,去伪存真找到正确的规律是学习中应着力训练的能力。 【解析】 电子数由多到少的顺序为:O>O>O2>O,键能大小顺序为W>Z>Y>X,A项错误;这些微粒都是O成键,无偏移,D项错误;关于C项,对于这些微粒在成键时所用电子情况,题中无信息,已有的知识中也没有,说明这不是本题考查的知识点。 【答案】 B (多选)关于键长、键能和键角,下列说法中不正确的是( CE ) A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径和成键数目有关 C.键能越大,键长越长,共价化合物越稳定 D.键角的大小与键长、键能的大小无关 E.C===C键的键能等于C—C键键能的2倍 F.因为H—O键的键能小于H—F键的键能,所以O2、F2与H2反应的能力逐渐增强 解析:键角是描述分子立体结构的重要参数,如H2O分子中2个H—O键的键角为105°,故H2O为V形(角形)分子,A正确;键长的大小与成键原子的半径有关,如Cl原子的半径小于I原子的半径,所以Cl—Cl键的键长小于I—I键的键长。此外,键长还和成键数目有关,如乙烯分子中C===C键的键长比乙炔分子中C≡C键的键长要长,B正确;键能越大,键长越短,共价键越强,共价化合物越稳定,C错误;键角的大小取决于成键原子轨道的夹角,与键长、键能无关,D正确;C===C键的键能为615 kJ/mol,C—C键的键能为347.7 kJ/mol,二者并不是2倍的关系,E错误;H—O键的键能为462.8 kJ/mol,H—F键的键能为568 kJ/mol,H—O键的键能小于H—F键的键能,意味着形成这些键时放出的能量依次增大,化学键越来越稳定,因此O2、F2跟H2反应的能力依次增强,F正确。故选CE。 知识点二 等电子原理的应用 1.应用:等电子体的许多性质是相近的,空间构型是相同的。利用等电子体可以: (1)判断一些简单分子或离子的立体构型; (2)利用等电子体在性质上的相似性制造新材料; (3)利用等电子原理针对某物质找等电子体。 2.常见等电子体 (1)等电子体的价电子总数相同,而组成原子的核外电子总数不一定相同,如CO2和CS2。 (2)可将等电子原理扩大到离子,应用更为广泛。 (3)应用等电子原理的前提是原子总数必须相同,其次是价电子总数相同。对主族元素来说,必须是最外层电子数相同而不是总电子数相同,如CO2和CS2是等电子体,而CH4和NH3不是等电子体。 如何判断等电子体? 【点拨】 要互为等电子体,就是要求粒子中原子总数和各原子价电子总数均相等,其解决方法通常为: 1.将粒子中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2与CO、N和CNO-均互为等电子体。 2.将粒子中一个或几个原子换成原子序数增加(或减少)n的元素的带n个单位电荷的阳离子(或阴离子),如N2O和N互为等电子体。 3.同主族元素最外层电子数相等,故可将粒子中原子换成同主族元素原子,如O3和SO2互为等电子体。 【例2】 由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间结构相似的是( ) A.SO2与O3 B.CO2与NO2 C.CS2与NO2 D.PCl3与BF3 【提示】 本题抓住题目中所给的关系“等电子体”信息,原子数相同,价电子总数相同即可顺利求解。 【解析】 由题中信息可知,只要算出分子中各原子最外层电子数之和即可判断。B的最外层电子数为3;C的最外层电子数为4;N、P的最外层电子数为5;O、S的最外层电子数为6。 【答案】 A 等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构、物理性质均相似。 (1)根据以上原理,仅由第二周期元素组成的共价化合物分子中,互为等电子体的是N2和CO;CO2和N2O。 (2)此后,等电子原理又有发展。例如:由短周期元素组成的粒子,只要其原子总数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO互为等电子体的分子有:SO2、O3。 解析:给定分子或离子写等电子体时,应依据原子和价电子数分别相等的原则写出。第二周期元素中,B、C、N、O、F等可形成共价型分子,如N2与CO互为等电子体,在此基础上增加同种元素的原子可得其他的等电子体,如CO2和N2O。 1.N—H键键能的含义是( C ) A.由N和H形成1 mol NH3所放出的能量 B.把1 mol NH3中的共价键全部拆开所吸收的热量 C.拆开约6.02×1023个N—H键所吸收的热量 D.形成1个N—H键所放出的热量 解析:N—H键的键能是指形成1 mol N—H键放出的能量或拆开1 mol N—H键所吸收的能量,不是指形成1个N—H键释放的能量。1 mol NH3中含有3 mol N—H键,拆开1 mol NH3或形成1 mol NH3吸收或放出的能量应是1 mol N—H键键能的3倍。 2.在白磷(P4)分子中,4个P原子分别处在正四面体的四个顶点,结合有关P原子的成键特点,下列有关白磷的说法正确的是( C ) A.白磷分子的键角为109°28′ B.分子中共有4对共用电子对 C.白磷分子的键角为60° D.分子中有6对孤电子对 解析:白磷的空间结构为,键角为60°,分子中共有6对共用电子对,有4对孤电子对。 3.下列说法正确的是( D ) A.键能越大,表示该分子越容易受热分解 B.共价键都具有方向性 C.在分子中,两个成键的原子间的距离叫键长 D.H—Cl的键能为431.8 kJ·mol-1,H—Br的键能为366 kJ·mol-1,说明HCl比HBr分子稳定 解析: 键能越大,分子越稳定,A项错,D项正确。H—H键没有方向性,B项错。形成共价键的两个原子之间的核间距叫做键长,C项错。 4.能够用键能的大小作为主要依据来解释的是( D ) A.常温常压下,氯气呈气态,而溴单质呈液态 B.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸 C.稀有气体一般难以发生化学反应 D.空气中氮气的化学性质比氧气稳定 解析:共价分子构成物质的状态取决于分子间作用力的大小,与分子内共价键的键能无关;物质的挥发性与分子内键能的大小无关;稀有气体是单原子分子,无化学键,难于发生化学反应的原因是它们已形成稳定结构;氮气比氧气稳定是由于N2分子中形成的共价键键能比O2分子中共价键键能大,在化学反应中更难以断裂。 5.下表是一些键能数据/(kJ·mol-1): 由上表中数据能否得出这样的结论: (1)半径越小的原子形成的共价键越牢固(即键能越大)。不能(填“能”或“不能”)。 (2)非金属性越强的原子形成的共价键越牢固。不能(填“能”或“不能”)。 (3)能否从数据中找出一些规律,请写出一条:能,同主族元素与相同原子结合形成共价键时,原子半径越小,共价键越强。 (4)试预测C—Br键的键能范围:218_kJ·mol-1查看更多