- 2021-02-26 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学 第四章 非金属及其化合物 富集在海水中的元素-氯
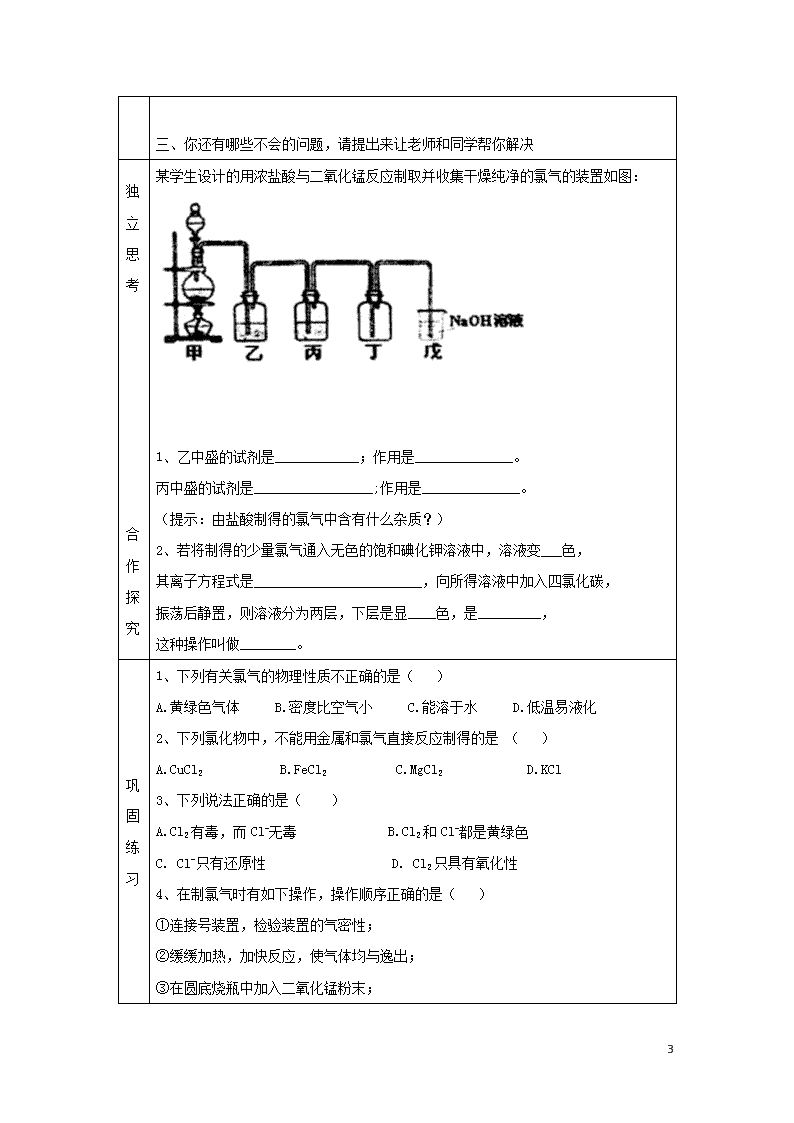
富集在海水中的元素-氯 学习目标 1、记住氯气的物理性质 2、熟练掌握氯气的化学性质(与金属的反应,特别是变价金属的反应特点;与水的反应;与碱的反应) 3、记住氯气的用途以及危害 4、记住漂白液和漂白粉的制取原理和有效成分以及原理 5、记住氯气的实验室制法(会根据反应物的状态分析发生装置,根据气体的性质选择干燥方法,以及尾气处理方法) 重点 氯气的化学性质 难点 燃烧反应的本质 ,氯气与变价金属反应的特点 学法指导 1、根据物质中元素的化合价分析物质的性质(最低价态只具有还原性;最高价态只具有氧化性 ;中间价态既有氧化性又有还原性) 2、气体制备的发生装置是根据反应物的状态和反应条件选择的,气体的除杂和尾气处理方法是根据气体的性质决定的 一、自主学习:(请同学们认真阅读课本82页-84页第二自然段;84页倒数第一自然段-85页学与问结束,你一定能完成下列问题) 一、 氯气 1、氯元素在元素周期表中的位置和结构 (1)原子结构:_______________ (2)存在形式:_________________ 2、氯气的物理性质 状态_____ 易_____颜色______气味______毒性_____密度_____溶解度:________ 3、氯气的化学性质 (1)Cl2与金属的反应(完成方程式) 与Na的反应:____________________________________ 与Fe的反应:_____________________________________ 与Cu的反应:_____________________________________ 5 自学引导︵学生课前必须完成︶ (2)Cl2与非金属的反应 ① Cl2与H2的反应现象: 化学方程式:__________________________________应用:工业制盐酸 ② Cl2还能跟其他一些非金属单质反应,如磷单质;但不能与C、O2直接化合。 2P+3Cl22PCl3(液体) PCl3+Cl2=PCl5(固体) (3) Cl2与水的反应 。 次氯酸分解反应 。 (4)Cl2与碱的反应 ①Cl2与NaOH溶液反应(制___________)反应方程式为________________________。 ②Cl2与Ca(OH)2反应(制____________),将Cl2通入冷的消石灰中,反应方程式为: _____________________________________________________________ (5)Cl2和还原性物质反应 Cl2 + 2FeCl2 = 2 FeCl3 ,Cl2 + 2KI = 2KCl + I2 , Cl2 + Na2SO3 + H2O = Na2SO4 + 2HCl (6)Cl2还能与很多有机物质反应,生成多种含氯化合物.(以后将要学到) 4、Cl2的用途 是化学工业中的重要物质,可作_______剂,制造_______、_______、氯仿等有机溶剂,在有机化工中是合成 等的重要原料。 5、Cl2的危害: __________________________________________________ 6、氯气的实验室制法(阅读教材82页科学史话完成下列内容的填写) 反应原理:MnO2+4HCl(浓)===MnCl2+2H2O+Cl2↑ 二、自主练习:(通过自学,相信自己能解决下列问题) 1、氯气与变价金属(Fe Cu)反应产物中(Fe Cu)化合价的特点,你能得出什么规律? 2、燃烧一定要有O2参加吗?你对燃烧的条件和本质有什么新的认识? 3、漂白粉的漂白原理为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 漂白粉的主要成分为: ,有效成分是: 4、漂白液、漂白粉有何区别?存放漂白粉时应注意哪些问题? 5 三、你还有哪些不会的问题,请提出来让老师和同学帮你解决 独立思考 合作探究 某学生设计的用浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图: 1、乙中盛的试剂是____________;作用是______________。 丙中盛的试剂是_________________;作用是______________。 (提示:由盐酸制得的氯气中含有什么杂质?) 2、若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变___色, 其离子方程式是________________________,向所得溶液中加入四氯化碳, 振荡后静置,则溶液分为两层,下层是显____色,是_________, 这种操作叫做________。 巩固练习 1、下列有关氯气的物理性质不正确的是( ) A.黄绿色气体 B.密度比空气小 C.能溶于水 D.低温易液化 2、下列氯化物中,不能用金属和氯气直接反应制得的是 ( ) A.CuCl2 B.FeCl2 C.MgCl2 D.KCl 3、下列说法正确的是( ) A.Cl2有毒,而Cl-无毒 B.Cl2和Cl-都是黄绿色 C. Cl-只有还原性 D. Cl2只具有氧化性 4、在制氯气时有如下操作,操作顺序正确的是( ) ①连接号装置,检验装置的气密性; ②缓缓加热,加快反应,使气体均与逸出; ③在圆底烧瓶中加入二氧化锰粉末; 5 ④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中; ⑤将多余Cl2用NaOH溶液吸收; ⑥用向上排空气法收集氯气。 A.①②③④⑤ B.③④②①⑥⑤ C.①③④②⑥⑤ D. ①④③②⑥⑤ 学习体会 总结: ① 大多书金属都能在一定条件下与Cl2发生化合生成金属氯化物。 ②干燥的Cl2在常温下不与Fe反应,因此可用钢瓶贮存液氯。 ③ CuCl2溶液在较小浓度时为蓝色,较大浓度时为绿色。 达标测试 1.从1897年英国首次使用氯气对给水管网消毒以来,氯气用于自来水消毒已经经历了100多年的历史。目前,我国大多数城市仍然采用氯气消毒法对自来水进行净化、消毒。氯气之所以长期用于自来水消毒,原因是 A.氯气有毒,可以毒死细菌、病毒 B.氯气具有刺激性气味,可以熏死细菌、病毒 C.氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 D.氯气用于自来水消毒的工艺简单、成熟,易于操作,且成本低 2.制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂之比为 A.1:1 B.1:2 C. 2:1 D. 3:2 3、试预测下列哪些物质不具备漂白性( ) A.Na2O B.Na2O2 C.HClO D.NaClO 4、据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是 。 A.NaOH B.NaCl C. KBr D. Na2CO3 5.下列反应的离子方程式正确的是( ) A.向Ba(OH)2溶液加入等物质的量的硫酸:Ba2++OH-+SO42-+H+= BaSO4↓+H2O B.向Na2CO3溶液中通入过量CO2气体:CO32-+CO2+H2O=2HCO3- C.BaCO3溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ 5 D.将C12通入水中:C12+H2O=Cl-+2H++ClO-(HClO是难电离的弱酸) 5查看更多