- 2021-02-26 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学课时跟踪训练14原子晶体含解析 人教版选修3
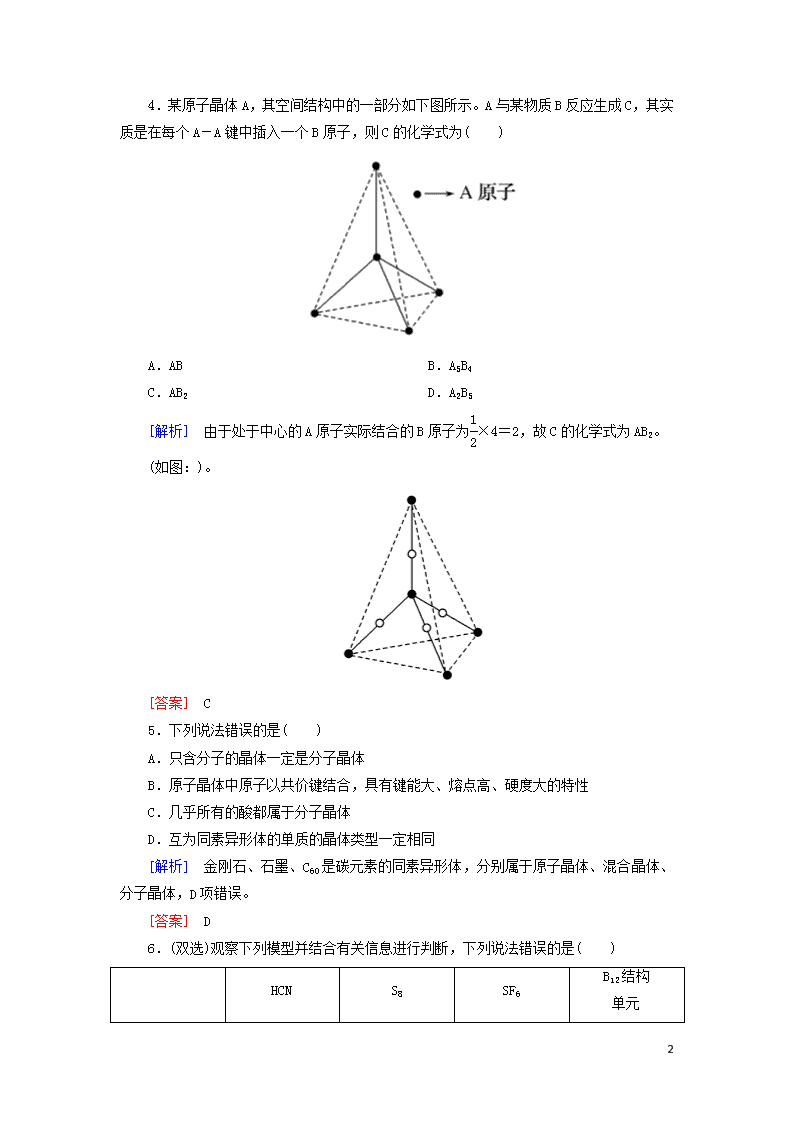
课时跟踪训练(十四) [基础巩固] 1.下列晶体中不属于原子晶体的是( ) A.干冰 B.金刚砂 C.金刚石 D.水晶 [解析] 干冰是固体CO2,属于分子晶体,A正确;金刚砂属于原子晶体,B不符合题意;金刚石属于原子晶体,C不符合题意;水晶属于原子晶体,D不符合题意。 [答案] A 2.根据下表中给出的有关数据,判断下列说法中错误的是( ) AlCl3 SiCl4 晶体硼 金刚石 晶体硅 熔点/℃ 190 -68 2300 >3550 1410 沸点/℃ 178 57 2550 4827 2355 A. SiCl4是分子晶体 B.晶体硼是原子晶体 C.AlCl3是分子晶体,加热能升华 D.金刚石中的C-C键比晶体硅中的Si-Si键弱 [解析] SiCl4、AlCl3的熔沸点低,都是分子晶体,AlCl3的沸点低于其熔点,即在未熔化的温度下它就能汽化,故AlCl3加热能升华,A、C正确;单质硼的熔沸点高,所以晶体硼是原子晶体,B正确;C原子的半径比Si原子的半径小,金刚石中的C-C键键长比晶体硅中的Si-Si键键长短,金刚石中的C-C键比晶体硅中的Si-Si键强,D错误。 [答案] D 3.美国《科学》杂志曾报道:在40 GPa的高压下,用激光加热到1800 K,人们成功制得了原子晶体CO2,下列对该物质的推断一定不正确的是( ) A.该原子晶体中含有极性共价键 B.该原子晶体易汽化,可用作制冷材料 C.该原子晶体有很高的熔、沸点 D.该原子晶体硬度大,可用作耐磨材料 [解析] CO2由固态时形成的分子晶体变为原子晶体,其成键情况也发生了变化,由原来的碳氧双键变为碳氧单键,但化学键依然为极性共价键,故A项正确。由于晶体类型及分子结构发生变化,物质的熔、沸点等性质也发生了变化。CO2原子晶体具有高硬度,高熔、沸点等特点,故C、D项正确,B项错误。 [答案] B 10 4.某原子晶体A,其空间结构中的一部分如下图所示。A与某物质B反应生成C,其实质是在每个A-A键中插入一个B原子,则C的化学式为( ) A.AB B.A5B4 C.AB2 D.A2B5 [解析] 由于处于中心的A原子实际结合的B原子为×4=2,故C的化学式为AB2。 (如图:)。 [答案] C 5.下列说法错误的是( ) A.只含分子的晶体一定是分子晶体 B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 C.几乎所有的酸都属于分子晶体 D.互为同素异形体的单质的晶体类型一定相同 [解析] 金刚石、石墨、C60是碳元素的同素异形体,分别属于原子晶体、混合晶体、分子晶体,D项错误。 [答案] D 6.(双选)观察下列模型并结合有关信息进行判断,下列说法错误的是( ) HCN S8 SF6 B12结构 单元 10 结构模 型示 意图 备注 - 易溶于CS2 - 熔点1873 K A.HCN的结构式为HCN,分子中含有1个σ键和2个π键 B.固态硫S8属于原子晶体 C.SF6是由极性键构成的非极性分子 D.单质硼属原子晶体,结构单元中含有30个B-B键 [解析] “C≡N”键中含有1个σ键和2个π键,A项不正确;S8属于分子晶体,B项错;SF6是正八面体对称结构,是非极性分子,C项正确;硼晶体的结构单元中有12个B原子,每个原子形成5个B-B键,而每个B-B键为2个原子所共有,所以B-B键数为12×5/2=30个,D项正确。 [答案] AB 7.在x mol石英晶体中,含有Si-O键数是( ) A.x mol B.2x mol C.3x mol D.4x mol [解析] 由石英的晶体结构可以看出一个硅原子周围有四个氧原子,即一个硅原子形成4个Si-O键,所以在x mol石英晶体中含有Si-O键数是4x mol。 [答案] D 8.现在已能在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法中正确的是( ) A.CO2的原子晶体中存在范德华力,每1 mol CO2原子晶体中含有2NA个π键 B.在一定条件下,CO2原子晶体转化为CO2分子晶体是物理变化 C.熔点:金刚石>原子晶体CO2 D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合 [解析] 原子晶体中不存在分子间作用力,A不正确;两者的晶体类型不同,CO2原子晶体转化为CO2分子晶体时存在化学键的断裂和生成,属于化学变化,B不正确;由于氧原子的半径小于碳原子的半径,所以熔点应该是原子晶体CO2>金刚石,C不正确;由题意知CO2原子晶体与SiO2结构相似,所以D正确。 [答案] D 9.下列说法正确的是( ) A.金刚石晶体中的最小碳原子环由6个碳原子构成 B.熔点很高的晶体一定属于原子晶体 10 C.1 mol SiO2晶体中含2 mol Si-O键 D.金刚石化学性质稳定,与任何物质都不反应 [解析] 据金刚石结构模型可知,金刚石中的最小碳环为六元环,在高温下可断开C-C键与O2反应,故A项正确,D项错误;钨的熔点很高,但属于金属晶体,B项错误;1 mol SiO2晶体中含4 mol Si-O键,C项错误。 [答案] A 10.(双选)下列关于原子晶体的说法中错误的是( ) A.原子晶体中不存在独立的“分子” B.原子晶体中所有原子之间以共价键结合成空间网状结构 C.金刚石是原子晶体,所以其化学性质稳定,即使在高温下也不与氧气发生反应 D.原子晶体中必须有共价键,可能存在分子间作用力 [解析] 原子晶体中原子之间以共价键结合形成空间网状结构,故原子晶体中不存在单独的“分子”;由原子晶体的定义可知,原子晶体中只有共价键,不存在分子间作用力。碳的化学性质不活泼,但在一定条件下能与O2、CO2等发生反应。故选CD。 [答案] CD 11.下列说法正确的是( ) A.在含4 mol Si-O键的二氧化硅晶体中,氧原子的数目为4NA B.金刚石晶体中,碳原子数与C-C键数之比为1∶2 C.30 g二氧化硅晶体中含有0.5 NA个二氧化硅分子 D.晶体硅、晶体氖均是由相应原子直接构成的原子晶体 [解析] 在二氧化硅晶体中,每个硅原子形成4个Si-O键,故含有4 mol Si-O键的二氧化硅晶体的物质的量为1 mol,即含有2NA个氧原子,A项错误;金刚石中每个碳原子均与另外4个碳原子形成共价键,且每两个碳原子形成一个C-C键,故1 mol 金刚石中共有2 mol C-C键,因此碳原子与C-C键数目之比为1∶2,B项正确;二氧化硅晶体中不存在分子这种微粒,C项错误;氖晶体是由单原子分子靠分子间作用力结合在一起形成的,属于分子晶体,D项错误。 [答案] B 12.二氧化硅晶体是立体的网状结构,其晶体结构模型如图所示,请认真观察该模型后回答下列问题: 10 (1)二氧化硅晶体中最小环上有________个原子,晶体结构中存在以________原子为中心、________原子为顶点的正四面体结构。 (2)晶体中每个最小环上有________个硅原子,________个氧原子。 (3)晶体中存在的作用力有________。 A.共价键 B.离子键 C.配位键 D.范德华力 E.氢键 [解析] 二氧化硅晶体中,最小环上有6个硅原子和6个氧原子,并形成以硅原子为中心、氧原子(或硅原子)为顶点的正四面体结构。原子晶体中只存在共价键,且Si-O键为极性键,不是配位键。 [答案] (1)12 Si O(或Si) (2)6 6 (3)A 13.有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)查看更多