- 2024-05-03 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年宁夏银川一中高二上学期期末考试化学试题(Word版)
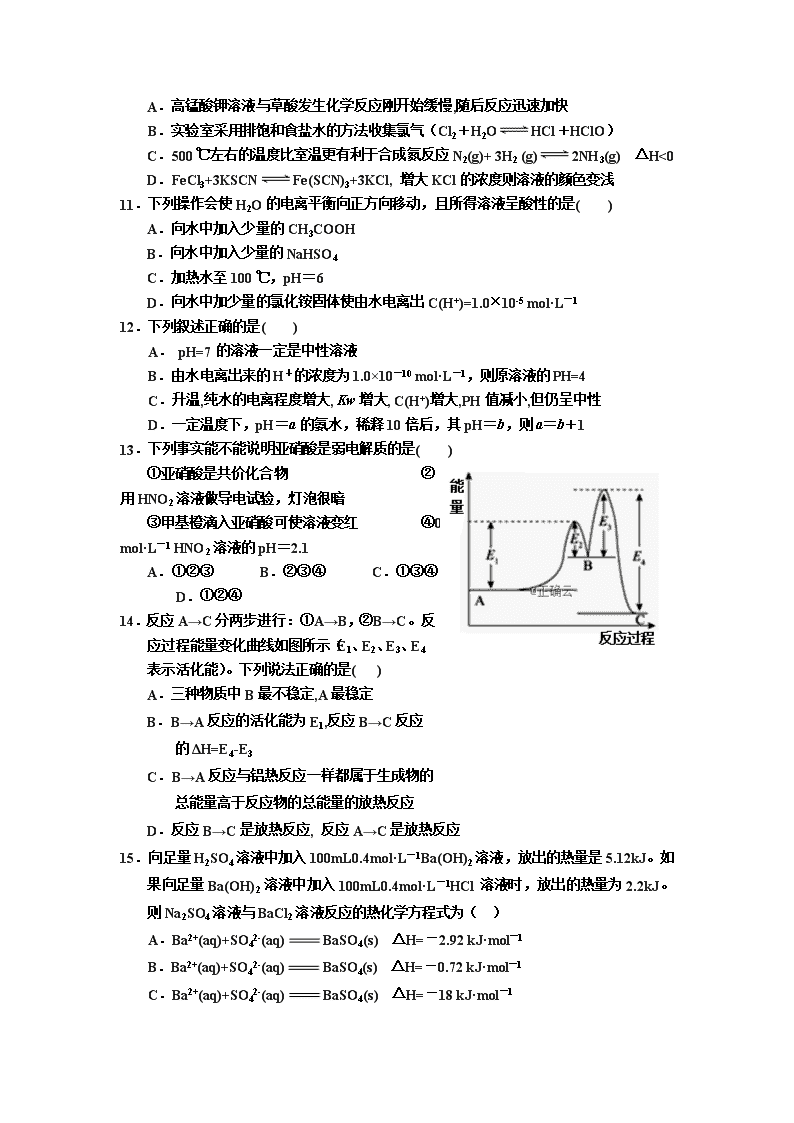
银川一中2018/2019学年度(上)高二期末考试 化 学 试 卷 命题人:许凌云 可能用的原子量:Ca-40 H-1 O-16 C-12 一、选择题(只有一个正确答案,每题2分,共50分) 1.下列说法中正确的是( ) A.放热反应一定不用加热,吸热反应一定需加热 B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应且ΔH>0 C.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小且可以再生,所以风能、氢能、太阳能和生物质能都属于未来新能源 D. 升高温度或加入催化剂,都可以改变化学反应的反应热 2.下表中物质的分类组合完全正确的是( ) 选项 A B C D 强电解质 KNO3 胆矾 BaSO4 HClO4 弱电解质 HF CaCO3 HClO NH3 非电解质 SO2 金属Al H2O C2H5OH 3.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小顺序排列正确的是( ) 甲.在500 ℃时,10 mol SO2和10 mol O2 乙.在500 ℃时,用V2O5作催化剂,10 mol SO2和10 mol O2 丙.在450 ℃时,8 mol SO2和5 mol O2 丁.在500 ℃时,8 mol SO2和5 mol O2 A. 乙、甲、丁、丙 B.乙、甲、丙、丁 C. 甲、乙、丙、丁 D.丁、丙、乙、甲 4.在一定温度的恒容的密闭容器中,下列叙述不是可逆反应2C(g) A(g)+3B(g)达到平衡状态标志的是( ) ①C生成的速率与C分解的速率相等 ②单位时间内生成a mol A,同时消耗3a mol B ③A、B、C的浓度不再变化 ④混合气体的密度 ⑤混合气体的总压强不再变化 ⑥若C为固体,A的体积分数不再变化 A.①② B.④⑥ C.④⑤ D.①③ 5.下列化学用语书写正确的是( ) A.铁粉投入到NaHSO4溶液中的离子方程式:Fe+2HSO4—=Fe2++H2Ó+ 2SO42— B.HS-的电离方程式: HS-+H2O=== H3O++S2- C.液氨也可像水一样发生自偶电离:2NH3 NH4++NH2— D.双氧水具有弱酸性,其电离方程式: H2O2 2H++O22- 6.下列关于热化学反应的描述中正确的是( ) A.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含74.0 g Ca(OH)2的稀溶液与稀硫酸完全中和,放出57.3 kJ的热量 B.已知N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1,将足量的N2(g)和H2(g)置于密闭的容器中充分反应生成1mol NH3(g),放出46.2kJ的热量 C.2gH2完全燃烧生成液态水放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为: 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ D.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 7.下列各组热化学方程式中,△H1>△H2的是( ) ①H2(g)+Cl2(g)=2HCl(g) △H1 H2(g)+I2(g)=2HI(g) △H2 ②C2H4O2(g)+2O2(g)=2CO2(g)+2H2O(g) △H1 C2H4O2(1)+2O2(g)=2CO2(g)+2H2O(1) △H2 ③CaCO3(s)=CaO(s)+CO2(g) △H1 Na2O(s)+H2O(l)=2NaOH(aq) △H2 ④2H2S (g) +3O2 (g) =2SO2 (g) +2H2O(g) △H1 2H2S (g) +O2 (g) =2S (S) +2H2O(g) △H2 A.②③ B.①④ C.①② D.③④ 8.下列关于可逆反应:A(g)+3B(g) 2C(g) △H <0,下列叙述正确的( ) A.增大反应物的浓度,可以提高活化分子百分数,所以 v(正)会先增大后减小 B.升高温度可以提高活化分子的能量所以v(正)、v(逆)都增大,但v(正)增的更大 C.采用催化剂,可以提高活化分子百分数,所以会引起v(正)、v(逆)同时增大且增大的倍数相同 D.减小压强可以降低单位体积内活化分子的数目,所以v(正)减小、v(逆)增大 9.已知298K下反应2Al2O3(s)+3C(s)= 4Al(s)+3CO2(g)△H=+2171.0kJ/mol, △S=+635.5J/(mol•K),则下列说法正确的是( ) A.由题给△H值可知,该反应是一个放热反应 B.△S>0表明该反应是一个熵减少的反应 C.该反应在室温下可能自发进行 D.若温度可以决定反应的方向,则该反应可以自发进行的最低温度为3416.2 K 10.下列事实可以用勒夏特列原理解释的是( ) A.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快 B.实验室采用排饱和食盐水的方法收集氯气(Cl2+H2OHCl+HClO) C.500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)2NH3(g) △H<0 D.FeCl3+3KSCNFe(SCN)3+3KCl, 增大KCl的浓度则溶液的颜色变浅 11.下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( ) A.向水中加入少量的CH3COOH B.向水中加入少量的NaHSO4 C.加热水至100 ℃,pH=6 D.向水中加少量的氯化铵固体使由水电离出C(H+)=1.0Ï10-5 mol·L-1 12.下列叙述正确的是( ) A. pH=7的溶液一定是中性溶液 B.由水电离出来的H+的浓度为1.0×10-10 mol·L-1,则原溶液的PH=4 C.升温,纯水的电离程度增大, Kw增大, C(H+)增大,PH值减小,但仍呈中性 D.一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1 13.下列事实能不能说明亚硝酸是弱电解质的是( ) ①亚硝酸是共价化合物 ②用HNO2溶液做导电试验,灯泡很暗 ③甲基橙滴入亚硝酸可使溶液变红 ④0.1 mol·L-1 HNO2溶液的pH=2.1 A.①②③ B.②③④ C.①③④ D.①②④ 14.反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是( ) A.三种物质中B最不稳定,A最稳定 B.B→A反应的活化能为E1,反应B→C反应 的ΔH=E4-E3 C.B→A反应与铝热反应一样都属于生成物的 总能量高于反应物的总能量的放热反应 D.反应B→C是放热反应, 反应A→C是放热反应 15.向足量H2SO4溶液中加入100mL0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL0.4mol·L-1HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( ) A.Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-2.92 kJ·mol-1 B.Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-0.72 kJ·mol-1 C.Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-18 kJ·mol-1 D.Ba2+(aq)+SO42-(aq)BaSO4(s) △H=-73 kJ·mol-1 16.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是( ) A.反应开始到10s,用Z表示的反应速率 为0.158mol/(L·s) B.平衡时的压强是起始压强的1.2倍 C.反应开始到10s时,Y的转化率为79.0% D.反应的化学方程式为:X(g)+ Y(g)Z(g) 17.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是( ) A.其他条件不变,使用高效催化剂,会缩短反应时间且废气中氮氧化物的转化率增大 B.其他条件不变,加入足量的NH3,再次平衡后氮氧化物的转化率增大,氮气的体积分数减小 C.其他条件不变,升高温度会提高反应物的转化率且使该反应的平衡常数增大 D.其他条件不变,缩小容器的体积会使平衡正向移动,再次平衡后氨气的浓度变小 18.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是( ) A.①压强对反应的影响(p2>p1) B.②温度对反应的影响 C.③平衡体系增加N2对反应的影响 D.④催化剂对反应的影响 温度/℃ 25 80 230 平衡常数 5×104 2 1.9×10-5 19.300 mL恒容密闭容器中,放入镍粉并 充入一定量的CO气体,一定条件下发 生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:下列说法不正确的是( ) A.上述反应为放热反应 B.在25 ℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正查看更多