- 2024-02-27 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省牡丹江市第一高级中学2018-2019学年高二寒假开学检测化学试题
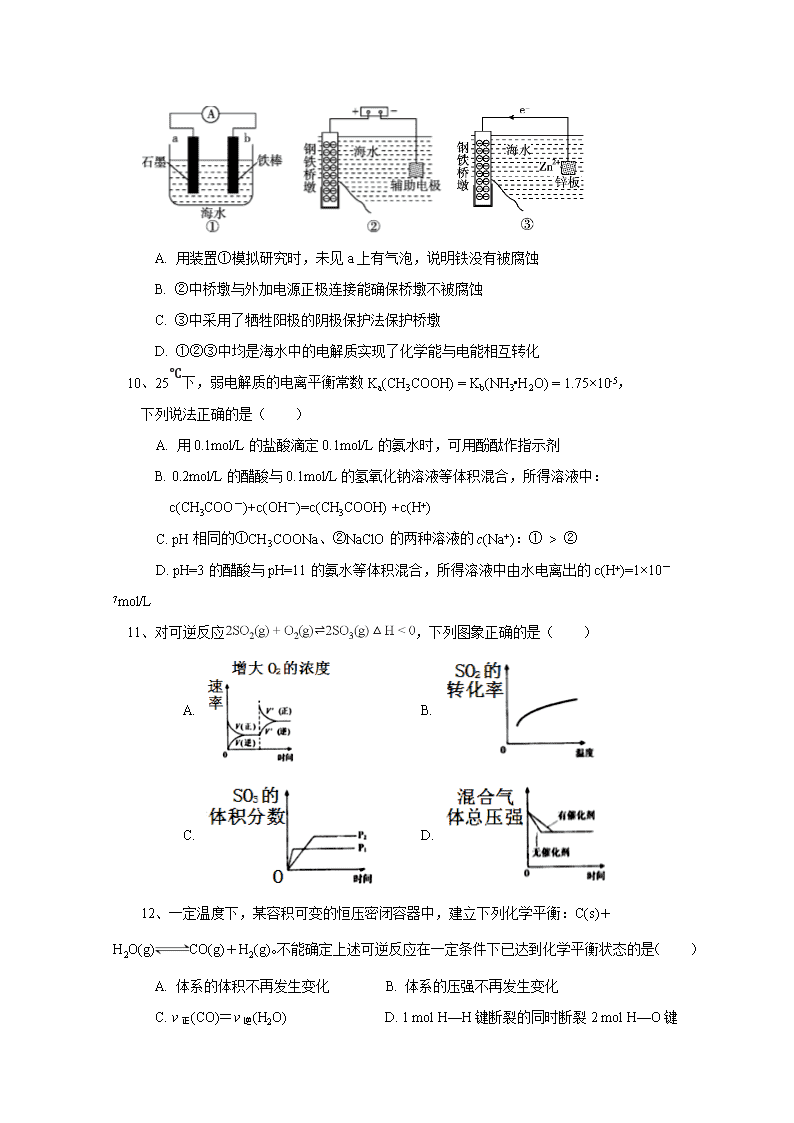
牡一中2017级高二学年假期检测 化 学 试 题 相对原子质量:H1 C12 N14 O 16 Cl 35.5 Na23 Al 27 Fe56 Cu64 Ag108 第I卷(选择题,共60分) 一、(每小题只有一个选项符合题意,每题4分,共15小题,计60分) 1、在一定条件下的溶液中,反应FeCl3+3KSCN Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡逆向移动的是( ) A. 加水稀释 B. 加入少量FeCl3固体 C. 加入少量KCl固体 D. 加入少量KSCN固体 2、用已知浓度的盐酸滴定未知浓度的NaOH溶液,使测得的NaOH溶液浓度偏高的是( ) A.滴定前滴定管中有气泡,滴定后消失 B.碱式滴定管量取NaOH溶液时,未进行润洗操作 C.滴定时达到滴定终点时俯视读数 D.锥形瓶取用NaOH待测液前加少量蒸馏水洗涤 3、下列解释事实的方程式不正确的是( ) A. 电化学镀银的阳极反应式: Ag+ + e-= Ag B. 测0.1 mol/L氨水的pH为11:NH3·H2ONH4++OH− C. pH=5的硫酸稀释1000倍,pH约等于7:H2OH++OH− D. 泡沫灭火器的反应原理:Al3++3HCO3- = Al(OH)3↓+3CO2↑ 4、同体积的1mol/L的HCl、H2SO4、CH3COOH、HNO3分别加入过量的Mg。下列叙述正确的是( )A. HNO3、HCl、H2SO4中放出H2的速率相同 B. HCl、HNO3中放出H2的量相等 C. HCl、CH3COOH中放出H2的量相等 D. H2SO4中放出H2的量最多,其余的相等 5、电化学气敏传感器可用于监测环境中的含量,其工作原理如图所示,被氧气氧化为,下列说法错误的是( ) A. 溶液中向电极b移动 B. 氨气在电极a上发生氧化反应 C. 反应消耗的与的物质的量之比为4:5 D. 正极的电极反应式为: 6、关于化学反应进行的方向叙述不正确的是( ) A. △H<0,△S>0时,反应自发进行,如金属钠和水的反应 B. 过程的自发性能判断过程的方向,还能确定过程是否一定会发生 C. △H>0,△S<0时,反应不自发进行,如2CO(g)=2C(s)+O2(g) D. 等量的同一种物质,气态时的熵值最大、液态时次之、固态时最小 7、对达到化学平衡的反应:,增大压强,下列叙述中正确的是( )A. 增大压强,活化分子的百分数增大,反应速率增大 B. 增大压强,单位体积内活化分子数增多,反应速率增大 C. 增大压强,正反应速率增大逆反应速率减小,平衡正向移动 D. 增大压强,逆反应速率增大正反应速率减小,平衡逆向移动 8、25℃时,下列各组离子在指定溶液中一定能大量共存的是( ) A. 水电离的c(H+)=10-13 mol/L 的溶液中:Na+、NH4+、CH3COO-、HCO3- B. c(H+)=10-12 mol/L的溶液中:K+、AlO2-、NO3-、SO42- C.能使甲基橙变红色的溶液中:Na+、NO3-、Cl-、Fe2+ D. 含有溶质为NaHCO3的溶液: Cl-、Al3+、Na+、AlO2- 9、研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是( ) A. 用装置①模拟研究时,未见a上有气泡,说明铁没有被腐蚀 B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 C. ③中采用了牺牲阳极的阴极保护法保护桥墩 D. ①②③中均是海水中的电解质实现了化学能与电能相互转化 10、25℃下,弱电解质的电离平衡常数Ka(CH3COOH) = Kb(NH3•H2O) = 1.75×10-5, 下列说法正确的是( ) A. 用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂 B. 0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,所得溶液中: c(CH3COO-)+c(OH-)=c(CH3COOH) +c(H+) C. pH相同的①CH3COONa、②NaClO的两种溶液的c(Na+):① > ② D. pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中由水电离出的c(H+)=1×10-7mol/L 11、对可逆反应,下列图象正确的是( ) A. B. C. D. 12、一定温度下,某容积可变的恒压密闭容器中,建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( ) A. 体系的体积不再发生变化 B. 体系的压强不再发生变化 C. v正(CO)=v逆(H2O) D. 1 mol H—H键断裂的同时断裂2 mol H—O键 13、一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g)达到平衡,下列说法正确的是( ) 容器 温度/K 物质的起始浓度/mol•L−1 物质的平衡浓度/mol•L−1 c(H2) c(CO) c(CH3OH) c(CH3OH) Ⅰ 400 0.20 0.10 0 0.080 Ⅱ 400 0.40 0.20 0 Ⅲ 500 0 0 0.10 0.025 A. 该反应的正反应吸热 B. 达到平衡时,容器I中反应物转化率比容器Ⅱ中的大 C. 达到平衡时,容器Ⅱ中c(H2)小于容器Ⅲ中的两倍 D. 达到平衡时,容器Ⅲ中的正反应速率比容器I中的小 14、下列说法正确的是( ) A. 0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)+c(H2CO3)+2c(CO32-) = c(Na+) B. 物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2[c(SO32—) + c(HSO3-)+ c(H2SO3) ] C. 同浓度的下列溶液中,① NH4HSO4 ② NH4Cl ③ NH3·H2O,c(NH4+)由大到小的顺序是:②>①>③ D. 常温下,浓度均为0.1mol/L NaCN和HCN溶液中pH=9, 则c(HCN)>c(Na+)> c(CN-)> c(OH-)> c(H+) 15、已知pAg+=−lgc(Ag+),pX−=−lgc(X−)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( ) A. Ksp(AgBr)=1.0×10-14 mol2·L-2 B. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点 C. 一定温度下,AgCl固体分别在下列溶液①10mL0.01mol·L-1KCl溶液 ②10mL蒸馏水③40mL0.03mol·L-1HCl溶液中的溶解度由大到小的排列顺序是②>①>③ D. 常温下,AgCl在纯水中的Ksp比在AgNO3溶液中的Ksp大 第II卷(非选择题,共40分) 16. (20分)金属单质及其化合物在生活、生产中有广泛应用,回答下列问题: (1)火法炼锌,是在鼓风炉中加热到1 100 ~ 1 300 ℃,发生反应Ⅰ: ZnO(s)+CO(g)Zn(g)+CO2(g) ΔH=+198 mol•L-1。 ①该反应的平衡常数表达式K=_________________。 ②温度为T1时,反应Ⅰ的平衡常数为K1,则同温下反应Ⅱ: ZnO(s)+CO(g) Zn(g)+CO2(g)的平衡常数K2=____________(用K1表示)。 ③某温度时反应Ⅰ的平衡常数K=1.0 mol•L-1,起始时在容积固定的密闭鼓风炉中通入0.11 mol•L-1 CO(ZnO足量),达平衡时,CO的浓度为_____________mol•L-1 。 (2) 由CuCl2溶液制备无水CuCl2 ,请回答相关问题: ①CuCl2水溶液呈 性 ,原因是(用离子方程式表示):______ ___ 把CuCl2溶液蒸干,灼烧,最后得到的主要固体产物是 。 ②某酸性CuCl2溶液中含有少量的FeCl3,为了除掉FeCl3杂质,需要加入____________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________ mol•L-1。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38) (3)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN),发生反应 Al2O3(s)+3C(s)+N2(g)= 2AlN(s)+3CO(g) ΔH=+1 026 kJ·mol-1 一定温度下,在压强为p的反应体系中,平衡时CO的物质的量浓度为c;若温度不变,反应体系的压强减小为0. 5p,则平衡时CO的物质的量浓度__________。 A.小于0.5c B.大于0.5c,小于c C.等于c D.大于c 17.(20分)某甲烷燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少。请回答下列问题: (1)铁电极为乙池中_____电极(填“M”或“N”);其对应的电极反应式为______________;通入甲烷的铂电极的电极反应式为___________________________________________。 (2)在此过程中,乙池中某一电极析出金属银4.32g时,乙池中总反应(离子方程式):______ _ _____。甲池中理论上消耗氧气_______L(标准状况下); (3)若用乙池进行粗铜精炼,①粗铜为乙池中_____电极(填“M”或“N”) ②有关粗铜精炼的描述,正确的是___________ A. 精炼过程中,硫酸铜的浓度不变 B. 杂质都将以单质形式沉积到池底 C. 纯铜增重2.56 g,电路中通过电子为0.08 mol ③粗铜精炼结束后的废电解液中常含有Zn2+、Pb2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,=________________(已知:Ksp(PbS)=3.4×,Ksp(ZnS)=1.6×) 。 牡一中2017级高二学年假期检测 答案 化 学 试 题 第I卷(选择题,共60分) 一、(每小题只有一个选项符合题意,每题4分,共15小题,计60分) 1 2 3 4 5 6 7 8 9 10 A A A C C B B B C C 11 12 13 14 15 A B C D D 二、非选择题(40分) 16.(20分) (1)①c(Zn)·c(CO2)/c(CO)。(2分) ②(2分) ③0.01 (3分) (2)①酸(2分)Cu2++2H2OCu (OH)2+2H+ (2分) CuO (2分) ② CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 (2分) 4.0×10-8 (3分) (3) B(2分) 17.(20分) (1) M (2分) Ag+ + e-= Ag (2分) CH4-8e-+10OH-=CO32—+7H2O (3分) (2)4Ag++2H2O ==电解 == 4Ag+O2↑+4H+ (3分),0.224 (3分) (3)N (2分) C (2分) 4.7×10-3(3分)查看更多