- 2023-11-17 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江西省玉山县一中高二上学期期中考试化学(20-31班)试题(Word版)
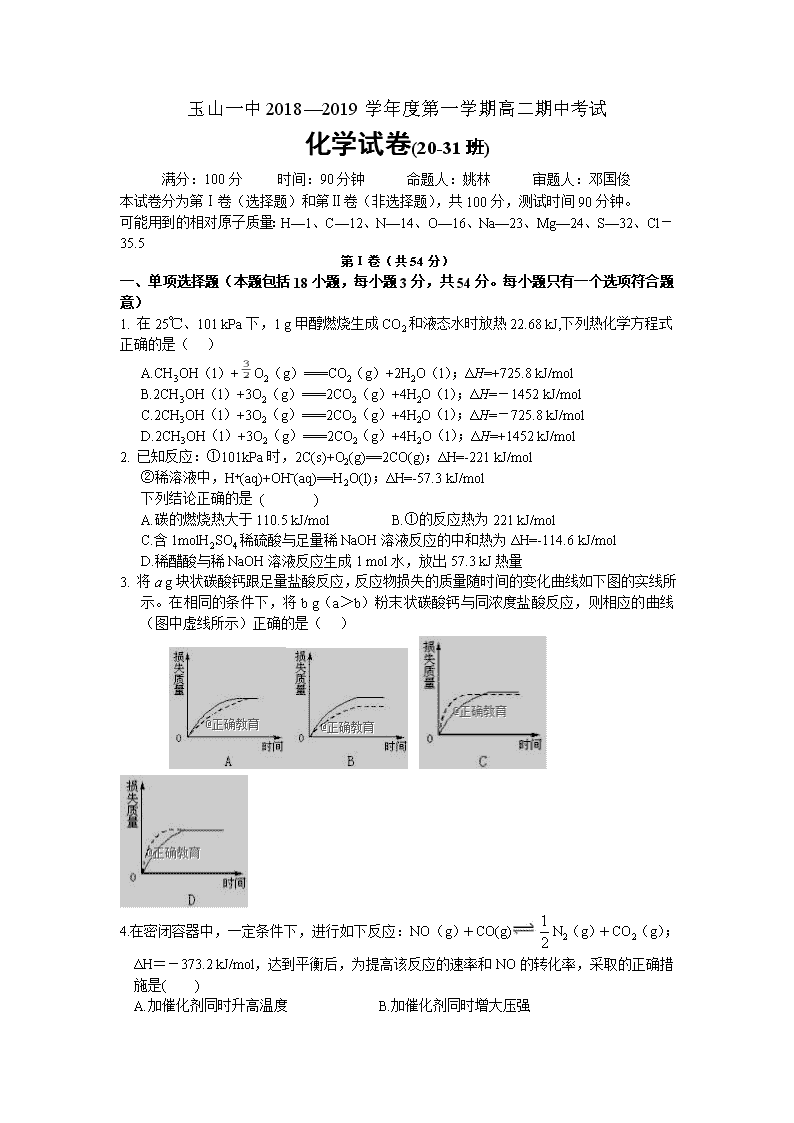
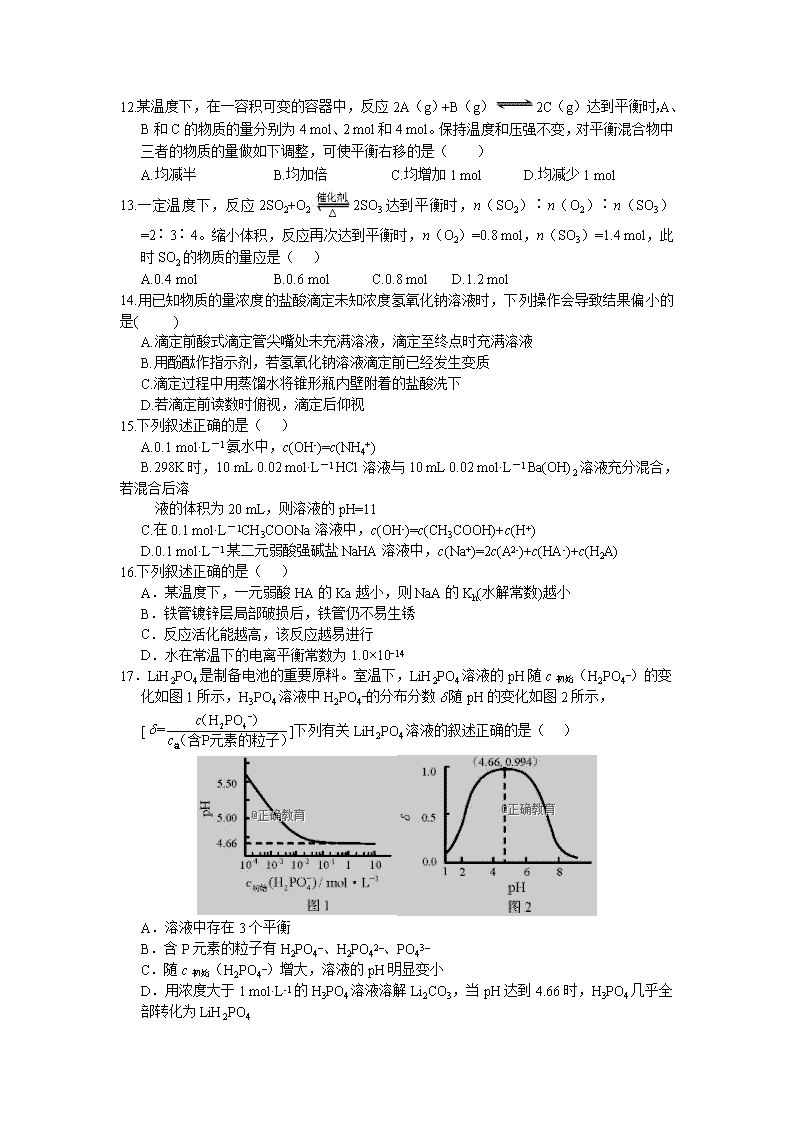
玉山一中2018—2019学年度第一学期高二期中考试 化学试卷(20-31班) 满分:100分 时间:90分钟 命题人:姚林 审题人:邓国俊 本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),共100分,测试时间90分钟。 可能用到的相对原子质量:H—1、C—12、N—14、O—16、Na—23、Mg—24、S—32、Cl-35.5 第Ⅰ卷(共54分) 一、单项选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意) 1. 在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( ) A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l);ΔH=+725.8 kJ/mol B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=+1452 kJ/mol 2. 已知反应:①101kPa时,2C(s)+O2(g)==2CO(g);ΔH=-221 kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol 下列结论正确的是 ( ) A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol C.含1molH2SO4稀硫酸与足量稀NaOH溶液反应的中和热为ΔH=-114.6 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 3. 将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示。在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( ) 4.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( ) A.加催化剂同时升高温度 B.加催化剂同时增大压强 C .升高温度同时充入N2 D.降低温度同时增大压强 5.常温下,若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应 为( ) A.10∶1 B.5∶1 C.1∶1 D.1∶10 6.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和, 用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( ) A. V3>V2>V1 B. V3=V2=V1 C. V3>V2=V1 D. V1=V2>V3 7. 室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBrC2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是 A.加入NaOH,可增大乙醇的物质的量 B.增大HBr浓度,有利于生成C2H5Br C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变 D.若起始温度提高至60℃,可缩短反应达到平衡的时间 8.在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+ 对于该平衡,下列叙述正确的是 A.加入水时,平衡逆向移动 B.加入少量NaOH固体,平衡正向移动 C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 D.加入少量CH3COONa固体,平衡正向移动 9.相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是 A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气 C.两者产生等量的氢气 D.无法比较两者产生氢气的量 10.在10 mL 0.1 mol·L-1 NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是( ) A. c(Na+)>c(Ac-)>c(H+)>c(OH-) B. c(Na+)>c(Ac-)>c(OH-)>c(H+) C. c(Na+)=c(Ac-)+c(HAc) D. c(Na+)+c(H+)=c(Ac-)+c(OH-) 11.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应: 2A(气)+B(气)2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种 说法: ①用物质A表示的反应平均速率为0.3 mol·L-1·s-1 ②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 ③2 s时物质A的转化率为70% ④2 s时物质B的浓度为0.7 mol·L-1 其中正确的是( ) A.①③ B.①④ C.②③ D.③④ 12.某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( ) A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol 13.一定温度下,反应2SO2+O22SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( ) A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol 14.用已知物质的量浓度的盐酸滴定未知浓度氢氧化钠溶液时,下列操作会导致结果偏小的是( ) A.滴定前酸式滴定管尖嘴处未充满溶液,滴定至终点时充满溶液 B.用酚酞作指示剂,若氢氧化钠溶液滴定前已经发生变质 C.滴定过程中用蒸馏水将锥形瓶内壁附着的盐酸洗下 D.若滴定前读数时俯视,滴定后仰视 15.下列叙述正确的是( ) A.0.1 mol·L-1氨水中,c(OH-)=c(NH4+) B.298K时,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶 液的体积为20 mL,则溶液的pH=11 C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) 16.下列叙述正确的是( ) A.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解常数)越小 B.铁管镀锌层局部破损后,铁管仍不易生锈 C.反应活化能越高,该反应越易进行 D.水在常温下的电离平衡常数为1.0×10−14 17.LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数随pH的变化如图2所示,[]下列有关LiH2PO4溶液的叙述正确的是( ) A.溶液中存在3个平衡 B.含P元素的粒子有H2PO4–、H2PO42–、PO43– C.随c初始(H2PO4–)增大,溶液的pH明显变小 D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4 18.H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2,Ka2 (H2C2O4 ) =5.4×10−5,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( ) A.0.1000 mol·L−1 H2C2O4溶液:c(H+ ) + 0.1000 mol·L−1=c(C2O42− )+c(OH−)−c(H2C2O4 ) B.c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ ) C.pH = 7的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4) D.c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4−) 第Ⅱ卷 非选择题 ( 本大题共4 题, 共计46分) 19.用实验确定某酸HA是弱电解质。两同学的方案是: 甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL; ②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。 乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL; ②分别取这两种溶液各10 mL,加水稀释为100 mL; ③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明 HA是弱电解质。 (1)在两个方案的第①步中,都要用到的定量仪器是_____________。 (2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH______1(选填>、<、=) 乙方案中,说明HA是弱电解质的现象是______。 a.装HCl溶液的试管中放出H2的速率快; b.装HA溶液的试管中放出H2的速率快; c.两个试管中产生气体速率一样快。 (3)请你评价:乙方案中难以实现之处是是配制PH=1的HA溶液,不妥之处_______________. (4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。 20.(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。 ①在晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的 化学方程式为:2K3[Fe(C2O4)3]2FeC2O4 +3K2C2O4 +2CO2↑;光解后产物与显示剂发生显 色反应,显色反应的化学方程式为______________。 ②测定三草酸合铁酸钾中铁的含量。称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用 盛 放c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。 向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。 加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V ml。该晶体中铁的 质量分数的表达式为(不必化简)________________________________。 (2)CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2 可以被NaOH溶液捕获。若所得溶 液pH=13,CO2主要转化为___(写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液 pH=___________。(室温下,H2CO3的K1=4×10−7;K2=5×10−11) 21.CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。 回答下列问题: (1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)2CO(g)+2H2(g)。 已知:C(s)+2H2(g)=C(g) ΔH=-75 kJ·mol−1 C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1 C(s)+(g)=CO(g) ΔH=-111 kJ·mol−1 该催化重整反应的ΔH=______ kJ·mol−1,有利于提高CH4平衡转化率的条件是____(填标号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平 衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。 (2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表: 积碳反应 CH4(g)= C(s)+2H2(g) 消碳反应 CO2(g)+ C(s)= 2CO(g) ΔH/(kJ·mol−1) 75 172 活化能/ (kJ·mol−1) 催化剂X 33 91 催化剂Y 43 72 ①由上表判断,应选择催化剂____(填“X”或“Y”)。在反应进料气组成、压强及反应时间相同的 情况下,某催化剂表面的积碳量随温度的变化关系如下左图所示。升高温度时,下列关于积碳 反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是_____ 填标号)。 A.K积、K消均增加 B.v积减小,v消增加 C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大 ②在一定温度下,测得某催化剂上沉积碳的生成速率为v=k·p(CH4)· (k 为速率常数)。 在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如上右图所示,则pa(CO2)、pb(CO2)、 pc(CO2)从大到小的顺序为________________。(用“>”连接) 22.作为新型的绿色硝化剂N2O5,在含能材料、医药等工业中得到广泛应用。 (1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应: 其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞ 时,N2O5(g)完全分解): t/min 0 40 80 160 260 1300 1700 ∞ p/kPa 35.8 40.3 42.5. 45.9 49.2 61.2 62.3 63.1 ①已知:2N2O5(g)2N2O4(g)+O2(g) ΔH1=−4.4 kJ·mol−1 2NO2(g) N2O4(g) ΔH 2=−55.3 kJ·mol−1 则反应N2O5(g)=2NO2(g)+O2(g)的ΔH =_______ kJ·mol−1。 ②研究表明,N2O5(g)分解的反应速率v=2×10−3×(kPa·min−1),t=62 min时,测得体系中 =2.9 kPa,则此时的=________ kPa,v=_______ kPa·min−1。 ③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于” 或“小于”)。 ④25℃时N2O4(g)2NO2(g)反应的平衡常数表达式Kp=______(用压强符号表示,Kp为以分压 表示的平衡常数,不用计算)。 (2)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程: 第一步 N2O5NO3+NO2 快速平衡 第二步 NO2+NO3→NO+NO2+O2 慢反应 第三步 NO+NO3→2NO2 快反应 其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是__________(填标号)。 A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3 C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高 高二化学(20-31班)参考答案 一、单选(18×3=54) 题号 1 2 3 4 5 6 7 8 9 10 答案 B A C B B C D B A A 题号 11 12 13 14 15 16 17 18 答案 B C A B C B D D 19.(10分) (1)100mL容量瓶(2)> b (3)在于加入的锌粒难以做到表面积相同 (4)配制NaA溶液,测其pH值>7即证明HA是弱电解质 20.(12分) (1)①3FeC2O4+2K3[Fe(CN)6]Fe3[Fe(CN)6]2+3K2C2O4 ②酸式滴定管 当滴入最后一滴KMnO4溶液,锥形瓶内溶液恰好出现粉红色,且半分钟内不复原; (2)CO32- 10 21.(12分) (1)247 A (2)①Y AD ②pc(CO2) >pb(CO2) >pa(CO2) 22.(12分) (1)①53.1 ②30.0 6.0×10-2 ③大于 ④ (2)AC查看更多