- 2023-11-06 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高一化学下学期期末联考试题 人教 新目标版
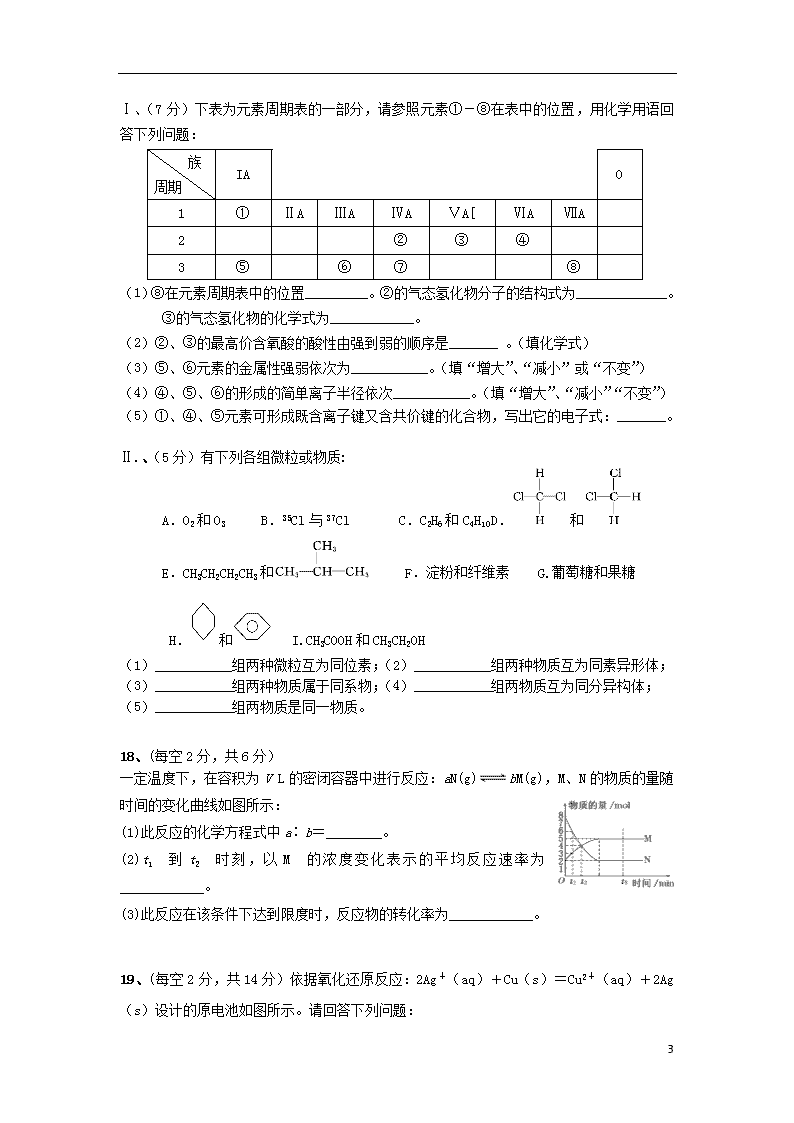
2019高一第二学期化学期末测试卷 (时间:70分钟 满分:100分 ) 可能用到的相对原子质量:Na—23 O—16 H—1 Cl—35.5 Al—27 Ag-108 Cu-64 一、单选题(每小题3分,共48分) 1、He可以作为核聚变材料。下列关于He的叙述中,正确的是() A.质子数为2 B.电子数为3 C.中子数为2 D.质量数为2 2.下列各项中表达正确的是() A.F—的结构示意图: B、CH4的球棍模型示意图: C.NaCl的电子式:D .N2的结构式: :N≡N: 3、下列反应中,属于加成反应的是( ) A.CH4+Cl2CH3Cl+HCl B.CH2=CH2+HClCH3CH2Cl △ C.2CH3CH2OH+O22CH3CHO +2H2O D. 4.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是() A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极 C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢 5、下列关于甲烷和苯的说法中,错误的是 ( ) A.苯是单双建交替的一种六元环 B.甲烷分子具有正四面体结构 C.甲烷可以与卤素单质发生取代反应 D.苯可以和纯的液溴发生取代反应 H—C—C—O—H H H H H ① ② ③ ④ ⑤ 6.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是:( ) A、和金属钠作用时,键①断裂 B、和氧气发生燃烧反应时,所有键断裂 C、和乙酸、浓硫酸共热制乙酸乙酯时,键②断裂 D、在铜催化下和氧气反应时,键①和③断裂 7.在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应: X(g)+2Y(g)2Z(g)。此反应达到平衡的标志是( ) A.单位时间生成0.1 mol X同时生成0.2mol Y B.容器内各物质的浓度不随时间变化 5 C.容器内X、Y、Z的浓度之比为1:2:2 D单位时间消耗0.1 mol X同时生成0.2 mol Z 8.下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是( ) A.加热Al2O3 B.加热CaCO3 C.电解熔融NaCl D.氧化镁与铝粉高温共热 9.一定条件下发生反应N2 + 3H2 2NH3,在5 min内,N2的物质的量浓度由6 mol / L,变为2 mol / L,则用NH3表示该反应在这段时间的平均速率为 ( ) A. 4 mol / (L•min) B. 1.6 mol / (L•min) C. 0.8 mol / (L•min) D. 0.6 mol / (L•min) 10.下列既含有离子键,又含有非极性共价键的物质是( ) A. H2O2 B. Ca(OH)2 C. CaCl2 D. Na2O2 11..列各图中,表示吸热反应的图是( ) 12、下列物质中,不能发生水解反应的是 ( )。 A.油脂 B.淀粉 C.葡萄糖 D.蛋白质 13、下列物质中加入金属钠不产生氢气的是( )。 A.乙醇 B.苯 C.乙酸 D.水 14、下列条件一定能使反应速率加快的是( ) ①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2 A.全部 B.①②⑤ C.② D.②③ 15、可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是 ( ) A.银氨溶液 B.新制氢氧化铜悬浊液 C .石蕊试液 D.碳酸钠溶液 16、X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小 的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y 处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说 法正确的() A.元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 B.元素X与元素Y只能形成一种化合物 C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR D.元素W、R的最高价氧化物对应水化物都是强酸 二.填空题(共52分) 17、(每空1分共12分) 5 Ⅰ、(7分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: 族 周期 IA 0 1 ① ⅡA ⅢA ⅣA ⅤA[ ⅥA ⅦA 2 ② ③ ④ 3 ⑤ ⑥ ⑦ ⑧ (1) ⑧在元素周期表中的位置_________。②的气态氢化物分子的结构式为_____________。 ③的气态氢化物的化学式为____________。 (2)②、③的最高价含氧酸的酸性由强到弱的顺序是_______ 。(填化学式) (3)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”) (4)④、⑤、⑥的形成的简单离子半径依次___________。(填“增大”、“减小”“不变”) (5)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。 Ⅱ.、(5分)有下列各组微粒或物质: A.O2和O3 B.35Cl与37Cl C.C2H6和C4H10D.和 E.CH3CH2CH2CH3和 F.淀粉和纤维素 G.葡萄糖和果糖 H.和 I.CH3COOH和CH3CH2OH (1)___________组两种微粒互为同位素;(2)___________组两种物质互为同素异形体; (3)___________组两种物质属于同系物;(4)___________组两物质互为同分异构体; (5)___________组两物质是同一物质。 18、(每空2分,共6分) 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如图所示: (1)此反应的化学方程式中a∶b=________。 (2)t1到t2时刻,以M的浓度变化表示的平均反应速率为____________。 (3)此反应在该条件下达到限度时,反应物的转化率为____________。 19、(每空2分,共14分)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题: 5 (1)电极X的材料是______;电解质溶液Y是______; (2)银电极为电池的_______极,发生的电极反应为______; X电极上发生的电极反应为______反应;(填“氧化”或“还原”) (3)外电路中的电子______(填“流出”或“流向”)Ag电极。 (4)当有1.6 g铜溶解时,银棒增重______ g。[:] 20、(方程式2分,其他每空1分,共10分) O2 和Cu C △② B H2O 乙烯 已知乙烯能发生以下转化:B和D是生活中常见的有机物。E有香味。 ① ③ 浓硫酸 E D (1)乙烯的结构简式为:________, C的分子式________; (2)B中含官能团用化学符号表示为 _______;D中含官能团的名称为________ ; (3)写出反应的化学方程式 ①:__________________________ 反应类型:________ ; ②:__________________________ 反应类型:________。 21、(每空2分,共10分)学生在实验室制取乙酸乙酯的主要步骤如下: ①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液; ②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;④分离出乙酸乙酯层、洗涤、干燥。 请根据题目要求回答下列问题: (1)配制该混合溶液的主要操作步骤为______________________________________; 写出制取乙酸乙酯的化学方程式:__________________________________________; (2)上述实验中饱和碳酸钠溶液的作用是______________________________________; (3) 浓硫酸的作用______________________________________; (4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。 A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体 昌吉市第一中学教育共同体 高一第二学期化学期末测试卷答案 一、单选题:(每题3分,共48分) 5 题号 1 2 3 4 5 6 7 8 答案 A A B C A C B C 题号 9 10 11 12 13 14 15 16 答案 B D A C B C B C 二、填空题:(共52分) 17、(每空1分共12分) Ⅰ、(7分)(1) 第三周期第ⅦA族;; NH3 (2)H2CO3查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档