- 2023-07-10 发布 |
- 37.5 KB |
- 4页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考流程题专题
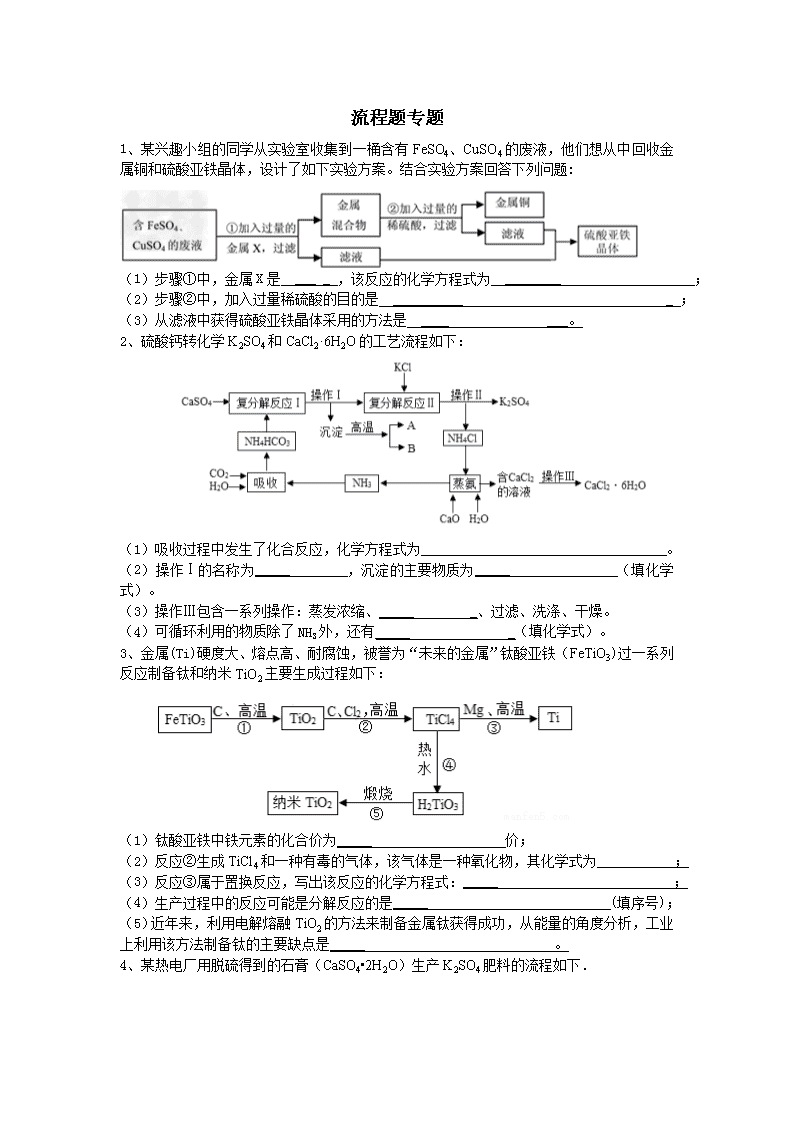
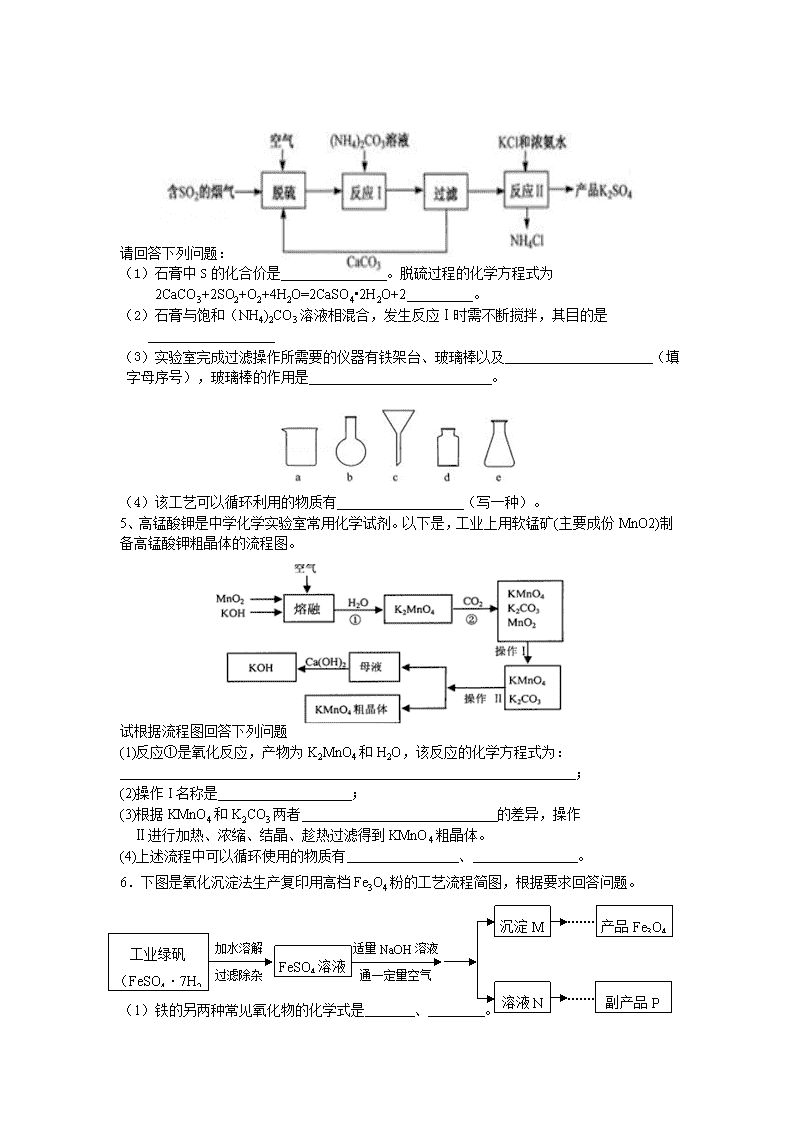
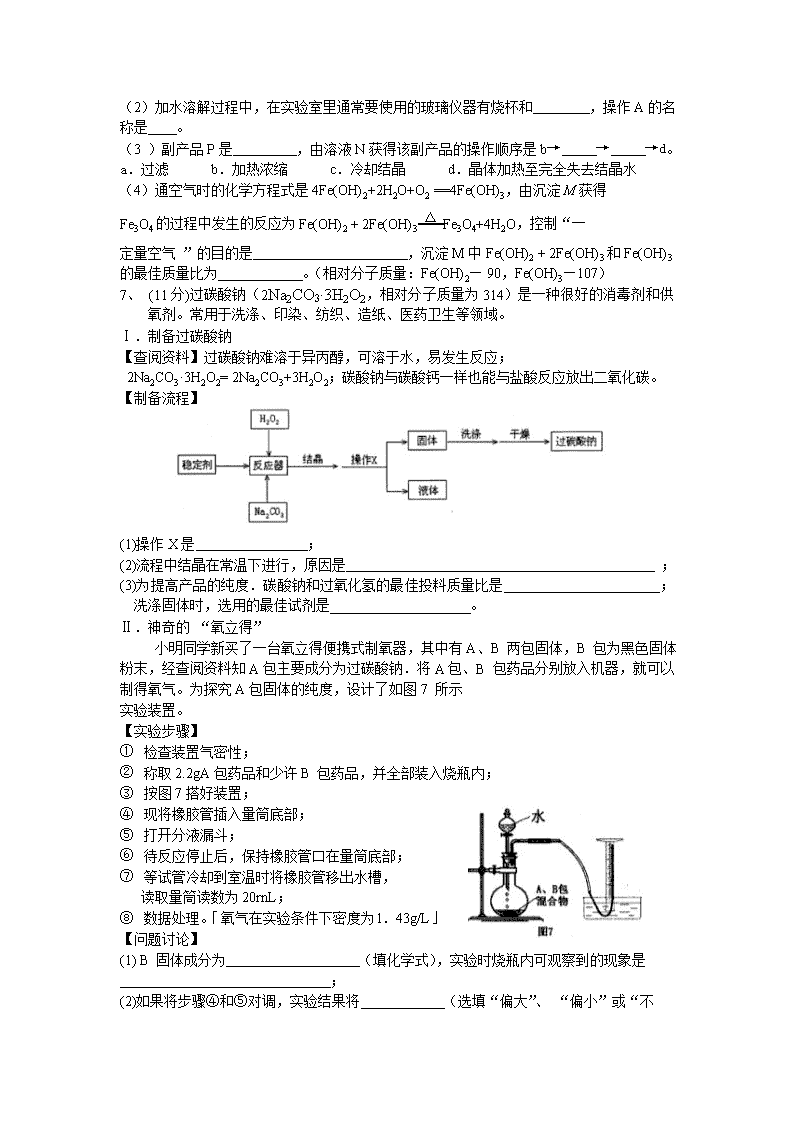
流程题专题 1、某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合实验方案回答下列问题: (1)步骤①中,金属X是 ___ _ ,该反应的化学方程式为 ________ ; (2)步骤②中,加入过量稀硫酸的目的是 __________ _ ; (3)从滤液中获得硫酸亚铁晶体采用的方法是 ____ ___。 2、硫酸钙转化学K2SO4和CaCl2·6H2O的工艺流程如下: (1)吸收过程中发生了化合反应,化学方程式为_____ _。 (2)操作Ⅰ的名称为_____ ,沉淀的主要物质为_____ (填化学式)。 (3)操作Ⅲ包含一系列操作:蒸发浓缩、_____ _、过滤、洗涤、干燥。 (4)可循环利用的物质除了NH3外,还有_____ _(填化学式)。 3、金属(Ti)硬度大、熔点高、耐腐蚀,被誉为“未来的金属”钛酸亚铁(FeTiO3)过一系列反应制备钛和纳米TiO2主要生成过程如下: (1)钛酸亚铁中铁元素的化合价为_____ 价; (2)反应②生成TiCl4和一种有毒的气体,该气体是一种氧化物,其化学式为_____ ; (3)反应③属于置换反应,写出该反应的化学方程式:_____ ; (4)生产过程中的反应可能是分解反应的是_____ (填序号); (5)近年来,利用电解熔融TiO2的方法来制备金属钛获得成功,从能量的角度分析,工业 上利用该方法制备钛的主要缺点是_____ 。 4、某热电厂用脱硫得到的石膏(CaSO4•2H2O)生产K2SO4肥料的流程如下. 请回答下列问题: (1)石膏中S的化合价是 。脱硫过程的化学方程式为 2CaCO3+2SO2+O2+4H2O=2CaSO4•2H2O+2 。 (2)石膏与饱和(NH4)2CO3溶液相混合,发生反应Ⅰ时需不断搅拌,其目的是 (3)实验室完成过滤操作所需要的仪器有铁架台、玻璃棒以及 (填字母序号),玻璃棒的作用是 。 (4)该工艺可以循环利用的物质有 (写一种)。 5、高锰酸钾是中学化学实验室常用化学试剂。以下是,工业上用软锰矿(主要成份MnO2)制备高锰酸钾粗晶体的流程图。 试根据流程图回答下列问题 (1)反应①是氧化反应,产物为K2MnO4和H2O,该反应的化学方程式为: ; (2)操作I名称是 ; (3)根据KMnO4和K2CO3两者 的差异,操作 Ⅱ进行加热、浓缩、结晶、趁热过滤得到KMnO4粗晶体。 (4)上述流程中可以循环使用的物质有 、 。 6.下图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。 适量NaOH溶液 通一定量空气 加水溶解 过滤除杂 溶液N 沉淀M 工业绿矾(FeSO4·7H2O) FeSO4溶液 副产品P 产品Fe3O4 (1)铁的另两种常见氧化物的化学式是 、 。 (2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和 ,操作A的名称是 。 (3 )副产品P是 ,由溶液N获得该副产品的操作顺序是b→ → →d。 a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水 (4)通空气时的化学方程式是4Fe(OH)2+2H2O+O2 ==4Fe(OH)3,由沉淀M获得 Fe3O4的过程中发生的反应为Fe(OH)2 + 2Fe(OH)3 △ Fe3O4+4H2O,控制“一 定量空气 ”的目的是 ,沉淀M中Fe(OH)2 + 2Fe(OH)3和Fe(OH)3的最佳质量比为 。(相对分子质量:Fe(OH)2— 90,Fe(OH)3—107) 7、 (11分)过碳酸钠(2Na2CO3·3H2O2,相对分子质量为314)是一种很好的消毒剂和供氧剂。常用于洗涤、印染、纺织、造纸、医药卫生等领域。 Ⅰ.制备过碳酸钠 【查阅资料】过碳酸钠难溶于异丙醇,可溶于水,易发生反应; 2Na2CO3·3H2O2= 2Na2CO3+3H2O2;碳酸钠与碳酸钙一样也能与盐酸反应放出二氧化碳。 【制备流程】 (1)操作X是 ; (2)流程中结晶在常温下进行,原因是 ; (3)为提高产品的纯度.碳酸钠和过氧化氢的最佳投料质量比是 ; 洗涤固体时,选用的最佳试剂是 。 Ⅱ.神奇的 “氧立得” 小明同学新买了一台氧立得便携式制氧器,其中有A、B 两包固体,B 包为黑色固体粉末,经查阅资料知A包主要成分为过碳酸钠.将A包、B 包药品分别放入机器,就可以制得氧气。为探究A包固体的纯度,设计了如图7 所示 实验装置。 【实验步骤】 ① 检查装置气密性; ② 称取2.2gA包药品和少许B 包药品,并全部装入烧瓶内; ③ 按图7搭好装置; ④ 现将橡胶管插入量筒底部; ⑤ 打开分液漏斗; ⑥ 待反应停止后,保持橡胶管口在量筒底部; ⑦ 等试管冷却到室温时将橡胶管移出水槽, 读取量筒读数为20rnL; ⑧ 数据处理。「氧气在实验条件下密度为l.43g/L」 【问题讨论】 (1) B 固体成分为 (填化学式),实验时烧瓶内可观察到的现象是 ; (2)如果将步骤④和⑤对调,实验结果将 (选填“偏大”、 “偏小”或“不 变”) ,理由是 ; (3)证明反应停止后烧瓶中有碳酸钠的方法是 ; (4)此样品中过碳酸钠的质量分数为 8、请根据下列图示回答问题: ① 甲图中R物质在室温(20℃)时的饱和状态为D点,40℃时的饱和状态为A点,现将甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径: a. 、 b. ; c.A状态由两种不同途径变到B状态时,溶液的溶质质量分数是否相等 (填“是” 或“否”)。 ② 乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线。现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是 (填序号,多选、少选、错选均不给分)。 a.只有N析出晶体; b.M、N两种溶液的溶质质量分数相等; c.只有M析出晶体: d.M、N均有晶体析出: e.M、N两种物质的溶解度相同。查看更多