- 2021-06-26 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第3章 自然界中的元素
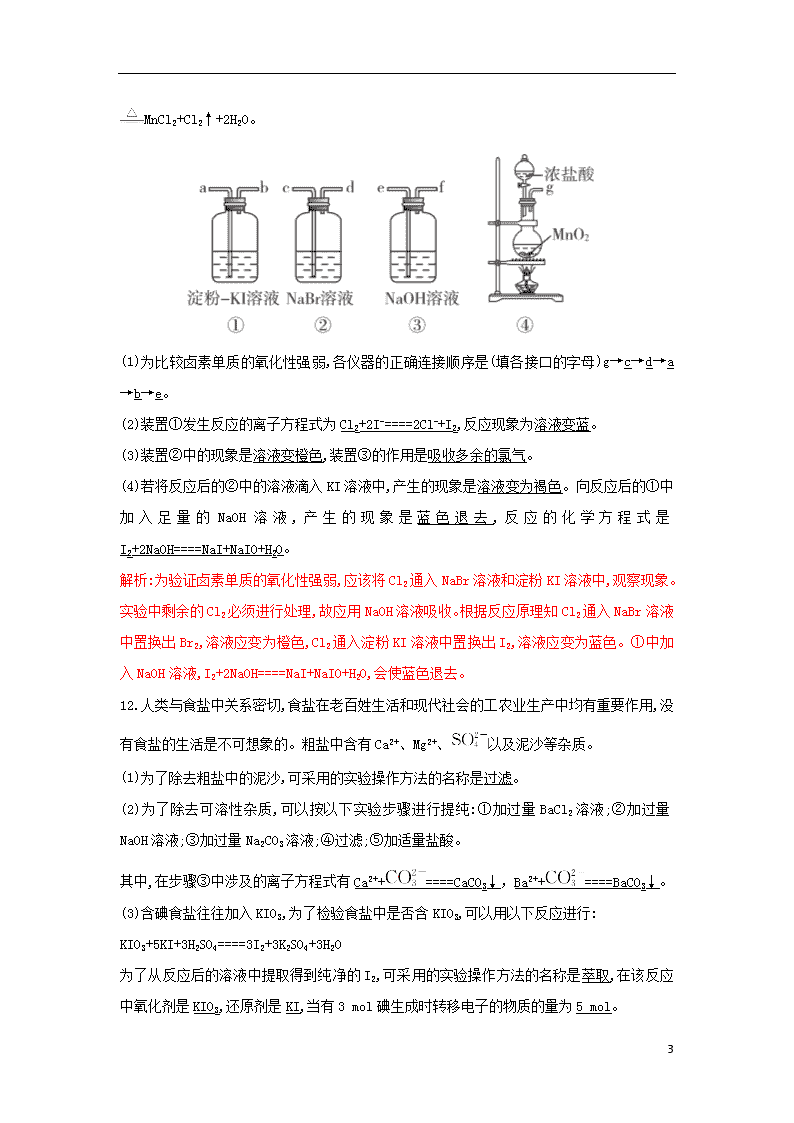
1 3.4.2 溴与海水提溴 1.向盛有液溴的试剂瓶中注入一定量的水,其目的是(C) A.制溴水 B.比较液溴和水的密度 C.防止液溴挥发 D.隔绝空气 2.除去海水提溴得到的液溴中溶有的少量氯气,应该采用的方法是(D) A.加入适量的 KI 溶液 B.通入溴蒸气 C.加氢氧化钠溶液 D.加入适量的溴化钠溶液 3.溴的氧化性介于氯和碘之间。利用这一性质判断下列说法正确的是(C) A.Cl-、I-加入含 Br-的溶液中,均可以将 Br-氧化为 Br2 B.把 Cl2 缓慢通入含有相同物质的量浓度的 Br-、I-的混合溶液中,Br-先被氧化 C.湿润的淀粉—碘化钾试纸遇到氯气会变成蓝色 D.KBr 溶液中加入碘水发生如下反应:2Br-+I2====2I-+Br2 解析:Cl-、I-都只有还原性,不能将 Br-氧化为 Br2,A 错误;还原性:I->Br-,故向含 Br-、I-的 混合溶液中通入 Cl2 时,Cl2 先氧化 I-后氧化 Br-,B 错误;Cl2+2KI====I2+2KCl,I2 遇淀粉变蓝,C 正确;Br2 的氧化性大于 I2,反应: 2Br-+I2====2I-+Br2 不可能发生,D 错误。 4.将少量氯水加入 KI 溶液中振荡,再加 CCl4 溶液,振荡,静置后观察到的现象是(D) A.形成均匀的蓝色溶液 B.有紫色沉淀析出 C.液体分层,上层呈紫红色 D.液体分层,下层呈紫红色 5.a、b、c、d 四个集气瓶中装有 Cl2、H2、HCl、HBr 中的任一种气体。若 a、d 两瓶气体混 合见光爆炸,a、b 两瓶气体混合瓶壁出现暗红色小液滴。则 c 瓶装的气体是(B) A.HBr B.HCl C.Cl2 D.H2 6.海带中含碘元素,有人设计如下步骤来提取碘:①通入足量氯气;②将海带烧成灰,向灰 中加水搅拌;③加 CCl4 振荡;④过滤;⑤用分液漏斗分液。合理的操作顺序是(A) 2 A.②④①③⑤ B.②①③④⑤ C.①③⑤②④ D.③①②⑤④ 7.痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,硝酸银显现法就是其中的一种:人 的手上有汗渍,当手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液 ①中的溶质就与汗渍中的物质②反应,生成物质③,物质③在光照下,分解出的银粒呈灰褐色, 随着反应的进行,银粒逐渐增多,指纹线就由棕色变成黑色。则①②③这三种物质分别是(B) A.①硝酸银②溴化钠③溴化银 B.①硝酸银②氯化钠③氯化银 C.①氯化银②硝酸银③氯化钠 D.①硝酸银②碘化钠③碘化银 8.甲、乙、丙三种溶液各含有一种卤离子 X-(X-指 Cl-、Br-、I-),若向甲中加淀粉溶液和氯 水,溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙中依次含有(B) A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl- D.Cl-、I-、Br- 9.已知还原性:I->Fe2+>Br-。利用这一性质判断下列检验 KI 溶液中是否含 Br-的方法正确的 是(D) A.加入足量的新制氯水,溶液变色则有 Br- B.加入酸性 KMnO4 溶液,观察溶液颜色是否退去 C.加入少量的碘水,再加入 CCl4 振荡,有机层有色,则有 Br- D.加入足量 FeCl3 溶液,用 CCl4 萃取后,在无色的水层中加入氯水,溶液呈橙色,则含有 Br- 10.现有三种溶液:①NaCl 溶液②NaBr 溶液③NaI 溶液 (1)向①②③中分别滴入硝酸酸化的 AgNO3 溶液。其现象分别是生成白色沉淀、生成浅黄色 沉淀、生成黄色沉淀。 (2)向①②③中分别通入 Cl2,其现象分别是无明显现象、溶液由无色变为橙色、溶液由无 色变为褐色。 (3)向①②③中分别滴入溴水,其现象分别是无明显现象、无明显现象、溶液由无色变为褐 色。 11.某化学课外小组为了探究卤素单质及其化合物的性质,选用以下仪器和药品进行实验,请 你帮助完成实验仪器的组装并回答问题。 已知实验室中可用二氧化锰和浓盐酸在加热条件下制取氯气,化学方程式为 MnO2+4HCl(浓) 3 MnCl2+Cl2↑+2H2O。 (1)为比较卤素单质的氧化性强弱,各仪器的正确连接顺序是(填各接口的字母)g→c→d→a →b→e。 (2)装置①发生反应的离子方程式为 Cl2+2I-====2Cl-+I2,反应现象为溶液变蓝。 (3)装置②中的现象是溶液变橙色,装置③的作用是吸收多余的氯气。 (4)若将反应后的②中的溶液滴入 KI 溶液中,产生的现象是溶液变为褐色。向反应后的①中 加 入 足 量 的 NaOH 溶 液 , 产 生 的 现 象 是 蓝 色 退 去 , 反 应 的 化 学 方 程 式 是 I2+2NaOH====NaI+NaIO+H2O。 解析:为验证卤素单质的氧化性强弱,应该将 Cl2 通入 NaBr 溶液和淀粉 KI 溶液中,观察现象。 实验中剩余的 Cl2 必须进行处理,故应用 NaOH 溶液吸收。根据反应原理知 Cl2 通入 NaBr 溶液 中置换出 Br2,溶液应变为橙色,Cl2 通入淀粉 KI 溶液中置换出 I2,溶液应变为蓝色。①中加 入 NaOH 溶液,I2+2NaOH====NaI+NaIO+H2O,会使蓝色退去。 12.人类与食盐中关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没 有食盐的生活是不可想象的。粗盐中含有 Ca2+、Mg2+、 以及泥沙等杂质。 (1)为了除去粗盐中的泥沙,可采用的实验操作方法的名称是过滤。 (2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量 BaCl 2 溶液;②加过量 NaOH 溶液;③加过量 Na2CO3 溶液;④过滤;⑤加适量盐酸。 其中,在步骤③中涉及的离子方程式有 Ca2++ ====CaCO3↓,Ba2++ ====BaCO3↓。 (3)含碘食盐往往加入 KIO3,为了检验食盐中是否含 KIO3,可以用以下反应进行: KIO3+5KI+3H2SO4====3I2+3K2SO4+3H2O 为了从反应后的溶液中提取得到纯净的 I2,可采用的实验操作方法的名称是萃取,在该反应 中氧化剂是 KIO3,还原剂是 KI,当有 3 mol 碘生成时转移电子的物质的量为 5 mol。 4 (4)电解熔融状态的 NaCl 可以制得 Na:2NaCl(熔融) 2Na+Cl2↑。得到的金属钠应保 存在煤油中,在空气中容易被氧化。若部分被氧化的 Na 质量是 0.77 g,加入到 10 g 水中,产 生 0.02 g 氢气。则所得溶液中溶质的质量分数是 11.16%(保留到小数点后两位)。 解析:(1)不溶性固体和可溶性固体的分离通常用过滤法。 (2)加入 Na2CO3 溶液的作用:一是除去 Ca2+,二是除去加入的过量的 Ba2+。 (4)2Na+2H2O====2NaOH + H2↑ 46 80 2 m(Na) m1(NaOH) 0.02 g m(Na)= =0.46 g, m1(NaOH)= =0.80 g, 故氧化钠的质量为 0.77 g-0.46 g=0.31 g。 Na2O+H2O====2NaOH 62 80 0.31 g m2(NaOH) m2(NaOH)=0.40 g, 故所得溶液的溶质质量分数是 ×100%≈11.16%。查看更多