- 2021-06-25 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学第二章化学键化学反应与能量第三节化学反应的利用第1课时利用化学反应制备物质课后提升练习含解析鲁科版必修2
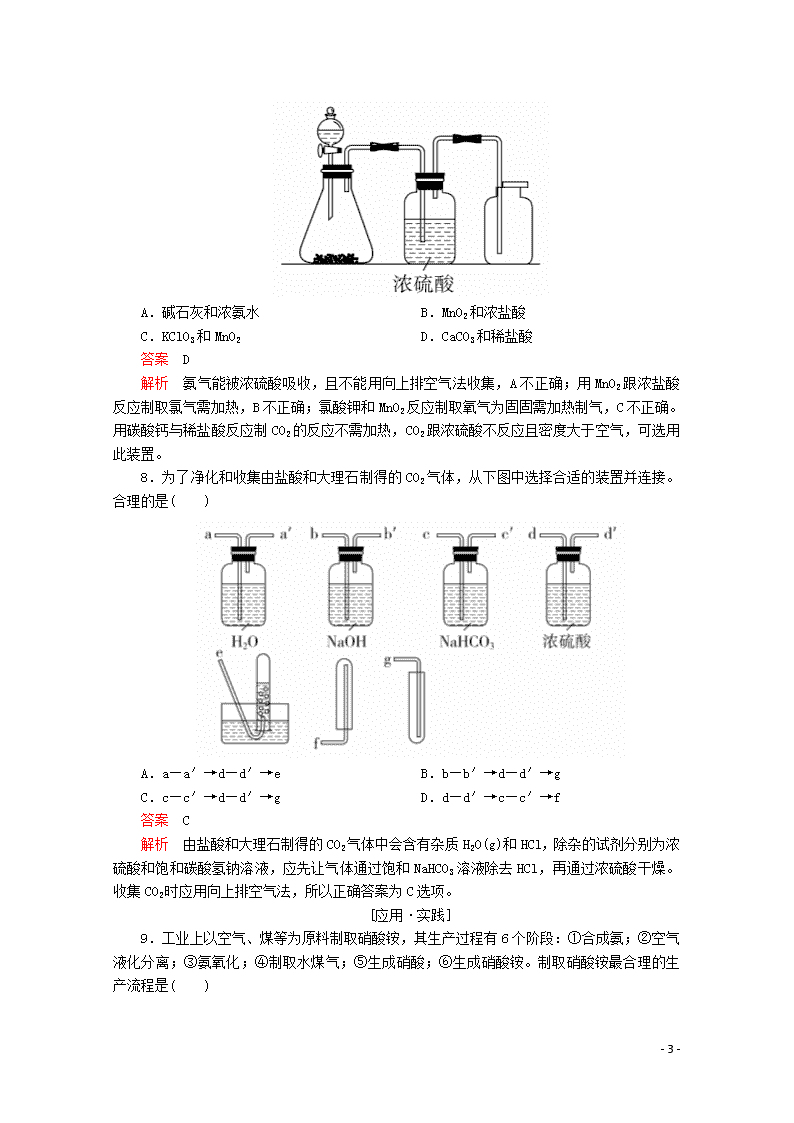
利用化学反应制备物质 [学习·理解] 1.培养良好的实验习惯对同学们今后的学习和工作都有十分重要的意义,同时实验步骤的严密性和准确性也是一个实验成功与否的决定因素。实验室制取氯气时有如下操作,其中正确的顺序是( ) ①连接装置并检查气密性 ②缓缓加热 ③加入MnO2粉末 ④从装有浓盐酸的分液漏斗中加入浓盐酸 ⑤将多余氯气用NaOH溶液吸收 ⑥用向上排空气法收集氯气 A.①②③④⑤⑥ B.③④②①⑥⑤ C.①④③②⑥⑤ D.①③④②⑥⑤ 答案 D 解析 本题主要考查氯气的实验室制法中的实验操作,即先连接装置并检查装置的气密性,再加药品,且先加固体再加液体,之后为减少HCl的挥发要缓慢加热,然后利用氯气的密度比空气密度大的性质用向上排空气法收集氯气,因为氯气有毒,最后必须用碱液吸收多余氯气以防止污染空气。 2.关于实验室制Cl2,下列说法正确的是( ) A.可用KMnO4和浓盐酸反应制取 B.用碱石灰干燥Cl2 C.用排水法收集Cl2 D.用饱和石灰水吸收尾气 答案 A 解析 KMnO4、MnO2都是氧化剂,都能与浓盐酸反应制取Cl2,A正确。Cl2是酸性气体,能溶于水,不能用碱石灰干燥,也不能用排水法收集,B、C错误。Ca(OH)2微溶于水,饱和石灰水中溶有的Ca(OH)2太少,吸收尾气不彻底,D错误。 3.下列操作或装置能达到实验目的的是( ) A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢 C.实验室用稀盐酸和高锰酸钾反应制取Cl2 - 8 - D.在制取干燥纯净的Cl2时,先使Cl2通过饱和食盐水,后通过浓硫酸 答案 D 解析 实验室制取氯气需要加热条件,A项不正确;除去氯气中的氯化氢气体用饱和食盐水,且气体应长进短出,B项不正确;实验室应用浓盐酸与高锰酸钾反应制取氯气,C项不正确。 4.实验室制氯气的反应4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,下列说法错误的是( ) A.还原剂是HCl,氧化剂是MnO2 B.每生成1 mol Cl2,转移电子2 mol C.每消耗1 mol MnO2,起还原作用的HCl为4 mol D.生成的氯气中含有水蒸气和HCl 答案 C 解析 4 mol HCl中有2 mol Cl-由-1价升高至0价,起还原作用的HCl为2 mol。 5.按下述实验方法制备气体,合理又实用的是( ) A.Zn粒与稀HNO3反应制备H2 B.用稀HCl和MnO2反应制备Cl2 C.Na2SO3固体与浓H2SO4反应制备SO2 D.加热分解NH4Cl固体制备NH3 答案 C 解析 锌与稀硝酸反应产生NO,不产生H2,A项不可行;稀盐酸和MnO2不反应,B项不可行;Na2SO3与浓硫酸反应生成Na2SO4、H2O和SO2,C项可行;NH4Cl分解产生的NH3和HCl会重新结合成NH4Cl,D项不可行。 6.在实验室中用浓盐酸与MnO2共热制取Cl2。下列收集Cl2的装置正确的是( ) 答案 C 解析 A中装置没有出气导管,不能用于收集气体;B中装置用于收集密度比空气小的气体;C中装置可以收集密度比空气大的气体,且C中具有尾气吸收装置;D中装置可用于吸收氯气,不能用于收集氯气。 7.如图所示是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是( ) - 8 - A.碱石灰和浓氨水 B.MnO2和浓盐酸 C.KClO3和MnO2 D.CaCO3和稀盐酸 答案 D 解析 氨气能被浓硫酸吸收,且不能用向上排空气法收集,A不正确;用MnO2跟浓盐酸反应制取氯气需加热,B不正确;氯酸钾和MnO2反应制取氧气为固固需加热制气,C不正确。用碳酸钙与稀盐酸反应制CO2的反应不需加热,CO2跟浓硫酸不反应且密度大于空气,可选用此装置。 8.为了净化和收集由盐酸和大理石制得的CO2气体,从下图中选择合适的装置并连接。合理的是( ) A.a—a′→d—d′→e B.b—b′→d—d′→g C.c—c′→d—d′→g D.d—d′→c—c′→f 答案 C 解析 由盐酸和大理石制得的CO2气体中会含有杂质H2O(g)和HCl,除杂的试剂分别为浓硫酸和饱和碳酸氢钠溶液,应先让气体通过饱和NaHCO3溶液除去HCl,再通过浓硫酸干燥。收集CO2时应用向上排空气法,所以正确答案为C选项。 [应用·实践] 9.工业上以空气、煤等为原料制取硝酸铵,其生产过程有6个阶段:①合成氨;②空气液化分离;③氨氧化;④制取水煤气;⑤生成硝酸;⑥生成硝酸铵。制取硝酸铵最合理的生产流程是( ) - 8 - 答案 D 解析 先制取氮气和氢气,再进行化合生成氨气,然后进行催化氧化、生成硝酸,最后硝酸和氨气反应生成硝酸铵。 10.设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(如图所示)。若关闭K不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散)。下列气体的制取方案宜使用该装置的是( ) A.用二氧化锰(粉末状)与双氧水反应制氧气 B.用锌粒与稀硫酸反应制氢气 C.用硫化亚铁(块状)与盐酸反应制硫化氢 D.用碳酸钙(块状)与稀硫酸反应制二氧化碳 答案 B 解析 用启普发生器制取气体的试剂需用块状(或大颗粒状),由于MnO2是粉末状,因此不宜使用该装置制取氧气,A项错误;由于H2S气体有毒,不宜使用该装置制取H2S气体,C项错误;由于碳酸钙与稀硫酸反应生成的CaSO4 - 8 - 微溶且会附着在碳酸钙表面而阻止反应进行,现象不明显,因此不宜使用该装置制取CO2气体,D项错误。 11.氯气是一种重要的化工原料,在生产和生活中应用十分广泛。已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,所以在实验室可用高锰酸钾固体和浓盐酸制氯气,实验装置如下图所示。 (1)请为该实验选择合适的发生装置________(填“A”或“B”)。 (2)要得到纯净、干燥的氯气,在发生装置和集气瓶之间还需要放置如下图中的________。 (3)当集气瓶中收集满氯气时,可以观察到气体呈________色。烧杯中所盛液体为________,其作用是________________________。 答案 (1)B (2)D (3)黄绿 NaOH溶液 吸收多余的氯气 解析 (1)由题知,该反应制取气体的类型为固体+液体→气体;反应不需加热,故应选择B装置。 (2)氯气中可能混有HCl、H2O(g),HCl用饱和NaCl溶液除去,H2O(g)用浓硫酸除去,要得到纯净、干燥的氯气,应先除去HCl,再除去H2O(g)。 (3)氯气的颜色为黄绿色,烧杯中所盛液体为NaOH溶液,其作用是吸收多余的氯气。 12.实验室用下列仪器和药品制取干燥纯净的氯气。 - 8 - (1)按气流从左到右,装置正确的连接为( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)。 (2)装置E的作用是__________________________, 装置D的作用是__________________________。 (3)装置A和D中反应的化学方程式: A__________________________; D__________________________。 (4)某校化学兴趣小组称取8.7 g二氧化锰与足量10 mol·L-1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=________L。 (5)若该小组量取了10 mol·L-1的浓盐酸40 mL,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1________(填“>”“<”或“=”)V2,原因是__________________________ __________________________。 答案 (1)a f h b c e d g (2)除掉氯气中混有的HCl 吸收多余的氯气 (3)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O Cl2+2NaOH===NaClO+NaCl+H2O (4)2.24 (5)> 随着反应的进行,盐酸浓度减小,稀盐酸不与MnO2反应,反应不再进行 解析 仪器的连接应按照制备、净化、收集、尾气吸收的顺序;E的作用是除氯化氢杂质,装置D只有一段导气管,是尾气吸收装置,内装氢氧化钠溶液。8.7 g二氧化锰物质的量为0.1 mol,MnO2与浓盐酸完全反应可产生0.1 mol氯气,标况下体积为2.24 L; 10 mol·L-1的浓盐酸40 mL,其中氯化氢的物质的量为0.4 mol,若0.4 mol氯化氢与足量MnO2完全反应也可产生0.1 mol氯气,但浓盐酸在反应过程中会逐渐变稀,其中的0.4 mol氯化氢不能完全反应,产生的氯气少于0.1 mol,所以V1>V2。 [迁移·创新] 13.已知无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾(AlCl3与水蒸气反应),实验室可设计如下两种装置制备AlCl3。 (1)装置一: - 8 - 回答以下问题: ①实验室常用MnO2与浓盐酸反应制备Cl2,制备实验开始时,先检查装置气密性,接下来的操作依次是________(填字母)。 A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸 ②装置B中盛放饱和NaCl溶液,该装置的主要作用是____________________,F中试剂的作用是__________________________ __________________________。 ③用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________。 (2)装置二:仪器X与仪器Y(广口瓶)直接相连的意图是①用Y收集产物AlCl3,②防止堵塞玻璃导管。回答以下问题: ①装置D中发生反应的化学方程式是__________________________ __________________________。 ②能否去掉E装置________,原因是__________________________ __________________________。 ③实验时应先点燃________处的酒精灯,其作用是_______________ __________________________。 答案 (1)①ACB ②除去Cl2中的HCl 防止水蒸气进入E中与AlCl3反应 ③碱石灰 (2)①2Al+3Cl22AlCl3 ②否 若去掉E装置,水蒸气会与Y中的AlCl3反应 ③ - 8 - A 排出装置中的空气,防止铝与氧气反应生成Al2O3 解析 (1)①操作时,先加固体,后加液体,再加热。②装置B中饱和NaCl溶液用于除去氯气中的HCl,F盛装浓硫酸,防止水蒸气进入E。③为除去多余的氯气和防止空气中的水蒸气进入E瓶中,可用干燥管盛装碱石灰代替F和G中的两种试剂的作用。 (2)①Al与Cl2在加热条件下生成AlCl3。②若去掉E装置,水蒸气进入Y会与Y中的AlCl3反应。③实验时先点燃A处的酒精灯,以排出装置中的空气,防止铝与氧气反应生成Al2O3。 - 8 -查看更多