- 2021-06-23 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
厦门市中考化学试题及答案WORD版
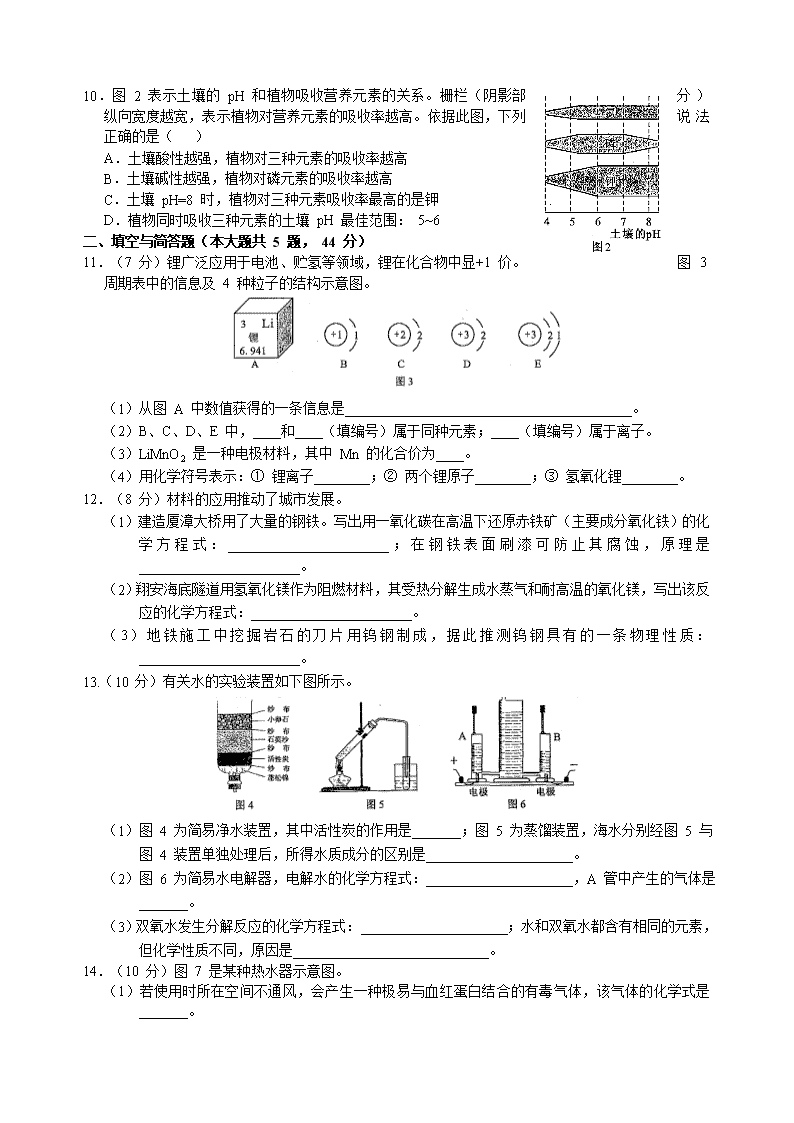
2013年厦门市初中毕业及高中阶段各类学校招生考试 化 学 试 题(附 答 案) (试卷满分: 100 分 考试时间: 60 分钟) 准考证号_________________姓名____________座位号________ 注意事项: 1.全卷四大题,共 18 题;试卷共 5 页,另有答题卡。 2.答案一律写在答题卡上,否则不能得分。 3.可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-63.5 Zn-65 一、选择题(本大题共 10 题, 25 分:第 1~5 题各 2 分,第 6~10 题各 3 分。每题只有一个选项符合题意,在答题卡选择题栏内用 2B 铅笔将该选项涂黑) 1.飞船舱中需提供给人呼吸的气体是( ) A.氮气 B.氧气 C.二氧化碳 D.稀有气体 2.下列物质中含维生素的是( ) A.水果 B.蔗糖 C.食盐 D.矿泉水 3.会造成白色污染的生活弃物是( ) A.果皮菜叶 B.塑料袋 C.木质筷子 D.铝制易拉罐 4.下列洗涤或除污过程应用乳化原理的是( ) A.用汽油除去衣服上的油污 B .用酒精除去衣服上的碘 C.用洗洁精洗去餐具上的油脂 D.用刷子刷除杯子上的污垢 5.下列灭火方法不合理的是 ( ) A.电器着火——用水泼灭 B.油锅着火——用锅盖盖灭 C.身上着火——就地打滚压灭 D.桌面上酒精燃烧——用湿抹布盖灭 6.青篙素(化学式为 C15H22O5)是治疗疟疾的特效药。关于青篙素的说法正确的是 ( ) A.不属于有机物 B . 28.2g 青篙素中含碳元素的质量为 18g C.一个青篙素分子含有 11 个氢分子 D . C 、 H 、 O 三种元素的质量比为 15 : 22 : 5 7.实验室需要 100g 质量分数为 3 %氯化钠溶液,配制过程中相关描述正确的是 ( ) A.用 3g 氯化钠与 100g 水配制得到 B.直接用手抓取氯化钠 C.氯化钠直接放于天平托盘上称取 D.用50g 质量分数6%氯化钠溶液与50g 水配制得到 8.用“”和“”分别代表两种不同单质A2和 B2 的分子,A2和 B2 在一定条件下发生化学反应生成新物质 X ,微观过程如图 1 所示。下列说法正确的是( ) A.在反应过程中 A2 和 B2 分子保持不变 B.该反应为置换反应 C.参加反应的A2与 B2 分子数之比为 3 : l D.物质 X 含 4 种元素 9.下列依据实验目的进行的实验设计,合理的是( ) 选项 实验目的 实验设计 A 从空气中获取纯净的氮气 用硫燃烧除去空气中的氧气 B 鉴别硬水和软水 观察颜色或闻气味 C 除去混在二氧化碳中的氯化氢气体 把混合气体通过足量的氢氧化钠溶液 D 鉴别硝酸铵和氯化钠固体 加适量的水溶解,测量前后温度变化 10.图 2 表示土壤的 pH 和植物吸收营养元素的关系。栅栏(阴影部分)纵向宽度越宽,表示植物对营养元素的吸收率越高。依据此图,下列说法正确的是( ) A.土壤酸性越强,植物对三种元素的吸收率越高 B.土壤碱性越强,植物对磷元素的吸收率越高 C.土壤 pH=8 时,植物对三种元素吸收率最高的是钾 D.植物同时吸收三种元素的土壤 pH 最佳范围: 5~6 二、填空与简答题(本大题共 5 题, 44 分) 11.(7 分)锂广泛应用于电池、贮氢等领域,锂在化合物中显+1 价。图3周期表中的信息及 4 种粒子的结构示意图。 (1)从图 A 中数值获得的一条信息是_________________________________________。 (2)B、C、D、E 中,____和____(填编号)属于同种元素;____(填编号)属于离子。 (3)LiMnO2 是一种电极材料,其中 Mn 的化合价为____。 (4)用化学符号表示:① 锂离子________;② 两个锂原子________;③ 氢氧化锂________。 12.(8 分)材料的应用推动了城市发展。 (1)建造厦漳大桥用了大量的钢铁。写出用一氧化碳在高温下还原赤铁矿(主要成分氧化铁)的化学方程式:_______________________;在钢铁表面刷漆可防止其腐蚀,原理是_______________________。 (2)翔安海底隧道用氢氧化镁作为阻燃材料,其受热分解生成水蒸气和耐高温的氧化镁,写出该反应的化学方程式:_______________________。 (3)地铁施工中挖掘岩石的刀片用钨钢制成,据此推测钨钢具有的一条物理性质:_______________________。 13.(10 分)有关水的实验装置如下图所示。 (1)图 4 为简易净水装置,其中活性炭的作用是_______;图 5 为蒸馏装置,海水分别经图 5 与图 4 装置单独处理后,所得水质成分的区别是_____________________。 (2)图 6 为简易水电解器,电解水的化学方程式:_____________________,A 管中产生的气体是_______。 (3)双氧水发生分解反应的化学方程式:_____________________;水和双氧水都含有相同的元素,但化学性质不同,原因是____________________________。 14.(10 分)图 7 是某种热水器示意图。 (1)若使用时所在空间不通风,会产生一种极易与血红蛋白结合的有毒气体,该气体的化学式是_______。 (2)下表是燃烧 1kg 不同燃料所产生两种气体的质量: 燃料 产生的CO2气体的质量/g 产生的SO2气体的质量/g A.石油气 2900 5.0 B.天然气 2500 0.1 C.煤气 2500 11.0 ① 写出天然气的主要成分燃烧的化学方程式:_____________________。 ② 等质量上述燃料燃烧,产生导致温室效应的气体最多的是____(填编号) , 产生导致酸雨的气体最多的是____(填编号);例举一种不产生以上两种环境问题的能源:_____________。 (3)热水器长期使用后产生水垢,写出稀盐酸与水垢中的碳酸钙反应的化学方程式:_____________________。 15.(9 分)几种常见物质之间的相互转化关系如图 8 所示(各字母代表一种物质,部分反应物、生成物及反应条件略去)。己知: ① 五种物质均含铜元素,且化合物中铜元素的化合价均为+ 2 ; ② A 为单质,在空气中加热后生成黑色物质 B ; ③ X 溶液与铁反应可得到 A ; ④ X 溶液与氯化钡溶液反应可得到 D ,同时有白色沉淀生成; ⑤ D 溶液中加入少量的氢氧化钠溶液得到 E 。结合信息推断: (1)B 的化学式是______。 (2)D→E 的反应基本类型是____________; E 与某种酸反应可实现 E→X 转化,该酸的名称是____________。 (3)写出以下转化的化学方程式: X→A : ________________________ ; X→D : ________________________。 三、实验与探究题(本大题共 2 题,20分) 16. (7 分)用 Y 形管或 Y 形导管完成以下实验。 (1)图 9 中 Y 形管左侧管中加入无色酚酞试液,右侧管中加入浓氨水,一段时间后,可观察到的现象:________________________,用分子的观点解释这一现象:________________________。 (2)图 10 中 Y 形导管平放于桌面,实验中可观察到的现象;________________________,用化学方程式解释结论:________________________;若把 Y 形导管固定在铁架台上(如图 11 ) , a 管位于上方, b 管位于下方,两石蕊试纸均湿润,可观察到 b 管中试纸变色比 a 管明显,原因:________________________。 17.(13 分)某化学兴趣小组回收利用废旧干电池。 实验 1 回收填料中的二氧化锰和氯化铵 查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。兴趣小组的同学们设计回收物质的流程如图 12 所示。 (1)操作 1 和操作 2 的名称都是____________,该操作中玻璃棒的作用是____________。 (2)灼烧滤渣 l 的目的是________________________ 。 (3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液 1 时,大量的氯化铵 晶体先析出,说明该温度下氯化铵溶解度____氯化锌的溶解度(填“<”、“=”或“>”)。 实验 2 利用外壳回收物锌制取氢气及相关探究 (4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图 13 。 ① 应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。 ② 若用排水法收集并测定气体的体积,气体从装置 B 导管口____(填“ a ”或“ b ” ) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是________。 (5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。 验实号编 试剂 前 10 min 内产生的氢气体积(mL) 不同纯度的锌 不同体积和浓度的稀硫酸 a 纯锌 30 mL 30 % 564.3 b 含杂质的锌 30 InL 30 % 634.7 c 纯锌 30 mL 20 % 449.3 d 纯锌 40 mL 30 % 602.8 ① 比较实验 a 和实验 b ,可以得到的结论是________________________。 ② 为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。 ③ 控制其他条件相同,需控制的条件是______________________(例举一种条件即可)。 四、计算与应用题(本大题共 1 题, 11 分) 18.(11 分)为测定锌铜合金中锌的含量,取该合金放入如图 14 盛有稀硫酸的锥形瓶中,发生反应: Zn+H2SO4=ZnSO4+H2↑ 。多次实验后,取平均值所得数据如下表: 反应前 充分反应后装置及反应剩余物质质量 装置和足量的稀硫酸质量 锌铜合金质量 342.10g 16.00g 357.70g 若不考虑干燥剂吸收空气中的水蒸气,计算: (1)根据质量守恒定律求生成氢气的质量。 (2)该合金中锌的质量分数。 2013 年厦门市初中毕业及高中阶段各类学校招生考试化学参考答案 一、选择题(本大题共 10 题, 25 分:第 1~5 题各 2 分,第 6~10 题各 3 分。) 1 2 3 4 5 6 7 8 9 10 B B B C A B D C D C 二、填空与简答题(本大题共 5 题, 44 分) 11.(7 分) (1)锂元素的相对原子质量为6.941。 (2)D、E;D。 (3)+3。 (4)①Li+;②2Li;③LiOH。 12.(8 分) (1)3CO+Fe2O32Fe+3CO2;隔绝空气中的氧气。 (2)Mg(OH)2MgO+H2O。 (3)质地坚硬。 13.(10 分) (1)吸附;纯净物与混合物的区别。 (2)2H2O2H2↑+O2↑;氧气。 (3)2H2O22H2O+O2↑;分子结构不同。 14.(10 分) (1)一氧化碳(CO)。 (2)① CH4+2O2CO2+2H2O。 ② A, C;太阳能。 (3)CaCO3+2HCl=CaCl2+H2O+CO2↑。 15.(9 分) (1)CuO (2)复分解反应;硫酸。 (3)CuSO4+Fe=Cu+FeSO4 ; CuSO4+BaCl2=CuCl2+BaSO4↓。 三、实验与探究题(本大题共 2 题,20分) 16. (7 分) (1)无色酚酞变红色,分子的不断运动。 (2)湿润的紫色石蕊试纸变红色,干燥的紫色石蕊试纸无明显变化。H2O+CO2=H2CO3;二氧化碳的密度比空气大,主要从b管中通过。 17.(13 分) (1)过滤,搅拌。(2)除去炭粉。(3)<。(4)①B,D。 ② b ,量筒。 (5)① 与同体积同浓度的稀硫酸反应,含杂质的锌比纯锌反应速率要快。 ② a和d。 ③ 温度(或锌粒形状大小)。 四、计算与应用题(本大题共 1 题, 11 分) 18.(11 分)(1)解:依题意可得 氢气的质量=342.10g+16.00g-357.70g =0.4g 答:氢气的质量为0.4g (2)解:设该合金中锌的质量分数为x。 Zn + H2SO4=ZnSO4+H2↑ 65 2 16.00g×x 0.4g x=81.25% 答:该合金中锌的质量分数为81.25%查看更多