- 2021-06-23 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习氮及其化合物学案
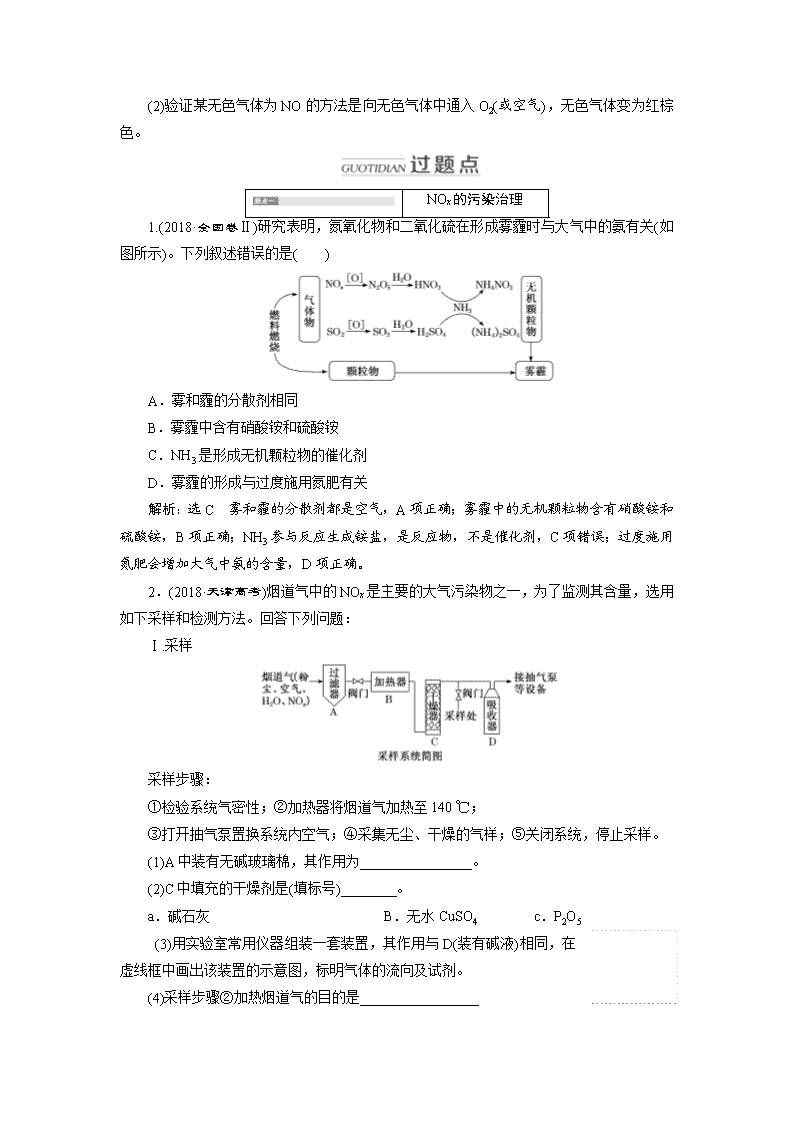
第四节 氮及其化合物 1.了解氮元素单质及其重要化合物的制备方法,掌握其主要性质及其应用。 2.了解氮元素单质及其重要化合物对环境的影响。 3.掌握氨气的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。 4.了解化学与生活、材料、能源、环境、生命、信息技术等的关系。 5.了解“绿色化学”的重要性。 考点(一) 氮及其氧化物 【点多面广精细研】 1.氮气的结构与性质 (1)氮元素的存在与氮的固定 (2)N2的物理性质 无色、无味气体,密度比空气略小,难溶于水。 (3)N2的化学性质 ①与氧气反应:N2+O22NO。 ②与氢气反应:N2+3H22NH3。 ③与镁反应:3Mg+N2Mg3N2。 2.氮的氧化物的种类与性质 (1)氮有多种价态的氧化物 如N2O、NO、NO2、N2O4、N2O3、N2O5等。其中属于硝酸酸酐的是N2O5。 (2)NO与NO2性质的比较 NO NO2 氮的价态 +2价 +4价 物理性质 无色、不溶于水的气体 红棕色、有刺激性气味的气体,易液化,易溶于水 化 学 性 与O2 反应 2NO+O2===2NO2 不反应 质 与H2O反应 不反应 3NO2+H2O===2HNO3+NO 与H2O、 O2反应 4NO+2H2O+3O2===4HNO3 4NO2+2H2O+O2===4HNO3 氧化性 有氧化性,但通常情况下表现出还原性 强氧化性,在溶液中能氧化S2-、I-、Fe2+等离子 对环境 的影响 有毒,大气污染物之一 有毒,大气污染物之一 实验室制取原理及收集方法 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O(排水法收集) Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O(向上排空气法收集) (3)氮氧化物对环境的污染 ①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。 ②酸雨:NOx排入大气中,与水反应生成HNO3和HNO2,随雨雪降到地面。 ③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。 ④NO与血红蛋白结合使人中毒。 [小题练微点] 判断下列说法的正误(正确的打“√”,错误的打“×”)。 (1)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化( ) (2)汽车尾气中的氮氧化合物是由游离态氮转化来的( ) (3)氮元素有负化合价、正化合价和零价,因而常温下,N2既能与氧气反应,又能与H2反应( ) (4)在实验室里,NO和NO2均用排水法收集( ) (5)可用NO2与水反应制取硝酸,故NO2是酸性氧化物( ) (6)通过灼热的镁粉,可除去N2中的少量氧气( ) (7)NO2溶于水时,NO2是氧化剂,水是还原剂( ) (8)溴蒸气和NO2都是红棕色气体,不能用湿润的淀粉KI试纸和NaOH溶液鉴别,可用AgNO3溶液或蒸馏水或CCl4鉴别( ) (9)(2016·全国卷Ⅰ)用向上排空气法收集铜粉与稀硝酸反应产生的NO( ) (10)(2015·全国卷Ⅰ)密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA( ) 答案:(1)√ (2)√ (3)× (4)× (5)× (6)× (7)× (8)√ (9)× (10)× [学霸微提醒] (1)氮的氧化物都有毒,其中NO2与N2O4存在下列平衡:2NO2N2O4,因此实验测得NO2的平均相对分子质量总大于46。 (2)验证某无色气体为NO的方法是向无色气体中通入O2(或空气),无色气体变为红棕色。 NOx的污染治理 1.(2018·全国卷Ⅱ)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是( ) A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 解析:选C 雾和霾的分散剂都是空气,A项正确;雾霾中的无机颗粒物含有硝酸铵和硫酸铵,B项正确;NH3参与反应生成铵盐,是反应物,不是催化剂,C项错误;过度施用氮肥会增加大气中氨的含量,D项正确。 2.(2018·天津高考)烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题: Ⅰ.采样 采样步骤: ①检验系统气密性;②加热器将烟道气加热至140 ℃; ③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。 (1)A中装有无碱玻璃棉,其作用为________________。 (2)C中填充的干燥剂是(填标号)________。 a.碱石灰 B.无水CuSO4 c.P2O5 (3)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。 (4)采样步骤②加热烟道气的目的是_________________ ________________________。 Ⅱ.NOx含量的测定 将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO,加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。 (5)NO被H2O2氧化为NO的离子方程式为______________________________________ ________________________________________________________________________。 (6)滴定操作使用的玻璃仪器主要有________________。 (7)滴定过程中发生下列反应: 3Fe2++NO+4H+===NO↑+3Fe3++2H2O Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O 则气样中NOx折合成NO2的含量为__________ mg·m-3。 (8)判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”)。 若缺少采样步骤③,会使测定结果________。 若FeSO4标准溶液部分变质,会使测定结果________。 解析:(1)装置A是过滤器,装有无碱玻璃棉的作用是过滤除去粉尘。(2)C中填充的是干燥剂,除去H2O且不能与NOx反应,所以应选有酸性、干燥能力强的P2O5。(3)D装置中装有碱液,用于除去NOx,作用与实验室中的洗气瓶相同,该装置的示意图见答案。(4)烟道气中有水,采样步骤②加热器将烟道气加热至140 ℃的目的是防止NOx溶于冷凝水。(5)NO被H2O2氧化为NO,H2O2的还原产物为H2O,离子方程式为2NO+3H2O2===2H++2NO+2H2O。(6)滴定操作使用的玻璃仪器主要有锥形瓶、滴定管,因为该滴定液呈酸性,所以选用酸式滴定管。(7)滴定过程中发生反应:3Fe2++NO+4H+===NO↑+3Fe3++2H2O、Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,与Cr2O反应的Fe2+的物质的量为6c2v2×10-3 mol,标准液中Fe2+的物质的量为c1v1×10-3 mol,则与NO反应的Fe2+的物质的量为(c1v1-6c2v2)×10-3mol,NO的物质的量为 mol,则v L气样中折合成NO2的含量为 mol×46 g·mol-1××1 000 mg·g-1×1 000 L·m-3=×104 mg·m-3。(8)若缺少采样步骤③,系统内存在空气,会使收集的气样中NOx偏少,测定结果偏低。若FeSO4标准溶液部分变质,溶液中的Fe2+浓度减小,消耗的K2Cr2O7标准溶液体积减小,使测定结果偏高。 答案:(1)除尘 (2)c (3) (4)防止NOx溶于冷凝水 (5)2NO+3H2O2===2H++2NO+2H2O (6)锥形瓶、酸式滴定管 (7)×104 (8)偏低 偏高 [方法规律] NOx尾气的处理 (1)碱液吸收法 2NO2+2NaOH===NaNO3+NaNO2+H2O, NO2+NO+2NaOH===2NaNO2+H2O, NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。一般适合工业尾气中NOx的处理。 (2)催化转化法 在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。反应方程式为 ①4NH3+6NO5N2+6H2O; ②8NH3+6NO27N2+12H2O; ③2NO+2CON2+2CO2; ④2NO2+4CON2+4CO2。 氮的氧化物与O2、H2O反应的计算 3.在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( ) ①1.2 mL ②2.4 mL ③3 mL ④4 mL A.①② B.②③ C.③④ D.①④ 解析:选D 混合气体通入水中,涉及的反应有①4NO2+O2+2H2O===4HNO3,②3NO2+H2O===2HNO3+NO。若12 mL全部为NO2,发生反应②,剩余气体4 mL大于实际剩余气体2 mL,故剩余气体为NO或O2。若剩余的气体是O2,则V(NO2)=×(12-2)mL=8 mL,V(O2)=12 mL-8 mL=4 mL。若剩余的气体是NO(2 mL)⇒6 mL NO2,则V(O2)=×(12-6)mL=1.2 mL。 4.(2019·石家庄二中模拟)将充有m mol NO和n mol NO2 气体的试管倒立于水槽中,然后通入m mol O2,若已知n>m,则充分反应后,试管中的气体在同温同压下的体积为( ) A. B. C. D.3(n-m) 解析:选B 根据3NO2+H2O===2HNO3+NO知,n mol NO2气体反应后生成 mol NO气体,再根据4NO+3O2+2H2O===4HNO3得∶m>4∶3,则知NO过量,故剩余的体积为-=。 5.氮氧化合物(用NOx表示)是大气污染的重要因素,根据NOx的性质特点,开发出多种化学治理氮氧化合物污染的方法。 (1)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO5N2+6H2O,8NH3+6NO27N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是__________。 (2)工业尾气中氮的氧化物常采用碱液吸收法处理。 ①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:____________________________________________________________________。 ②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是___________________________________________________。 解析:(1)设NO的体积为V(NO),NO2的体积为V(NO2),依据方程式知,处理NO需NH3:V(NO),处理NO2需NH3:V(NO2),则,解得V(NO)=0.75 L,V(NO2)=2.25 L,V(NO)∶V(NO2)=1∶3。(2)①生成两种钠盐,必然是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。②NO中氮的化合价为+2价,NO2中氮的化合价为+4价,二者1∶1 混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。 答案:(1)1∶3 (2)①2NO2+2NaOH===NaNO3+NaNO2+H2O ②NaNO2 [方法规律] 氮的氧化物与O2、H2O反应的3种计算方法 1.关系式法 (1)NO和O2混合气体通入水中 由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3。 (2)NO2和O2混合气体通入水中 由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3。 (3)NO、NO2和O2三种混合气体通入水中 先按3NO2+H2O===2HNO3+NO计算出生成的NO体积,然后加上原来混合气体中NO体积,再按①计算。 2.电子守恒法 当NOx转化为硝酸时要失去电子,如果是NOx与O2混合,则反应中O2得到的电子数与NOx失去的电子数相等。 3.原子守恒法 4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O===2HNO3等效。当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。 1.我国“神舟 11 号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体成分有 CO2、H2O、N2、NO 等,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量“红烟”,产生“红烟”的原因是( ) A.“红烟”是 Fe2O3 B.NO 与 H2O 反应生成 C.CO2 与 NO 反应生成 NO2 D.NO 遇空气生成 NO2 巧用平衡思想理解NO2气体存在形式 2NO2N2O4 ΔH<0 ①NO2能使湿润的淀粉KI试纸变蓝。 ②1 mol NO2在标准状况下的体积应小于22.4 L。 ③标准状况下,22.4 L NO2的质量大于46 g。 解析:选D 引燃后的高温气体成分有CO2、H2O、N2、NO等无色气体中,NO容易被O2氧化为NO2,NO2是红棕色气体。 2.如图所示,将相同条件下的m体积NO和n体积O2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留 体积的气体,该气体与空气接触后立即变为红棕色。则m与n的比值为( ) A.3∶2 B.2∶3 C.8∶3 D.3∶8 掌握氮的氧化物的相关计算 ①计算剩余气体体积。 ②溶液的浓度,在计算时一般设容器的体积为V L,通过反应方程式计算剩余气体体积、溶液的浓度。 解析:选C 该过程中涉及的反应有2NO+O2===2NO2、3NO2+H2O===2HNO3+NO,可将两个方程式“合并”为4NO+3O2+2H2O===4HNO3。剩余气体与空气接触立即变为红棕色,说明剩余气体为NO。则可知 体积的NO气体与n体积的O2恰好完全反应。 4NO+3O2+2H2O===4HNO3 4 3 n 4∶=3∶n,解得m∶n=8∶3。 考点(二) 氨和铵盐 【点多面广精细研】 1.氨的物理性质与喷泉实验 (1)物理性质 无色有刺激性气味的气体,密度比空气小,易液化。极易溶于水(1∶700),可由喷泉实验证明。 (2)喷泉实验 ①喷泉实验的原理 因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。 ②常见的能形成喷泉实验的气体和吸收剂如表: 气体 HCl NH3 CO2、SO2、Cl2、H2S NO2+O2 吸收剂 水或NaOH溶液 水或盐酸 浓NaOH溶液 水 2.氨的化学性质 (1)与水反应 反应原理为NH3+H2ONH3·H2ONH+OH-。氨气溶于水得氨水,氨水中含有的粒子有:NH3·H2O、H2O、NH3、NH、OH-、H+。NH3·H2O为可溶性一元弱碱,不稳定,易分解,化学方程式为NH3·H2ONH3↑+H2O。 (2)氨气与酸的反应 蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为有白烟生成,将浓盐酸改为浓硝酸,也会出现相同的现象。化学方程式为HCl+NH3===NH4Cl、NH3+HNO3===NH4NO3。 (3)与盐溶液的反应 过量氨水与AlCl3溶液反应的离子方程式: Al3++3NH3·H2O===Al(OH)3↓+3NH。 (4)氨气的还原性 ①催化氧化:4NH3+5O24NO+6H2O。 ②被CuO氧化:2NH3+3CuO3Cu+N2+3H2O。 ③被氯气氧化:2NH3+3Cl2===N2+6HCl或8NH3+3Cl2===N2+6NH4Cl。 (5)氨的用途 ①液氨汽化时吸收大量的热,故用作制冷剂。 ②制氮肥、硝酸、铵盐、纯碱等。 3.氨气的实验室制法 4.铵盐及NH的检验 (1)铵盐的物理性质 铵盐都是白色固体,均易溶于水。 (2)铵盐的化学性质 (3)NH的检验 未知液产生使湿润的红色石蕊试纸变蓝色的气体,则证明含NH。 [小题练微点] 判断下列说法的正误(正确的打“√”,错误的打“×”)。 (1)氨易液化,因此可用来作制冷剂( ) (2)氨溶解于水显弱碱性,因此可使酚酞溶液变为红色( ) (3)氨气遇到浓盐酸、硫酸都会发生反应,产生白烟( ) (4)实验室可用浓氨水与生石灰制取氨气( ) (5)加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华( ) (6)氨水中含氮微粒中最多的微粒是NH( ) (7)铵盐都易溶于水,其水溶液均呈酸性( ) (8)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效( ) (9)向某无色溶液中加入稀NaOH溶液,把湿润的红色石蕊试纸放在试管口,不变蓝,则原溶液中不含NH( ) (10)NH4H的结构与NH4Cl相似,NH4H固体与少量H2O反应可有两种气体生成( ) (11)用浓NH4Cl溶液处理过的舞台幕布不易着火是因为NH4Cl隔绝了空气( ) (12)现有1 mol·L-1的氨水,则该溶液中NH3·H2O的浓度是1 mol·L-1( ) 答案:(1)√ (2)√ (3)× (4)√ (5)× (6)× (7)× (8)√ (9)× (10)√ (11)× (12)× [学霸微提醒] (1)极易溶于水的气体有NH3(1∶700)、HCl(1∶500)。 (2)NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。 (3)氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。 氨气的制备和性质 1.判断下列说法的正误(正确的打“√”,错误的打“×”)。 (1)(2018·江苏高考)NH4Cl与Ca(OH)2混合加热可生成NH3( ) (2)(2017·全国卷Ⅱ)加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝,说明NH4HCO3显碱性( ) (3)(2017·天津高考)用烧碱处理含高浓度NH的废水并回收利用氨( ) (4)(2017·北京高考)氨气使AlCl3溶液产生白色沉淀,氨气发生还原反应( ) (5)(2017·江苏高考)利用NH3易溶于水的性质,可用作制冷剂( ) (6)(2016·江苏高考)下列物质间的转化能够实现N2NH3NH4Cl(aq)( ) (7)(2016·上海高考)用生石灰与浓氨水制得的气体能使湿润的红色石蕊试纸变蓝,说明NH3为碱性气体( ) (8)(2015·重庆高考)实验室用如图所示装置制取氨( ) 答案:(1)√ (2)× (3)√ (4)× (5)× (6)√ (7)√ (8)× 2.(2016·全国卷Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题: (1)氨气的制备 ①氨气的发生装置可以选择上图中的________,反应的化学方程式为________________________________________________________________________。 ②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。 (2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。 操作步骤 实验现象 解释原因 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 ①Y管中_______________________________________________ ②反应的化学方程式_______________________________________________ 将注射器活塞退回原处并固定,待装置恢复到室温 Y管中有少量水珠 生成的气态水凝聚 打开K2 ③________________________________________________ ④________________________________________________ 解析:(1)①图中给出了两种气体制备装置,一种是固固加热制气装置,一种是固液加热制气装置。如果选择A装置制取氨气,则反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;如果选择B装置制取氨气,则反应的化学方程式为NH3·H2ONH3↑+H2O。②欲收集一瓶干燥的氨气,首先要除去杂质,制备氨气的杂质只有水蒸气,由于氨气溶于水显碱性,因此要选用碱石灰作干燥剂,干燥管的进出口方向为粗进细出,因此先接d后接c;其次要收集氨气,由于氨气的密度小于空气,要从短管进气,因此先接f再接e;最后要进行尾气处理,由于氨气极易溶于水,因此可以选择水吸收尾气,还要注意防倒吸,所以接i。(2)由题干内容“工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2”,结合实验条件可知反应为8NH3+6NO27N2+12H2O,NO2为红棕色气体,发生反应后变成无色气体,因此现象为红棕色气体逐渐变浅。反应后气体分子数减少,Y管中的压强小于外压,因此产生倒吸现象。 答案:(1)①A 2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O(或B NH3·H2ONH3↑+H2O) ②dcfei (2)①红棕色气体慢慢变浅 ②8NH3+6NO27N2+12H2O ③Z中NaOH溶液产生倒吸现象 ④反应后气体分子数减少,Y管中压强小于外压 [易错提醒] 实验室制氨气的注意事项 (1)制氨时铵盐不选(NH4)2CO3、NH4HCO3、NH4NO3等,因为它们受热易分解,使产生的NH3中混有较多的杂质气体,另外NH4NO3易爆炸;选碱时,用Ca(OH)2而不用NaOH或KOH,因为NaOH、KOH具有吸湿性,易结块,不利于产生氨,且在高温下均能腐蚀玻璃。 (2)干燥氨气不能用浓硫酸,也不能用无水CaCl2(8NH3+CaCl2===CaCl2·8NH3),通常用碱石灰干燥氨气。 (3)实验室制取NH3的简易方法 方法 化学方程式(或原理) 发生装置 加热浓氨水 NH3·H2ONH3↑+H2O 浓氨水+ 固体NaOH NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大有利于NH3的生成 浓氨水+ 固体CaO CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解。化学方程式:NH3·H2O+CaO===NH3↑+Ca(OH)2 喷泉实验的原理 3.(2019·南京师大附中检测) 利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。 (1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是________________________________________________________________________ ________________________________________________________________________。 (2)若先打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是 ________________________________________________________________________。 (3)通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________________________________________。 若要在该装置中产生双喷泉现象,其操作方法是______________________________ ________________________________________________________________________。 解析:(1)打开a、b活塞,再将胶头滴管中的水挤入烧瓶Ⅱ中,由于NH3极易溶于水,使烧瓶内气体压强迅速减小,烧杯中的水迅速进入烧瓶Ⅱ中,形成喷泉。(2)先打开a、c活塞,再将胶头滴管中的水挤入烧瓶Ⅱ中,烧瓶Ⅱ中的气压迅速减小,烧瓶Ⅰ中的HCl气体会流向烧瓶Ⅱ中,且与NH3化合生成NH4Cl而产生白烟。(3)在(2)基础上,若关闭a活塞,打开b活塞,烧杯中的水会迅速进入烧瓶Ⅰ中,形成喷泉;若打开b活塞,不关闭a活塞,烧瓶中的水便会同时进入烧瓶Ⅰ和Ⅱ中,形成双喷泉。 答案:(1)先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞) (2)烧瓶Ⅱ中导管口处产生白烟 (3)先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,关闭a活塞,然后打开b活塞 先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,打开b活塞 4.(2017·全国卷Ⅰ节选)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3===NH3·H3BO3;NH3·H3BO3+HCl===NH4Cl+H3BO3。 回答下列问题: (1)a的作用是________________。 (2)b中放入少量碎瓷片的目的是_____________________________________________。 f的名称是________。 (3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是___________________________________________; 打开k2放掉水。重复操作2~3次。 解析: (1)导管a与大气相通,其作用是避免烧瓶内气压过大,发生危险。(2)加热液体时加入碎瓷片,其作用是防止液体暴沸。冷凝管有直形冷凝管和球形冷凝管、蛇形冷凝管,要指明。(3)停止加热,瓶内水蒸气冷凝,气体压强减小,会引起g中液体倒吸入c中,利用蒸馏水倒吸来洗涤仪器e、f。 答案:(1)避免b中压强过大 (2)防止暴沸 直形冷凝管 (3)c中温度下降,管路中形成负压 归纳拓展 1.喷泉实验的原理分析 (1)形成喷泉的原因 形成喷泉最根本的原因是烧瓶内外存在压强差。当烧瓶内气体溶于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内,如此持续,最后液体将充满烧瓶。 (2)影响喷泉实验成功的因素 ①盛气体的烧瓶必须干燥。②气体要充满烧瓶。③烧瓶不能漏气(实验前应先检查装置的气密性)。④所用气体能大量溶于所用液体或气体与液体可以快速反应。 2.喷泉实验的发散装置及操作方法 喷泉实验是中学化学的重要实验,其本质是形成压强差而引发液体上喷,以教材中的装置(发散源)可设计如图所示的多种不同的装置和采用不同的操作(如使气体溶于水、热敷或冷敷、生成气体等)来形成喷泉。 设计说明:装置(Ⅰ)改变了胶头滴管的位置,胶头滴管挤入少量水于试剂瓶中,即可使少量溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。装置(Ⅱ)向导管中通入一定量的H2S和SO2,现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液上喷形成喷泉。装置(Ⅲ)打开①处的止水夹并向烧瓶中缓慢通入等体积的HCl气体后关闭该止水夹,等充分反应后再打开②处的止水夹,观察到先有白烟产生,后产生喷泉。装置(Ⅳ)挤压胶头滴管,然后打开导管上部的两个活塞,则在右面烧瓶出现喷烟现象,再打开导管下部活塞,则可产生双喷泉。 1.如图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。表中对实验现象所做的解释正确的是( ) 选项 实验现象 解释 A 浓盐酸附近产生白烟 NH3与浓盐酸反应产生了NH4Cl固体 B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应 C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液 D 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 NH3是一种可溶性碱 解析:选A B项,NH3与浓硫酸反应;C项,AlCl3、MgCl2等氯化物溶液均可与NH3反应使溶液变浑浊;D项,NH3·H2O是碱,NH3不属于碱。 2.如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( ) A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹 B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹 理清喷泉实验原理 烧瓶中气压减小,形成喷泉,类型是极易溶于水的气体,如NO2、NH3,或者气体与溶液极易反应,如Cl2~NaOH溶液,CO2~NaOH溶液。 解析:选B H2难溶于NaOH溶液,不能形成较大压强差,不能引发“喷泉”现象。 3.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列说法正确的是( ) A.NH4Cl和NaHCO3都是常用的化肥 B.NH4Cl、HNO3和Na2CO3受热时都易分解 C.在一定条件下可发生氧化还原反应 D.图中所涉及的盐类物质都属于正盐 点拨:NH3中N的化合价为-3价,NO2中N的化合价为+4 价。 解析:选C NaHCO3不是化肥,故A错误;NH4Cl、HNO3受热时都易分解,Na2CO3性质稳定,受热不分解,故B错误;NH3和NO2中氮元素存在中间价态,一定条件下可发生氧化还原反应,故C正确;NaHCO3为酸式盐,故D错误。 4.下列说法中正确的是( ) A.所有铵盐受热均可以分解,产物均有NH3 B.硝酸铵受热易分解爆炸,实验室常用加热氯化铵与氢氧化钙的固体混合物制备氨气 C.在盛有硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的试管中,滴加少量NaOH溶液,在试管口用湿润的红色石蕊试纸检验,试纸变蓝 D.铵盐都易溶于水,其水溶液均呈酸性 解析:选B 铵盐分解不一定产生NH3,如NH4NO3在400 ℃以上分解生成N2、NO2和H2O,A项错;Fe2+比NH更易结合OH-,因而加入少量NaOH,不会产生NH3,C项错;NH4HCO3、(NH4)2S溶液等均呈碱性,D项错。 5.NH3及其盐都是重要的化工原料。 (1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。 (2)按如图装置进行NH3性质实验。 ①先打开旋塞1,B瓶中的现象是____________________,原因是_____________________ _____________________________________________,稳定后,关闭旋塞1。 ②再打开旋塞2,B瓶中的现象是______________________________________________。 解析:(1)制备氨气时,加热固体的试管口应略向下倾斜,所以制备装置应选取装置A;氨气的密度比空气的小,因此应用向下排空气法收集,所以收集装置应选取装置C;氨气极易溶于水,应防止发生倒吸,因此尾气处理装置应选取装置G。(2)A瓶的压强大于B瓶的,因此A瓶中的氯化氢进入B瓶中,与氨气反应生成氯化铵,可以看到B瓶中有白烟生成。由于氯化氢和氨气反应导致B瓶中的压强降低,且B瓶中的氯化氢相对过量,因此当打开旋塞2时,石蕊水溶液会被倒吸入B瓶中,遇氯化氢溶液变红色。 答案:(1)A、C、G (2)①有白烟生成 A瓶中的氯化氢移动到B瓶中,与B瓶中的氨气反应生成氯化铵,能看到白烟 ②液体进入B瓶中,溶液的颜色变红 考点(三) 硝酸 【精讲精练快冲关】 [知能学通] 1.物理性质 硝酸是无色易挥发的液体,有刺激性气味。 2.化学性质 (1)不稳定性 反应的化学方程式: 4HNO32H2O+4NO2↑+O2↑。 (2)强氧化性 浓、稀硝酸均具有强氧化性,浓度越大,氧化性越强,其还原产物的价态越高。还原产物一般为HNO3(浓)―→NO2,HNO3(稀)―→NO。 与金属 反应 稀硝酸与铜反应的化学方程式: 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O 浓硝酸与铜反应的化学方程式: Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 与非金 属反应 浓硝酸与C反应的化学方程式: C+4HNO3(浓)CO2↑+4NO2↑+2H2O 与还原 性化合 物反应 硝酸可氧化Fe2+、H2S、SO2、Na2SO3、HI等还原性物质。如稀硝酸与FeSO4溶液反应的离子方程式: 3Fe2++4H++NO===3Fe3++NO↑+2H2O (3)与有机物反应 ①硝化反应(与苯反应): 。 ②颜色反应:含苯基的蛋白质遇到浓硝酸时变黄色。 3.硝酸工业制法的反应原理 (1)NH3在催化剂作用下与O2反应生成NO: 4NH3+5O24NO+6H2O。 (2)NO进一步氧化生成NO2:2NO+O2===2NO2。 (3)用水吸收NO2生成HNO3: 3NO2+H2O===2HNO3+NO。 [注意] ①硝酸与变价金属反应,金属被氧化为高价态。 ②硝酸浓度越大,其还原产物的价态越高。还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO,很稀的硝酸还原产物也可能为N2O、N2或NH4NO3。 ③硝酸与金属反应,体现硝酸的强氧化性和酸性,浓硝酸与非金属反应只体现氧化性。 ④浓硝酸能使紫色石蕊溶液先变红,后褪色,该反应过程中浓硝酸表现出强酸性和强氧化性。 ⑤在酸性条件下NO不能与Fe2+、I-、SO、S2-等还原性较强的离子大量共存。 ⑥常温下,铁、铝遇浓硝酸能发生“钝化”,并非不反应,故浓硝酸可以用铁桶或铝桶盛放。 [题点练通] 硝酸的性质 1.判断下列说法的正误(正确的打“√”,错误的打“×”)。 (1)(2018·北京高考) 热铜丝插入稀硝酸中,产生无色气体,随后变为红棕色,颜色变化与氧化还原反应无关( ) (2)(2016·全国卷Ⅰ)用向上排空气法收集铜粉与稀硝酸反应产生的NO( ) (3)(2016·全国卷Ⅰ)1 mol Fe溶于过量硝酸,电子转移数为2NA( ) (4)(2016·江苏高考)将铜丝插入稀硝酸中:Cu+4H++2NO===Cu2++2NO2↑+H2O( ) (5)(2016·海南高考)将铁屑放入稀HNO3中证明Fe比H2活泼( ) (6)(2015·全国卷Ⅱ)常温下,将浓硝酸滴加到用砂纸打磨过的铝条上,会产生红棕色气体( ) 答案:(1)× (2)× (3)× (4)× (5)× (6)× 2.(2017·北京高考)下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( ) ① ② ③ A.由①中的红棕色气体,推断产生的气体一定是混合气体 B.红棕色气体不能表明②中木炭与浓硝酸发生了反应 C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 解析:选D ①中灼热碎玻璃起加热作用,浓硝酸受热分解生成红棕色NO2,硝酸中氮元素化合价降低,必有元素化合价升高,只能为氧元素,因此,还有O2生成,产生的气体为混合气体,A项正确;由①可知,浓硝酸受热分解可生成红棕色气体,所以②中产生的“红棕色气体”不一定是木炭与浓硝酸发生反应产生的,B项正确;③中浓硝酸挥发才能与红热木炭接触,产生的NO2是还原产物,C项正确;红热的木炭还可与空气中的O2反应生成CO2,不一定是木炭与浓硝酸发生反应生成了CO2,D项错误。 3.(2019·门头沟区模拟)室温下,某兴趣小组用如图装置在通风橱中进行如下实验: 实验 现象 试管Ⅰ中开始无现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色 试管Ⅱ中剧烈反应,迅速生成大量红棕色气体,溶液呈绿色;之后向绿色溶液中持续通入N2,溶液变为蓝色 下列说法正确的是( ) A.试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成 B.等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更多 C.换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈 D.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2 解析:选D 试管Ⅰ中浅红棕色气体为NO2,是由硝酸还原生成的NO与空气中O2反应生成,故A错误;依据Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O可知,等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更少,故B错误;换成Fe之后重复实验,铁与浓硝酸发生钝化生成致密氧化膜,阻止反应进行,故C错误;铜与浓硝酸反应生成红棕色NO2,试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2,持续通入N2后,溶液变为蓝色,是因为N2把NO2从溶液中带出,故D正确。 4.某化学兴趣小组设计了如图所示的浓HNO3 与Cu反应的微型实验。下列说法中错误的是( ) A.挤压塑料瓶使浓HNO3进入干燥管就可引发反应 B.将装置口向上竖起就可停止反应 C.蘸碱液的棉花可起到吸收NO2的作用 D.该装置适用于木炭与浓硝酸或浓硫酸的反应实验 解析:选D 挤压塑料瓶能使浓硝酸进入干燥管与铜接触,引发反应,故A正确;只需将装置口向上竖起,浓硝酸回流到塑料瓶,而铜片不能进入塑料瓶,可以停止反应,故B正确;二氧化氮与碱反应生成亚硝酸盐和硝酸盐,所以蘸碱液的棉花可起到吸收NO2的作用,故C正确;该装置适用于块状固体和液体反应,且不需要加热的气体的制备,而木炭与浓硫酸和浓硝酸都要加热才反应,故D错误。 5.(2019·尖山区模拟)在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3。铜粉溶解的是( ) A.只有①或② B.只有②或④ C.只有①或②或③ D.①②③④中任意一种 解析:选D ①Cu能和FeCl3反应生成FeCl2和CuCl2,所以Cu能在FeCl3溶液中溶解,正确; ②Fe2O3能与稀H2SO4反应:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu===2FeSO4+CuSO4,所以铜粉溶解,正确;③加入Cu(NO3)2后,溶液中含有H+和NO,所以相当于溶液中含有HNO3,HNO3能和Cu反应,3Cu+8H++2NO===3Cu2++2NO↑+4H2O,所以铜粉溶解,正确;④依据③的分析可知,加入KNO3,相当于加入NO,也与硫酸中的H+构成HNO3致使Cu溶解,正确。 硝酸与金属的反应 6.(2019·福州模拟)将19.2 g的铜和某浓度的硝酸反应,生成8.96 L(标准状况)的气体,则参加反应的硝酸为______mol,将这8.96 L的气体和标准状况下________L的氧气混合,再通入水中没有气体剩余。 解析:因N原子守恒,所以参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2 )=2n(Cu)+n(NO)+n(NO2)=×2+=1 mol;因产生的气体和氧气最终变为硝酸,在上述两个过程中只有两种元素铜、氧的化合价发生变化,根据电子得失守恒,则n(O2)×4=n(Cu)×2,即n(O2)=n(Cu)×=×=0.15 mol,体积为3.36 L。 答案:1 3.36 7.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题: (1)NO的体积为________L,NO2的体积为________L。 (2)参加反应的HNO3的物质的量是______________。 (3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为____________mol·L-1。 (4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水____________g。 解析:(1)n(Cu)==0.51 mol,设混合气体中NO的物质的量为x,NO2的物质的量为y。根据气体的总体积为11.2 L,有:x+y=0.5 mol。根据得失电子守恒,有:3x+y=(0.51×2)mol。解方程组得:x=0.26 mol,y=0.24 mol。则:V(NO)=0.26 mol×22.4 L·mol-1=5.824 L, V(NO2)=11.2 L-5.824 L=5.376 L。(2)参加反应的HNO3分两部分:一部分没有被还原,显酸性,生成Cu(NO3)2;另一部分被还原成NO2和NO,所以参加反应的HNO3的物质的量为0.51 mol×2+0.5 mol=1.52 mol。(3)HNO3在反应中一部分变成气体,一部分以NO的形式留在溶液中。变成气体的HNO3的物质的量为0.5 mol。加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aV mol,也就是以NO形式留在溶液中的HNO3的物质的量为10-3aV mol。所以,c(HNO3)= mol·L-1。(4)由得失电子守恒得:2×n(Cu)=2×n(H2O2),×2=n(H2O2)×2,n(H2O2)=0.51 mol,则m(H2O2)=17.34 g。需30%的双氧水:17.34 g÷30%=57.8 g。 答案:(1)5.824 5.376 (2)1.52 mol (3) (4)57.8 硝酸与金属反应的计算方法 (1)原子守恒法 HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂,转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3 中氮原子的物质的量。 (2)得失电子守恒法 HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。 (3)电荷守恒法 HNO3过量时反应后溶液中(不考虑OH-)有: c(NO)=c(H+)+nc(Mn+)(Mn+代表金属离子)。 (4)离子方程式计算法 金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO进行相关计算,且溶液中要符合电荷守恒。 考点(四) 磷及其化合物 【精讲精练快冲关】 [知能学通] 1.磷单质 (1)磷的同素异形体 白磷不溶于水,易溶于CS2,分子式为P4,为正四面体结构(),与红磷(赤磷)是同素异形体。 (2)单质磷的化学性质 ①与氧气反应:P4+5O22P2O5(五氧化二磷)。 ②与卤素单质反应: P4+6Cl24PCl3(白雾),P4+10Cl24PCl5(白烟)。 ③与稀硝酸反应: 3P+5HNO3+2H2O3H3PO4+5NO↑。 2.五氧化二磷和磷化氢 五氧化二磷是磷酸的酸酐,有很强的吸水性,是一种干燥剂。磷化氢的化学式为PH3,碱性比氨气弱得多,强还原剂。 3.磷酸 磷酸易溶于水、难挥发,属于三元非氧化性中强酸(可当作弱酸对待),具有酸的通性。 (1)电离方程式 H3PO4H++H2PO,H2POH++HPO,HPOH++PO。 (2)与碱反应 NaOH+H3PO4===NaH2PO4+H2O(生成磷酸二氢盐), 2NaOH+H3PO4===Na2HPO4+2H2O(生成磷酸氢盐), 3NaOH+H3PO4===Na3PO4+3H2O(生成正盐)。 [题点练通] 1.(2019·黄冈模拟)砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是( ) A.黄砷中共价键键能大于白磷 B.黄砷的熔点高于白磷 C.黄砷易溶于水 D.分子中共价键键角均为109.5° 解析:选B 原子半径:As>P,键长越大键能越小,则黄砷中共价键键能小于白磷,故A错误;相对分子质量越大,分子间作用力越强,熔点越高,则黄砷的熔点高于白磷,故B正确;黄砷为非极性分子,水为极性溶剂,根据相似相溶原理,黄砷不易溶于水,故C错误;P4、As4都为正四面体结构,As、P原子位于正四面体的顶点上,分子中共价键键角均为60°,故D错误。 2.PH3是一种无色剧毒气体。下列判断错误的是( ) A.PH3分子是非极性分子 B.PH3分子中有一对孤电子对 C.PH3分子形状为三角锥形 D.PH3分子稳定性低于 NH3分子 解析:选A PH3分子结构是三角锥形,正负电荷重心不重合,为极性分子,故A错误,C正确;PH3分子结构和 NH3相似,中心原子都含有一个孤电子对,故B正确;共价键键长越短,键能越大,分子越稳定,P的原子半径比N大,则N—H键键长更短、键能更高,所以PH3分子稳定性低于NH3分子,故D正确。 3.磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。 (1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(1 550 ℃)下通过下面三个反应共熔得到。 a.4Ca3(PO4)2(s)+10C(s)===12CaO(s)+2P4(s)+10CO2(g) b.CaO(s)+SiO2(s)===CaSiO3(s) c.CO2(g)+C(s)===2CO(g) 已知:CaSiO3的熔点(1 546 ℃)比SiO2低。 ①写出由Ca3(PO4)2、焦炭和SiO2在电炉中高温(1 550 ℃)制取白磷总的化学反应方程式________________________________________________________________________ ________________________________________________________________________。 ②白磷(P4)是正四面体结构,请画出白磷(P4)的结构式_____________,并指出1 mol白磷(P4)含有P—P键的数目_____________。 (2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体____________(写化学式)。 (3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在_________之间 (已知磷酸的各级电离常数为K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 ,lg 7.1≈0.9 lg 6.3≈0.8 lg 4.2≈0.6)。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是__________________________________________________(用离子方程式表示)。 解析:(1)①根据已知反应,结合热化学方程式和盖斯定律得到总反应的化学方程式为2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4+10CO。②白磷(P4)是正四面体结构,P—P间形成共价键,白磷(P4)的结构式为,1 mol白磷(P4)含有P—P键的数目为6NA。(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体,磷元素升高为次磷酸盐,磷元素化合价为+1价,降低的只能为负价,则为氢化物PH3。(3)为获得尽可能纯的NaH2PO4,需配制磷酸、磷酸二氢钠的缓冲溶液,当溶液全部为磷酸溶液时,磷酸以第一步电离为主,所以H3PO4H++H2PO K1=7.1×10-3;pH=-lg c(H+)=3-lg 7.1≈2.1,当溶液全部为NaH2PO4溶液时,H2POH++HPO K2=6.3×10-8,所以pH=-lg c(H+)=8-lg 6.3≈7.2,所以pH应控制介于2.1~7.2之间;HPO既能发生电离又能发生水解,电离反应式为HPOPO+H+,水解反应式为HPO+H2OH2PO+OH-,溶液呈碱性,说明水解程度大于电离程度;由于HPO和Ca2+反应生成沉淀:3Ca2++2HPO===Ca3(PO4)2↓+2H+,促进HPO的电离,溶液则显酸性。 答案:(1)①2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4+10CO ② 6NA (2)PH3 (3)2.1~7.2 3Ca2++2HPO===Ca3(PO4 )2↓+2H+ 考点(五) 常见无机物的转化关系 【多角探明无盲点】 无机推断题作为一种传统的高考题型,重点考查学生对元素及其化合物主干知识的掌握情况,题目结构紧凑,文字表述少,但转化关系中包含信息多,综合性强,难度较大。解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。 抓住“物质颜色”作为突破口 有色固体 ①红色:Cu、Cu2O、Fe2O3; ②红褐色:Fe(OH)3; ③黄色:AgI; ④淡黄色:S、Na2O2、AgBr; ⑤蓝色:Cu(OH)2; ⑥黑色:炭粉、CuO、MnO2、FeS、CuS; ⑦紫黑色:KMnO4、I2; ⑧白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3 有色溶液 Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO(紫红色)、Fe3+遇 SCN-(血红色)、I2遇淀粉(蓝色)、Fe3+遇苯酚(紫色)等 有色气体 Cl2(黄绿色)、Br2(g)、NO2(红棕色)、I2(g)(紫色)、O3(淡蓝色)等 火焰颜色 ①焰色反应:Na+(黄色)、K+(紫色,透过蓝色钴玻璃)等; ②蓝色:CO在空气中燃烧; ③淡蓝色:S、H2、CH4等在空气中燃烧; ④苍白色:H2在Cl2中燃烧 [对点练] 1.有一化合物X,其水溶液为浅绿色,可发生如图的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。 请回答下列问题: (1)B的电子式为____________。 (2)画出元素M的原子结构示意图____________________________________________。 (3)物质X的化学式为____________。 (4)电解混合液时阳极反应式为________________________________________________。 (5)按要求写出上述转化关系中有关反应的化学方程式: ①含有L元素的化合反应:___________________________________________________; ②含有L元素的置换反应:___________________________________________________。 解析:由颜色可知C为Fe(OH)3,则A为Fe(OH)2、H为Fe2O3,由M、L为常见的金属单质,可知M、L分别为Al、Fe;X与NaOH反应生成气体B,B一定是NH3;在混合液中加入BaCl2溶液有不溶于盐酸的沉淀生成,可知含有SO,所以X为(NH4)2Fe(SO4)2,混合液为NaOH和Na2SO4溶液,电解生成H2、O2,D、E分别为O2、H2,F为NO,G为HNO3。 答案:(1) (2) (3)(NH4)2Fe(SO4)2 (4)4OH--4e-===O2↑+2H2O (5)①4Fe(OH)2+O2+2H2O===4Fe(OH)3 ②Fe2O3+2Al2Fe+Al2O3 抓住“物质特性”作为突破口 (1)能使品红溶液褪色的气体 SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。 (2)沉淀发生特殊的颜色变化 Fe(OH)2Fe(OH)3(白色沉淀先变灰绿色,再变红褐色)。 (3)在空气中变为红棕色 NO(无色)NO2(红棕色)。 (4)能使澄清石灰水变浑浊的气体:CO2、SO2。 (5)通入CO2气体变浑浊的溶液:澄清石灰水(过量则变澄清)、Na2SiO3溶液、饱和Na2CO3溶液。 (6)使湿润的红色石蕊试纸变蓝的气体:NH3。 (7)使湿润的淀粉KI试纸变蓝的物质:NO2、Cl2、Br2、FeCl3等。 (8)常温下能溶解SiO2固体的物质:氢氟酸和NaOH溶液。 (9)烟雾现象 棕(黄)色的烟 Cu或Fe在Cl2中燃烧 白烟 Na在Cl2中燃烧;NH3遇到浓盐酸或浓硝酸 白雾 由HX等极易溶于水的气体产生 (10)钝化现象:常温下Fe、Al遇到浓硫酸或浓硝酸会生成一层致密的氧化膜,从而保护金属不再发生反应。 [对点练] 2.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如图实验: 另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题: (1)画出白色沉淀1中金属元素的原子结构示意图______,写出气体甲的电子式____________。 (2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________。 (3)白色沉淀2在空气中变成红褐色沉淀的原因是________________(用化学反应方程式表示)。 (4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_______________________________________________________ ________________________________________________________________________, 并设计实验方案验证该反应的产物___________________________________________ ________________________________________________________________________ ________________________________________________________________________。 解析:从框图可知,气体甲为CO2 ;由溶液1转变为白色沉淀1,白色沉淀1又能溶解在CO2水溶液中,可推断白色沉淀1为CaCO3;从固体2的转化过程可知,白色沉淀2为Fe(OH)2,最终的红褐色沉淀为Fe(OH)3;由上述推断可初步确定X为含有Ca、Fe元素的碳酸盐,且其中铁元素的化合价为+2,故可推断其为CaFe(CO3)2,分解得到的固体1为CaO与FeO的混合物,应用题给数据可以进一步确认上述判断的正确性。(1)白色沉淀1中的金属元素为钙,其原子结构示意图为,气体甲为CO2,其电子式为。(2)X的化学式为CaFe(CO3)2;在惰性气流中加热X至完全分解的化学反应方程式为CaFe(CO3)2CaO+FeO+2CO2↑。(3)白色沉淀2在空气中变成红褐色沉淀是因为Fe(OH)2被氧化成Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。(4)CO2气体与固体1中的FeO可能发生氧化还原反应,反应方程式为2FeO+CO2Fe2O3+CO;检验产物的方法:取反应所得固体物质,加稀盐酸溶解,然后加入KSCN溶液,若溶液呈红色,说明反应产物中有Fe(Ⅲ)。将生成的气体通过灼热CuO,若黑色固体变为红色,证明生成的气体中含有CO。 答案:(1) (2)CaFe(CO3)2 CaFe(CO3)2CaO+FeO+2CO2↑ (3)4Fe(OH)2+O2+2H2O===4Fe(OH)3 (4)2FeO+CO2Fe2O3+CO 检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变为红色 抓住“特殊反应条件”作为突破口 反应条件 反应方程式 高温 ①CaCO3CaO+CO2↑; ②SiO2+CaCO3CaSiO3+CO2↑; ③SiO2+Na2CO3Na2SiO3+CO2↑; ④SiO2+CaOCaSiO3; ⑤SiO2+2CSi+2CO↑; ⑥C+H2O(g)CO+H2; ⑦CO+H2O(g)CO2+H2; ⑧3Fe+4H2O(g)Fe3O4+4H2; ⑨2Al+Fe2O32Fe+Al2O3 高温、高压 和催化剂 N2+3H22NH3 加热、 催化剂 ①4NH3+5O24NO+6H2O; ②2SO2+O22SO3 电解 ①2NaCl+2H2O2NaOH+H2↑+Cl2↑; ②2H2O2H2↑+O2↑; ③2Al2O3(熔融)4Al+3O2↑ [对点练] 3.如图所示为A、B、C、D、E五种含氮物质之间的相互转化关系。 (1)写出各物质的化学式: B_________,C_________,D_________,E_________。 (2)写出各步反应的化学方程式。 ①D→C:____________________________________________________________。 ②B→E:_____________________________________________________________。 ③E→C:(写离子方程式)________________________________________。 解析:(1)A与氢气在高温、高压、催化剂作用下发生反应合成氨气,A为氮气,氮气在放电的条件下可以和氧气发生反应生成一氧化氮,一氧化氮能和氧气化合为红棕色的二氧化氮气体,氨气的催化氧化产物是一氧化氮和水,二氧化氮可以和水发生反应生成硝酸和一氧化氮,金属铜可以和稀硝酸发生反应生成硝酸铜、一氧化氮和水。所以A、B、C、D、E分别是N2、NO2、NO、NH3、HNO3。(2)①D→C是氨气的催化氧化,产物是一氧化氮和水,即4NH3+5O24NO+6H2O。②B→E是二氧化氮和水反应生成硝酸和一氧化氮,即3NO2+H2O===2HNO3+NO。③E→C是铜和稀硝酸反应生成一氧化氮、硝酸铜和水,反应的离子方程式为3Cu+8H++2NO===3Cu2++2NO↑+4H2O。 答案:(1)NO2 NO NH3 HNO3 (2)①4NH3+5O24NO+6H2O ②3NO2+H2O===2HNO3+NO ③3Cu+8H++2NO===3Cu2++2NO↑+4H2O 抓住“特殊数据”作为突破口 (1)常见10电子微粒及相互转化关系 分子 Ne、HF、H2O、NH3、CH4 阳离子 Na+、Mg2+、Al3+、NH、H3O+ 阴离子 F-、O2-、N3-、OH-、NH 其相互转化关系为NH+OH-NH3↑+H2O;H3O++OH-===2H2O (2)常见18电子微粒 分子 Ar、HCl、H2S、PH3、SiH4、H2O2、N2H4、F2 阳离子 K+、Ca2+ 阴离子 Cl-、S2-、P3-、O 有机物 CH3OH、CH3NH2、CH3F、CH3CH3 (3)常见物质的相对分子质量 相对分子质量 物质 28 CO、N2、C2H4 26 C2H2 32 S、O2 78 Na2S、Na2O2、Al(OH)3 100 CaCO3、KHCO3、Mg3N2 [对点练] 4.如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是( ) A.常温下,单质a呈气态 B.单质c具有强氧化性 C.稳定性:d>e D.f受热易分解为d和e 解析:选C a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,则b一定是H2。分子中所含原子个数:d>e,f为离子化合物,因此f一定是铵盐,则a是N2,c是F2,d是NH3,e是HF,f是NH4F。常温下N2 是气体,A正确;F是最活泼的非金属元素,因此单质氟具有强氧化性,B正确;非金属性是F强于N元素,故氢化物稳定性是HF强于NH3,C不正确;铵盐受热易分解,因此NH4F受热分解生成NH3和HF,D正确。 抓住“特殊转化关系”作为突破口 (1)直线型转化关系 ①金属碱性氧化物碱盐型, 满足此关系的有 K、Na、Ca、Ba等。 ②非金属酸性氧化物酸盐型, 满足此关系的有C、N、S等。 ③ABC(酸或碱)型, 满足此关系的有NH3、N2、S、H2S、C、Na等。 (2)交叉型转化关系 (3)三角型转化关系 (4)置换反应型反应关系 化合物A+单质B―→化合物C+单质D 这类反应主要有: CO2+2Mg2MgO+C; Fe2O3+3H22Fe+3H2O; Fe+2HCl===FeCl2+H2↑; C+H2O(g)CO+H2; 3Fe+4H2O(g)Fe3O4+4H2。 [对点练] 5.表中各组物质之间不可以通过一步反应实现如图所示转化关系的是( ) 选项 X Y Z 箭头旁所标数字代表的反应条件 A Na2O2 NaOH NaCl ①常温遇水 B Al2O3 NaAlO2 Al(OH)3 ②通入CO2 C NO NO2 HNO3 ④加入铜粉 D Cl2 NaClO HClO ③加浓盐酸 解析:选A 氯化钠不能通过一步反应得到过氧化钠,故A符合题意;氧化铝与氢氧化钠溶液反应生成偏铝酸钠,向偏铝酸钠溶液中通入二氧化碳,二者反应生成氢氧化铝,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠,氢氧化铝受热分解生成氧化铝,各物质之间通过一步反应可以实现转化,故B不符合题意;一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,稀硝酸与铜反应生成一氧化氮,浓硝酸与铜反应生成二氧化氮,各物质之间通过一步反应可以实现转化,故C不符合题意;氯气与氢氧化钠溶液反应生成次氯酸钠,次氯酸钠与碳酸反应生成次氯酸,次氯酸与氢氧化钠溶液反应生成次氯酸钠,次氯酸与浓盐酸反应生成氯气,各物质之间通过一步反应可以实现转化,故D不符合题意。查看更多