- 2021-06-23 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】百师联盟2020届高三下学期开年联考(山东卷)
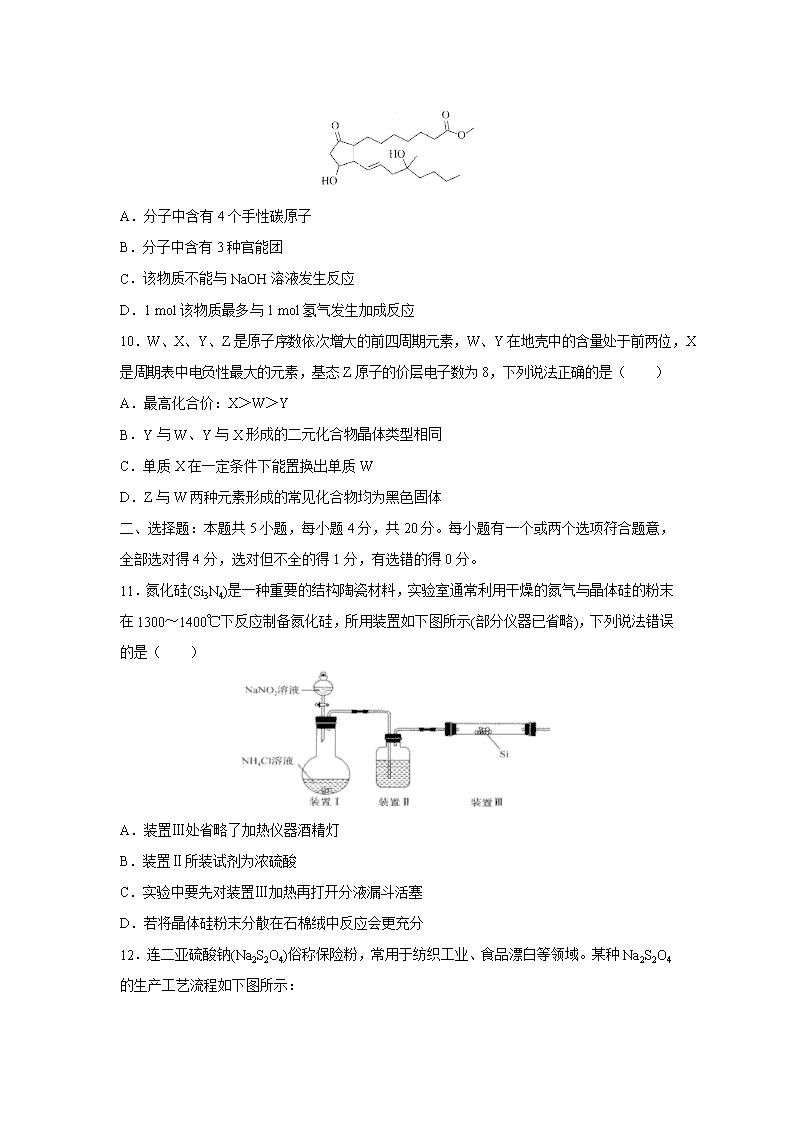
百师联盟2020届高三下学期开年联考(山东卷) 可能用到的相对原子质量:H—l C—12 N—14 O—16 Na—23 S—32 Fe—56 Cu—64 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1.《石灰吟》是明代名臣、文学家于谦创作的一首七言绝句:千锤万凿出深山,烈火焚烧若等闲。粉骨碎身浑不怕,要留清白在人间。该诗中没有涉及到的反应类型是( ) A.置换反应 B.氧化还原反应 C.放热反应 D.吸热反应 2.下列各族的基态原子中未成对电子数不可能等于2的是( ) A.ⅣA族 B.ⅡA族 C.Ⅷ族 D.ⅣB族 3.物质M的分子式为C4H9Cl,其核磁共振氢谱如右图所示,下列说法错误的是( ) A.M的结构简式是C(CH3)3Cl B.M中所含极性最强的化学键是C—C1 C.M与NaOH的乙醇溶液混合加热生成的有机物有两种不同的结构 D.M与NaOH的水溶液混合加热,M分子内只断开C—C1键 4.检验并提取海带中碘的实验中涉及多种基本实验操作,下列相关叙述正确的是( ) A.灼烧海带时要用到蒸发皿、酒精灯等仪器 B.海带灰溶解和过滤的操作都要用到玻璃棒且作用不同 C.氧化I-时用浓硝酸代替稀硫酸和H2O2溶液效果更好 D.用CCl4萃取I2后要进行分液,有机层从分液漏斗上口倒出 5.实验室常用氟化钙固体和浓硫酸混合加热制HF:CaF2+H2SO4(浓)CaSO4+2HF↑。下列关于该反应的说法错误的是( ) A.该反应利用了浓硫酸的酸性和难挥发性 B.CaF2晶体中Ca2+和F-的配位数之比为1:2 C.影响H2SO4和CaSO4熔点的作用力不同 D.HF是极性分子且分子极性强于HC1 6.NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A.32g18O3中含有的质子数目为16NA B.1 L pH=2的HF溶液中所含的H+和F-的数目均为0.01NA C.2.3 g Na与一定量的氧气反应后所得固体质量为2.8g,转移电子数目为0.1NA D.16 g CH4与氯气光照完全反应生成氯代烃的分子数目为NA 7.根据下列实验操作和现象所得到的结论正确的是( ) 选项 实验操作和现象 实验结论 A 向NaHS溶液中加入盐酸产生大量气泡 氯的非金属性强于硫 B 向溶液中加盐酸酸化的氯化钡溶液产生白色沉淀 原溶液中一定含 C 将铁片和铜片用导线连接后插入浓硝酸,铁片表面产生气泡 铜的活泼性强于铁 D 常温下测得CH3COONH4溶液pH=7 相同温度下CH3COOH和NH3· H2O电离常数相同 8.已知NH4NO3的分解产物与温度有关: NH4NO3NH3↑+HNO3↑ ① NH4NO3N2O↑+2H2O↑ ② 2NH4NO32N2↑+O2↑+4X↑ ③ 4NH4NO33N2↑+2NO2↑+8H2O↑ ④ 下列说法错误的是( ) A.四个反应中有三个是氧化还原反应 B.反应②所得混合气体的相对分子质量是26.7 C.反应③中X的化学式是H2O D.反应④的氧化产物是N2,还原产物是NO2 9.Misoprostol是一种合成的前列腺素E1类似物,可用于口服治疗胃溃疡,其结构如下图所示,下列关于Misoprostol的说法正确的是( ) A.分子中含有4个手性碳原子 B.分子中含有3种官能团 C.该物质不能与NaOH溶液发生反应 D.1 mol该物质最多与1 mol氢气发生加成反应 10.W、X、Y、Z是原子序数依次增大的前四周期元素,W、Y在地壳中的含量处于前两位,X是周期表中电负性最大的元素,基态Z原子的价层电子数为8,下列说法正确的是( ) A.最高化合价:X>W>Y B.Y与W、Y与X形成的二元化合物晶体类型相同 C.单质X在一定条件下能置换出单质W D.Z与W两种元素形成的常见化合物均为黑色固体 二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。 11.氮化硅(Si3N4)是一种重要的结构陶瓷材料,实验室通常利用干燥的氮气与晶体硅的粉末在1300~1400℃下反应制备氮化硅,所用装置如下图所示(部分仪器已省略),下列说法错误的是( ) A.装置Ⅲ处省略了加热仪器酒精灯 B.装置Ⅱ所装试剂为浓硫酸 C.实验中要先对装置Ⅲ加热再打开分液漏斗活塞 D.若将晶体硅粉末分散在石棉绒中反应会更充分 12.连二亚硫酸钠(Na2S2O4)俗称保险粉,常用于纺织工业、食品漂白等领域。某种Na2S2O4的生产工艺流程如下图所示: 若在实验室模拟该工艺流程,下列说法错误的是( ) A.将锌粉投入水中形成悬浮液主要是为了加快反应速率 B.向Na2S2O4溶液中加NaCl溶液或固体对Na2S2O4的产率无明显影响 C.洗涤Na2S2O4·2H2O时用冰水效果好于常温蒸馏水 D.该流程中涉及化合反应、分解反应、复分解反应,不涉及氧化还原反应 13.全钒液流电池是一种新型储能电池,具有充放电可逆性高、能量转化效率高等优点,其结构如下图所示,放电时电极a发生氧化反应。下列说法错误的是( ) A.充电时电极a应连接电源的负极 B.放电时电极b发生的反应为+e-+2H+ VO2++H2O C.放电时电极a附近溶液pH不发生变化 D.充电时H+从质子交换膜右侧向左侧移动 14.物质X在一定条件下可转化为物质Y或物质Z: 两个反应的能量变化如右图所示,下列说法正确的是( ) A.两个反应均为放热反应 B.X、Y、Z的关系是互为同素异形体或同分异构体 C.X转化为Y的活化能高于X转化为Z的活化能 D.其它条件一定,加压有利于提高X转化为Z的速率和平衡转化率 15.常温下向10 mL 0.1mol/L的NaCN溶液中滴加等浓度的盐酸(忽略体积和温度变化), δ(HCN)和随溶液pH变化的图像如右图所示,下列说法错误的是( ) A.常温下HCN的电离常数为l0-9.2 B.pH为9.2时,加入盐酸的体积大于5 mL C.pH为a时溶液中c(Cl-)大于pH为b时溶液中c(Cl-) D.滴加过程中可能出现:c(Na+)>c(CN-)>c(OH-)>c(Cl-)>c(H+) 三、非选择题:本题包括5小题,共60分。 16.(10分)氢氧化锂(LiOH)是重要的初加工锂产品之一,可用于继续生产氟化锂、锰酸锂等,在实验室模拟用天然锂辉石(主要成分是LiAlSi2O6)生产LiOH的一种工艺流程如下图所示: 已知:溶液1中含有Li+、K+、Al3+、Na+、Fe3+、等离子。请回答下列相关问题。 (1)高温烧结的目的是________________________________________________。 (2)操作1是_____________________________。 (3)判断LiOH已洗涤干净的操作是______________________________________________。 (4)工业生产中通过电解LiC1溶液的方法也可制得LiOH,其原理如下图所示,电极a应连接电源的_________(选填“正极”或“负极”),电极b发生的反应是__________,阳离子交换膜的作用是_________________________________。 17.(12分)黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。请回答下列问题。 (1)Fe2+的电子排布式是____________________________。 (2)液态SO2可发生自偶电离,SO2属于_____________(选填“极性分子”或“非极性分子”),的空间构型是___________________。 (3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有_______种。 (4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____________。乙硫醇的沸点比乙醇的沸点低,原因是______________________________________________ _______________________________________________。 (5)黄铜矿主要成分X的晶胞结构及晶胞参数如右图所示,X的化学式是______________ ,其密度为_____________g/cm3(阿伏加德罗常数的值用NA表示)。 18.(13分)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种绿色晶体,易溶于水,难溶于乙醇等有机溶剂,光照或受热易分解。实验室要制备K3[Fe(C2O4)3]·3H2O并测定的含量。请回答下列相关问题。 Ⅰ.FeC2O4·2H2O的制备 向烧杯中加入5.0 g (NH4)2Fe(SO4)2·6H2O、15 mL蒸馏水、1 mL 3 moL/L的硫酸,加热溶解后加入25 mL饱和H2C2O4溶液,继续加热并搅拌一段时间后冷却,将所得FeC2O4·2H2O晶体过滤、洗涤。 (1)制备FeC2O4·2H2O时,加入3 mol/L硫酸的作用是________________________。 Ⅱ.K3[Fe(C2O4)3]·3H2O的制备 向Ⅰ中制得的FeC2O4·2H2O晶体中加入10 mL饱和K2C2O4溶液,水浴加热至40℃,缓慢加入过量3%的H2O2溶液并不断搅拌,溶液中产生红褐色沉淀,H2O2溶液完全加入后将混合物加热煮沸一段时间,然后滴加饱和H2C2O4溶液使红褐色沉淀溶解。向溶液中再加入10 mL无水乙醇,过滤、洗涤、干燥。 (2)制备过程中有两个反应会生成K3[Fe(C2O4)3],两个化学方程式依次是:______________ ___________________________、2Fe(OH)3+3K2C2O4+3H2C2O4 2K3[Fe(C2O4)3]+6H2O。 (3)H2O2溶液完全加入后将混合物加热煮沸一段时间的目的是______________________。 Ⅲ.含量的测定 称取0.22 gⅡ中制得的K3[Fe(C2O4)3]·3H2O晶体于锥形瓶中,加入50 mL蒸馏水和15 mL 3 mol/L的硫酸,用0.02000 mol/L的标准KMnO4溶液滴定,重复3次实验平均消耗的KMnO4溶液体积为25.00 mL。 (4)滴定时KMnO4溶液应盛放在_____________(填仪器名称)中,判断滴定终点的依据是______________________________________________。 (5)滴定终点时,所得溶液中的溶质除硫酸外,还有__________________________(写化学式), K3[Fe(C2O4)3]·3H2O样品中的质量分数是____________________。 19.(11分)乙烯是用途最广泛的基本有机原料,可用于生产塑料、合成橡胶等产品。工业上可用乙烷、二氧化碳、甲醇、乙醇等为原料制乙烯。请回答下列相关问题。 (1)已知H2、C2H4、C2H6的燃烧热依次是286 kJ/mol、1411 kJ/mol、1560 kJ/mol,乙烷热裂解制乙烯的热化学方程式是,则=_______________。 (2)工业上用乙烷热裂解制乙烯时,通常会在保持起始压强不变的情况下用水蒸气对乙烷稀释以提高平衡转化率,其原理是______________________________________________。 向温度为1015 K、体积为5 L的刚性容器中充入0.03 mol水蒸气和0.06 mol乙烷,起始压强为0.15 MPa,30 s后体系达到平衡,乙烷的平衡转化率为60%,则建立平衡的过程中平均反应速率v(H2)=______________mol/(L·s),的平衡常数KP=_______________MPa。 (3)二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如下图所示,从生产低级烯烃的角度考虑,最合适的反应温度是___________。资料显示原料气中时,随着的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________ ________________________________________________________。 20.(14分)华法林(物质F)是一种香豆素类抗凝剂,在体内有对抗维生素K的作用,可用于预防血栓栓塞性疾病。某种合成华法林的路线如下图所示。请回答下列相关问题。 (1)华法林的分子式是_________________。物质E中的含氧官能团名称是_____________。 (2)A→B的氧化剂可以是__________(填标号)。 a.银氨溶液 b.氧气 c.新制Cu(OH)2悬浊液 d.酸性KmnO4溶液 (3)C→D的化学方程式是_______________________________________________。 (4)E→F的反应类型是______________________。 (5)物质C的同分异构体中符合下列条件的有________________种(不考虑立体异构)。 ①含有苯环;②苯环上有两个取代基;③含有-COO-结构且不含甲基 (6)以 和(CH3CO)2O为原料制备,写出合成路线(无机试剂任选) 【参考答案】查看更多