- 2021-06-22 发布 |
- 37.5 KB |
- 11页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
北京专版2020中考化学复习方案主题三身边的化学物质第07课时溶液试题
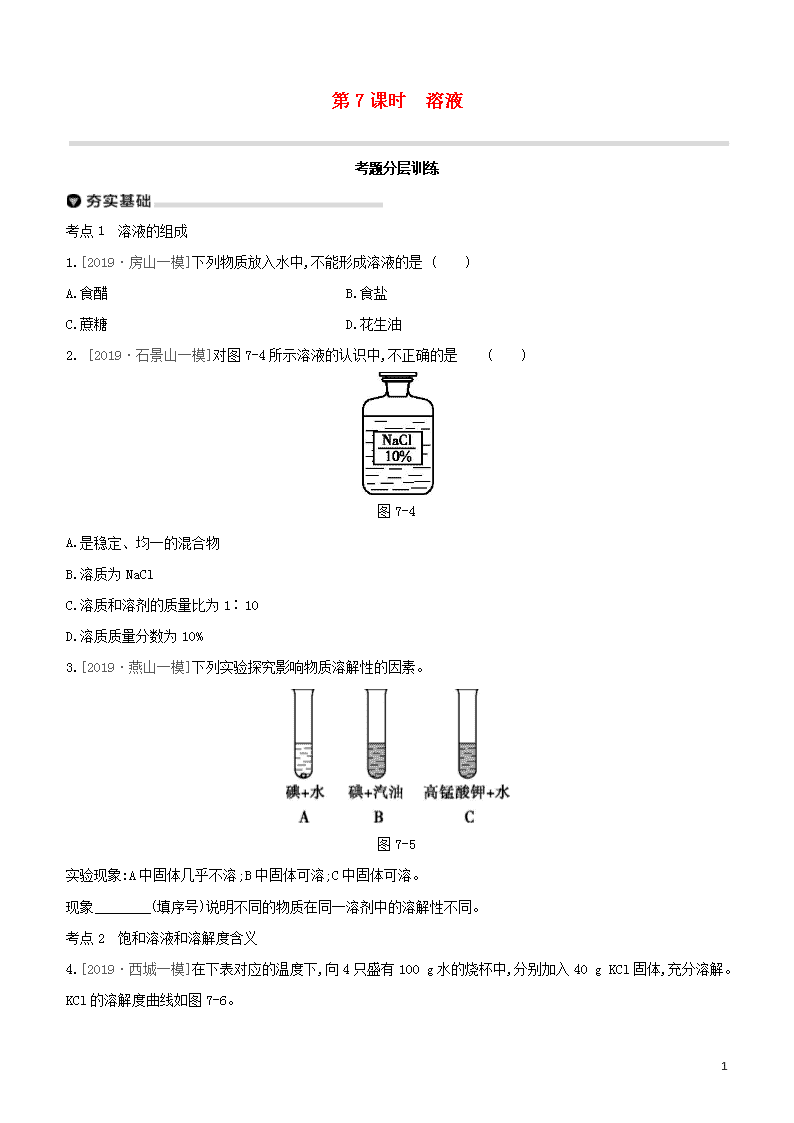
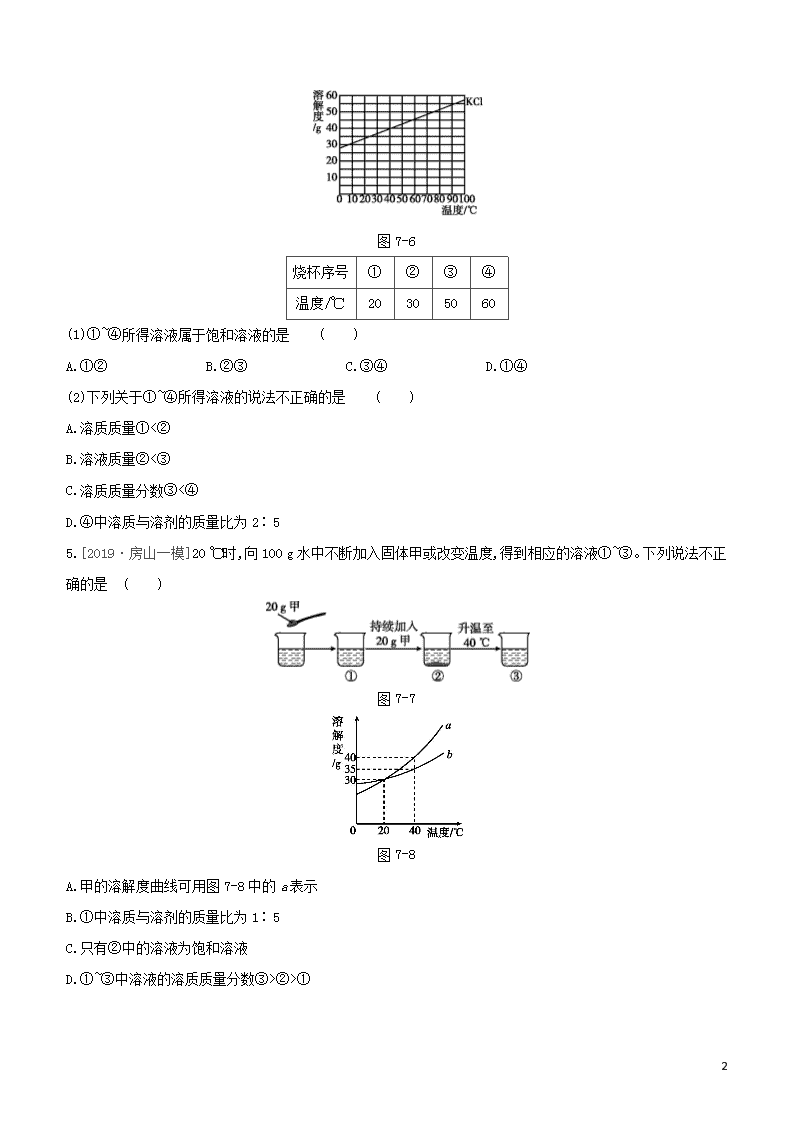
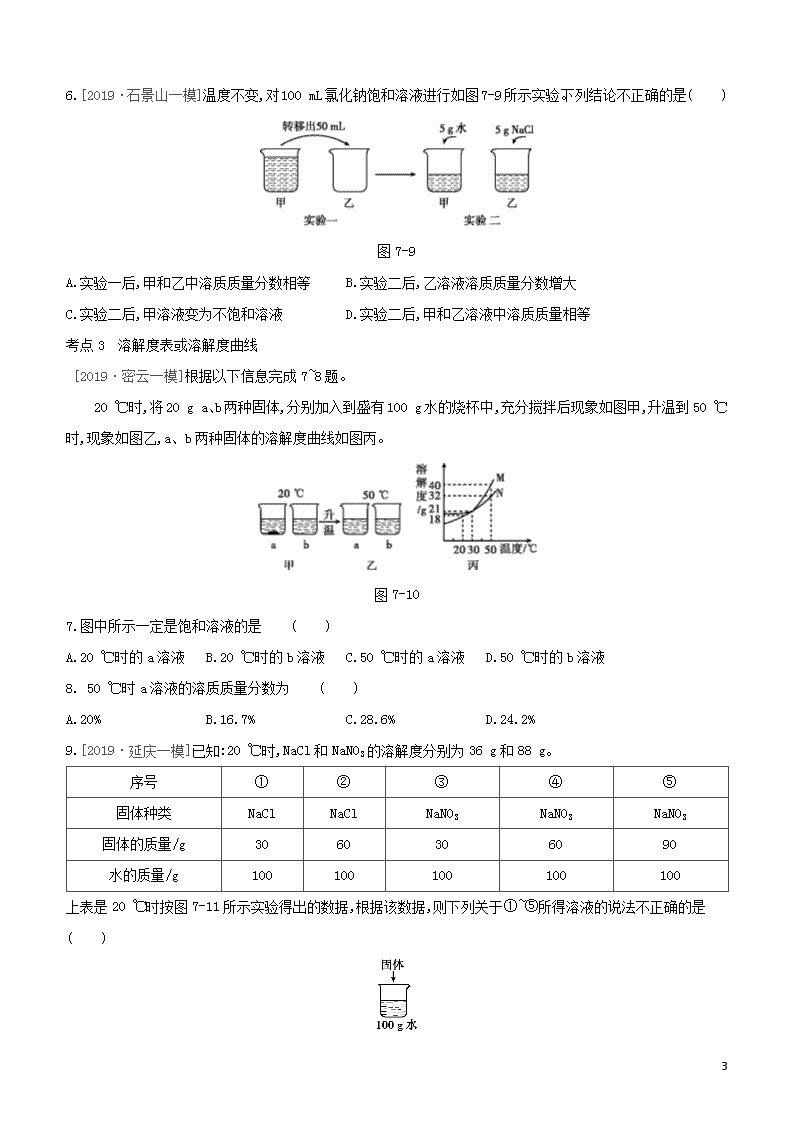
第7课时 溶液 考题分层训练 考点1 溶液的组成 1.[2019·房山一模]下列物质放入水中,不能形成溶液的是 ( ) A.食醋 B.食盐 C.蔗糖 D.花生油 2. [2019·石景山一模]对图7-4所示溶液的认识中,不正确的是 ( ) 图7-4 A.是稳定、均一的混合物 B.溶质为NaCl C.溶质和溶剂的质量比为1∶10 D.溶质质量分数为10% 3.[2019·燕山一模]下列实验探究影响物质溶解性的因素。 图7-5 实验现象:A中固体几乎不溶;B中固体可溶;C中固体可溶。 现象 (填序号)说明不同的物质在同一溶剂中的溶解性不同。 考点2 饱和溶液和溶解度含义 4.[2019·西城一模]在下表对应的温度下,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解。KCl的溶解度曲线如图7-6。 11 图7-6 烧杯序号 ① ② ③ ④ 温度/℃ 20 30 50 60 (1)①~④所得溶液属于饱和溶液的是 ( ) A.①② B.②③ C.③④ D.①④ (2)下列关于①~④所得溶液的说法不正确的是 ( ) A.溶质质量①<② B.溶液质量②<③ C.溶质质量分数③<④ D.④中溶质与溶剂的质量比为2∶5 5.[2019·房山一模]20 ℃时,向100 g水中不断加入固体甲或改变温度,得到相应的溶液①~③。下列说法不正确的是 ( ) 图7-7 图7-8 A.甲的溶解度曲线可用图7-8中的a表示 B.①中溶质与溶剂的质量比为1∶5 C.只有②中的溶液为饱和溶液 D.①~③中溶液的溶质质量分数③>②>① 11 6.[2019·石景山一模]温度不变,对100 mL氯化钠饱和溶液进行如图7-9所示实验。下列结论不正确的是( ) 图7-9 A.实验一后,甲和乙中溶质质量分数相等 B.实验二后,乙溶液溶质质量分数增大 C.实验二后,甲溶液变为不饱和溶液 D.实验二后,甲和乙溶液中溶质质量相等 考点3 溶解度表或溶解度曲线 [2019·密云一模]根据以下信息完成7~8题。 20 ℃时,将20 g a、b两种固体,分别加入到盛有100 g水的烧杯中,充分搅拌后现象如图甲,升温到50 ℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。 图7-10 7.图中所示一定是饱和溶液的是 ( ) A.20 ℃时的a溶液 B.20 ℃时的b溶液 C.50 ℃时的a溶液 D.50 ℃时的b溶液 8. 50 ℃时a溶液的溶质质量分数为 ( ) A.20% B.16.7% C.28.6% D.24.2% 9.[2019·延庆一模]已知:20 ℃时,NaCl和NaNO3的溶解度分别为36 g和88 g。 序号 ① ② ③ ④ ⑤ 固体种类 NaCl NaCl NaNO3 NaNO3 NaNO3 固体的质量/g 30 60 30 60 90 水的质量/g 100 100 100 100 100 上表是20 ℃时按图7-11所示实验得出的数据,根据该数据,则下列关于①~⑤所得溶液的说法不正确的是( ) 11 图7-11 A.溶质质量:②=④ B.溶液质量:①<② C.溶质质量分数:①=③ D.⑤中溶质与溶剂的质量比为22∶25 10.[2019·平谷一模]如图7-12所示,在分别盛有100 g水的烧杯中放入KNO3充分溶解,则说法正确的是( ) 温度/℃ t1 t2 KNO3的溶解度/g 60 90 图7-12 A.甲、乙、丙均为饱和溶液 B.乙升温至t2 ℃,溶液质量增加 C.甲、乙、丙溶液中溶质质量相等 D.丙溶液的溶质质量分数是60% 11.[2019·燕山一模]KCl和KNO3在不同温度下的溶解度数据如表所示,下列说法中正确的是( ) 温度/℃ 20 40 60 溶解度/g KCl 33 38 45 KNO3 31 64 110 A.KNO3的溶解度始终大于KCl B.60 ℃时,110 g KNO3完全溶解最少需要100 g 水 C.20 ℃时,KCl饱和溶液的溶质质量分数是33% D.随着温度的升高,某不饱和KCl溶液会变饱和 12.[2019·门头沟一模]图7-13是a、b两种固体物质的溶解度曲线。下列说法中不正确的是( ) 图7-13 A.a物质的溶解度随温度的升高而增大 B.t2 ℃时a物质的溶解度比b物质的溶解度大 C.M点表示在t1 ℃时a、b两种物质的溶解度相等 D.t2 ℃时,将55 g的a物质放入到100 g水中,充分溶解,得到155 g溶液 11 13.[2019·通州一模]t2 ℃时,将甲、乙各80 g分别放到盛有100 g水的两个烧杯中,充分溶解后,恢复到t2 ℃,现象如图7-14①,甲和乙的溶解度曲线如图②。请结合图示回答下列问题。 图7-14 (1)能说明固体甲对应的溶解度曲线是a的证据是 。 (2)下列关于t2 ℃时,甲、乙所得溶液的说法不正确的是 (填序号)。 A.溶质质量:甲<乙 B.乙为饱和溶液 C.溶质质量分数:甲=乙 D.将溶液降温至t1 ℃时,甲、乙的溶解度相等 1. 下列有关溶液的说法正确的是 ( ) A.长期放置不分层的液体一定是溶液 B.溶质可以是固体,也可以是液体或气体 C.降低饱和溶液的温度,一定有晶体析出 D.配制好的6%的NaCl溶液,装入试剂瓶中时不慎洒出一部分,溶液浓度减小 2.甲、乙两种固体物质的溶解度曲线如图7-15所示,下列有关表述正确的是 ( ) 图7-15 A.t2 ℃时,甲、乙两溶液中溶质的质量分数一定相等 B.t1 ℃时,分别将10 g甲和10 g乙配制成饱和溶液,前者需要水的质量较多 C.将t2 ℃时乙的饱和溶液变为不饱和溶液,可采取降温的方法 D.将甲、乙的饱和溶液分别由t2 ℃降温至t1 ℃,析出晶体甲多 11 3.甲、乙两种物质的溶解度曲线如图7-16所示。下列说法不正确的是 ( ) 图7-16 A.10 ℃时,甲、乙两种物质的溶解度相同 B.20 ℃时,把30 g甲加入50 g水中,得到70 g溶液 C.将20 ℃时的甲、乙饱和溶液升温至30 ℃,甲、乙溶液中溶质的质量分数均不变 D.将30 ℃时甲的饱和溶液降温至10 ℃,析出甲固体40 g 4.20 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表: 实验小组 第一组 第二组 第三组 第四组 水的质量/g 50 50 50 50 所取NaCl的质量/g 15 20 25 30 剩余NaCl的质量/g 0 2 7 12 下列说法错误的是 ( ) A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl B.用蒸发的方法可以使不饱和溶液变成饱和溶液 C.第二组所得溶液的溶质与溶剂的质量比为9∶25 D.相同温度下,NaCl在水里的溶解度与水的质量无关 5.已知氯化钾、硝酸钾在不同温度时的溶解度如下表: 温度/℃ 0 20 40 60 溶解度/g 氯化钾 27.6 34.0 40.0 45.5 硝酸钾 13.3 31.6 63.9 110.0 图7-17 依据上表数据和溶解度曲线判断,下列说法错误的是 ( ) 11 A.能表示硝酸钾和氯化钾溶解度的曲线分别是甲和乙 B.t1℃时,氯化钾和硝酸钾的溶解度相等,在 34.0 g 至 35.0 g 之间 C.t2℃时,将接近饱和的丙物质的溶液升高温度,可使其变成饱和溶液 D.氯化钾中混有少量的硝酸钾,可采用降温结晶的方法提纯 6.如图7-18是两种固体的溶解度曲线。 图7-18 (1)40 ℃时,氯化钠的溶解度 (填“>”“<”或“=”)硝酸钾的溶解度。 (2)硝酸钾的溶解度随温度的升高而 。 (3)若将饱和的硝酸钾溶液从40 ℃降温到10 ℃, (填“有”或“无”)晶体析出。 (4)20 ℃时,某实验小组取不同质量的硝酸钾,分别加入到100 g水中,充分溶解后,所得溶液的质量与加入硝酸钾的质量对应关系如表: 实验一 实验二 实验三 实验四 硝酸钾的质量/g 20.0 25.0 30.0 35.0 所得溶液的质量/g 120.0 125.0 130.0 131.6 根据上表数据,实验二所得的溶液为 (填“饱和”或“不饱和”)溶液;20 ℃时,硝酸钾的溶解度为 g。 7.溶液在日常生活、工业生产和科学研究中具有广泛用途。 (1)溶质质量分数为3%的KNO3溶液常用作无土栽培的营养液,配制100 g该营养液需要的溶质是 ,其质量为 g,配制时常用玻璃棒搅拌,目的是 。 (2)某KNO3固体(混有少量NaCl),要用它配制上述营养液,需在配制前进行提纯(图7-19甲为溶解度曲线)。60 ℃时,KNO3的溶解度为 g,将该固体溶于水配制为接近饱和的溶液,可采用降温结晶的方法提纯KNO3,其理由是 。 11 图7-19 (3)探究温度对溶解度的影响,如图乙所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20 ℃ Y的饱和溶液(有少量Y的固体剩余)。往试管中滴加适量水,烧杯中固体逐渐消失,写出X与Y可能的组合: 。 8.将NaOH、NaCl、NH4NO3固体各10 g分别放入盛有100 mL水的烧杯中充分溶解。在不同时间测量溶液的温度,绘制成如下图像: 图7-20 分析图像,回答问题。 (1)在NaOH、NaCl、NH4NO3三种物质中,溶解时出现吸热现象的是 (写名称)。 (2)对NaOH而言,a点右侧曲线表示:在一定时间段内,溶液温度随时间推移而 (填“升高”或“降低”),其原因是 。 11 【参考答案】 夯实基础 1.D [解析]溶液是一种或几种物质分散到另一种物质中形成的均一、稳定的混合物。食醋、食盐和蔗糖溶于水能形成均一、稳定的混合物,即能形成溶液;花生油不能和水相互溶解,不能形成均一、稳定的混合物,形成的是乳浊液。 2.C [解析]溶液是均一、稳定的混合物,故A正确;固体溶于液体时,固体是溶质,液体是溶剂,所以氯化钠属于溶质,故B正确;溶质和溶剂的质量比是1∶9,故C错误;由标签中内容可知溶质质量分数为10%,故D正确。 3.A、C 4.(1)A [解析]由溶解度曲线可知20 ℃、30 ℃时氯化钾的溶解度均小于40 g,50 ℃、60 ℃时氯化钾的溶解度大于40 g,向4只盛有100 g水的烧杯中,分别加入40 g KCl固体,充分溶解,则①~④所得溶液属于饱和溶液的是①②,③④属于不饱和溶液。 (2)C [解析]因为氯化钾的溶解度随温度的升高而增大,所以30 ℃的溶解度大于20 ℃的溶解度,溶质质量①<②,故选项A正确;50 ℃的溶解度大于30 ℃的溶解度,50 ℃时加入的40 g KCl固体完全溶解,溶液质量②<③,故选项B正确;③④溶液中溶质质量均为40 g,溶质质量分数③=④,故选项C不正确;④中溶质与溶剂的质量比为40 g∶100 g=2∶5,故选项D正确。 5.C [解析]根据溶解度曲线可知,40 ℃时,a曲线上对应的溶解度为40 g,而40 ℃时40 g的甲物质完全溶解,则甲的溶解度曲线可用a表示;①中溶质与溶剂的质量比为20 g查看更多